
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Biologie
|
|
Qdidactic » didactica & scoala » biologie Stresul oxidativ |
Stresul oxidativ
Stresul oxidativ
1.Generalitati
Radicalii liberi sunt compusi reactivi produsi in mod natural in corpul uman. Ei pot exercita efecte pozitive (asupra sistemului imunitar) sau negative (oxidarea lipidelor, proteinelor sau ADN-ului). Pentru a limita aceste efecte daunatoare, un organism necesita o protectie complexa reprezentata de sistemul antioxidant. Acest sistem este constituit din antioxidanti enzimatici (catalaza, glutation peroxidaza, superoxid dismutaza) si antioxidanti neenzimatici (vitamina E-tocoferol, vitamina A-retinol, vitamina C-acidul ascorbic, glutationul si acidul uric). Dezechilibrul intre producerea radicalilor liberi si apararea antioxidanta duce la o stare de stres oxidativ, care poate fi implicata in procesul de imbatranire si chiar in anumite stari patologice (cancerul sau boala Parkinson).
Radicalii liberi, care sunt produsi in cantitati mari in timpul exercitiului fizic [Cooper CE., Vollaard NBJ., Choueiri T. si colab., 2002], sunt implicati in oboseala musculara, imbatranire si multe boli [Lachance PA. si colab., 2001], [Golden TR. si colab., 2002]. Totusi, ei exercita efecte pozitive asupra sistemului imunitar si asupra functiilor metabolice esentiale [Thomas MJ., 2002]. Antioxidantii sunt componente care supreseaza radicalii liberi si efectele lor daunatoare. Daca productia de radicali liberi este mai mare decat activitatea antioxidanta, atunci exista o stare de stres oxidativ corelata cu lezarea celulelor [Sen CK., 2001
Radicalii liberi sunt molecule sau fragmente moleculare cu unu sau mai multi electroni neimperecheati in structura lor [Jenkins RR., 1988 Cheeseman KH., Slater TF., 1993 Rimbach G., Hohler D., Fischer A. si colab., 1999]. Radicalii liberi sunt foarte instabili si reactivi deoarece acestia tind sa preia un electron de la alte molecule (oxidare) [Sen CK., 2001 Prior RL., Cao G., 1999]. Timpul lor de viata este foarte scurt (de la cateva nanosecunde la cateva milisecunde). Cand reactioneaza cu alti radicali sau molecule, un radical liber poate forma alti radicali [Sen CK., 2001 Capacitatea neobisnuita a radicalilor de a interactiona cu alti compusi alterandu-i este data de prezenta in structura lor a cel putin un electron neimperecheat. Radicalii liberi se pot forma pe baza scindarii prin extractie cu protoni sau prin reatii de atac in serie a altor radicali.
Cele mai importante familii de radicali liberi sunt speciile reactive de oxigen (ROS = reactive oxygen species), urmate de speciile reactive de azot (RNS = reactive nitrogen species) si speciile reactive de sulf (RSS = reactive sulphur species).
Generarea excesiva de radicali liberi poate avea loc sub influenta unor factori biologici endogeni sau a unor factori exogeni, precum poluarea, radiatiile, etc. [Figura 5].
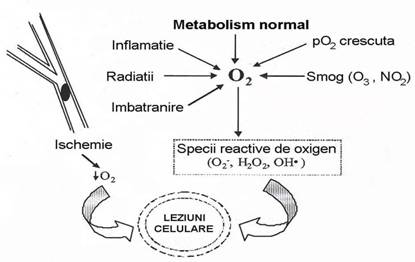
Figura 5: Surse generatoare de specii reactive de oxigen (ROS) si alti radicali liberi.
Alte modalitati de obtinere a radicalilor liberi sunt reprezentate de sistemul transportor de electroni si de enzimele existente la nivelul reticulului endoplasmic sau la nivelul membranei nucleare (monooxigenaza dependenta de citocrom P450 si citocrom reductaza dependenta de NADPH), enzime care activeaza oxigenul molecular. Celulele fagocitare implicate in raspunsul inflamator ca neutrofilele, macrofagele si monocitele pot genera specii reactive de oxigen (ROS) [Yu BP., 1994; Stoian I. si colaboratorii., 1996; Younes M., 1999]. Ischemia si arteroscleroza pot genera nivele ridicate de specii reactive de oxigen, acelasi efect observandu-se si in cazul inhibitiei sau reducerii activitatii enzimelor antioxidante, organismul fiind astfel incapabil de a contracara efectul de crestere a nivelului radicalilor liberi.
2.Clasificarea radicalilor liberi
Din punct de vedere al naturii elementului care contine electroni neimperecheati, radicalii liberi pot fi clasificati in:
radicali liberi ai oxigenului
radicali liberi ai azotului
compusi aromatici
compusi de tip chinonic si semichinonic
acizi nucleici
radicalul tiol
Radicalii liberi ai oxigenului. Speciile reactive de oxigen (ROS), din care fac parte radicalul hidroxil (.OH), anionul superoxid (O2.-), oxigenul singlet (1O2) si peroxidul de hidrogen (H2O2) se formeaza ca o consecinta a metabolismului aerob al celulei [Wiseman H., Halliwell B, 1996]. Antioxidantii celulari detoxifica organismul de aceste specii reactive, dar in cazul in care acest echilibru se modifica se poate declansa stresul oxidativ la nivel celular. Acest fenomen provoaca leziuni la nivel celular si tisular, modificari ale membranei plasmatice (peroxidarea lipidelor, modificarea influxului de calciu), a mitocondriei (producand liza), a proteinelor solubile, a glucidelor si la nivelul macromoleculei ADN. In cazul in care stresul oxidativ persista, la nivel celular apar modificari oxidative ale biomoleculelor (inclusiv la nivelul genomului) avand ca rezultat mutageneza si chiar moartea celulara [Hunt CR. si colaboratorii, 1998; Mills EM. si colaboratorii, 1998].
Sediul celular al respiratiei si de producere a energie este mitocondria [Figura 6]. La acest nivel se produc cele mai intime procese catabolice ale organimului, ce rezulta in formarea de ATP, principalele molecule ce asigura necesarul energetic celular. In cadrul mitocondriei are loc catabolismul final al diferitelor tipuri de molecule (glucide, acizi grasi), iar echivalentii de reducere aparuti din aceste procese sunt transportati prin catene trasportoare de electroni reprezentate de molecule funtionale ale mitocondriei. In final electronii sunt acceptati de catre oxigenul molecular ajuns la acest nivel, iar datorita prezentei protonilor se formeaza apa. Orice disfunctie aparuta la acest nivel duce automat la dereglari metabolice profunde traduse prin aparitia unor boli grave (precum maladiile Parkinson, Alzheimer si Huntington) [Sas K. si colaboratorii, 2007].
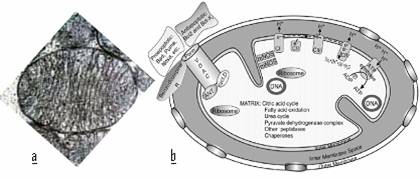
Figura 6: Mitocondria: a.in microscopie electronica; b.reprezentare schematica pentru evidentierea fungiilor
Este posibil ca in locul proteinelor din cadrul lantului respirator, sa fie redus prematur oxigenul molecular, ducand la aparitia a diferitelor ROS [Geschman R. si colaboratorii, 1954]. Acestea vor duce la oxidari secundare, nedorite, cu efectele dramatice ale stresului oxidativ. La nivelul membranei mitocondriale interne sunt produse specii reactive de oxigen de tipul superoxidului (.O2-). Exista o posibilitate de formare a superoxidului si prin actiunea NADPH oxidazei in neutrofilele sau macrofagele activate (aceasta reactie avand rol in apararea organismului gazda fata de agentii infectiosi). Este cunoscut faptul ca mitocondria reprezinta situsul principal de generare a speciilor reactive de oxigen, cum ar fi anionul superoxid, radicalul hidroxil, oxigenul singlet si peroxidul de hidrogen [Burtke TM., Sandstrom PA., 1994; Morel Y., 1999]. Se estimeaza ca intre 1 - 4% din moleculele de oxigen reactioneaza la nivelul lantului respirator mitocondrial cu formare de radicali superoxid (O2.-).
Speciile reactive de oxigen ca peroxidul de hidrogen, radicalii superoxid sau hidroxil pot aparea in conditii normale de respiratie sau prin expunerea tesutului sau celulelor la diferite conditii cum ar fi inflamatia, hiperoxia, radiatii UV si ionizante, metalele grele si anumiti oxidanti chimici.
Sursa principala endogena de specii reactive de oxigen este reprezentata de reactiile de autooxidare a unor constituenti solubili celulari cum ar fi: metaloproteinele, hemoproteinele, flavoproteinele, epinefrina, metalele tranzitionale, gruparile tiol, aceste reactii ducand la eliberarea ROS [Misra HP., Fridovich I., 1972]. O alta cale de generare a ROS (in special O2.- si OH) este reprezentata de reactiile de reducere a oxigenului molecular, catalizate de o serie de enzime citosolice ca xantin oxidaza.
Speciile reactive ale oxigenului sunt cunoscute a fi implicate in diferite mecanisme procarcinogene. O serie de studii sugereaza faptul ca speciile reactive de oxigen induc apoptoza, proces inhibat in prezenta de antioxidanti, dar au si rol in carcinogeneza prin interferenta cu diferite cascade de semnalizare, cu factori de transcriptie nucleari (NFKB), cu protein kinaze mitogen activate (MAPKs), cu fosfolipaza A2 si kinaza c. Celulele pot reactiona rapid la aparitia dezechilibrului redox prin blocarea ciclului celular si initierea procesului de reparare ADN, precum si stimularea tanscriptiei anumitor gene. Toate aceste evenimente pot determina intrarea celulei in apoptoza, necroza sau senescenta sau pot determina supravietuirea si proliferarea celulara [Limoli CL. si colaboratorii, 1998].
Speciile reactive de oxigen sunt:
Oxigenul singlet O2) - se obtine prin reactii de oxido-reducere, descompunere sau radioliza. Oxigenul singlet are un caracter electrofil, reactionand cu multi compusi organici cum sunt acizii grasi polinesaturati, colesterol, oleine formand hidroperoxizi sau cu compusi organici continand atomi de S sau N producand oxizi. Dintre antioxidanti, α-tocoferolul, carotenii si bilirubina poseda capacitatea de a stinge oxigenul in stare de singlet.
Oxigenul singlet (1O2) poate fi produs prin reactiile urmatoare:
![]()
![]()
![]()
![]()
Superoxidul (O2.-) - constituie prima etapa a activarii O2 pe calea reducerii univalente si deci se formeaza prin captarea unui electron care se plaseaza pe unul din orbitalii n de antilegatura.
Superoxidul este radicalul liber primar in sistemele biologice, fiind in echilibru cu forma sa protonata, radicalul hidroperoxil. Sursele majore ale acestor radicali provin din lantul transportor al mitocondriei si din reticulul endoplasmic. Desi anionul superoxid este relativ nereactiv in comparatie cu alti multi radicali, sistemele biologice il convertesc in specii mult mai reactive, cum ar fi radicalii peroxil, alcoxil si hidroxil [Dean RT. si colaboratorii, 1997].
Peroxidul de hidrogen (H2O2) - aditia unui al doilea electron la O2.- produce ionul peroxid O22- , care nu are electroni impari si nici caracter de radical liber. H2O2 se formeaza rapid prin reactiile de dismutare ale O2.-. Ca si O2, H2O2 este un agent oxidant slab, actionand mai ales asupra compusilor nesaturati (eteri) si asupra triptofanului. Principalele reactii ale H2O2 au loc cu ionii metalici. Dintre toate speciile reactive ale O2, H2O2 este cel mai stabil si mai usor de masurat.
|
Peroxidul de oxigen poate fi generat si la nivelul peroxizomilor, fara interventia SOD. Neutralizarea peroxidului se poate realiza pe baza reactiilor Fenton si Haber-Weiß. Catalaza poate cataliza degradarea peroxidului de oxigen fara a genera compusi nocivi.
2 H2O2 → 2 H2O + O2
O alta posibilitate de neutralizare apeleaza la prezenta mieloperoxidazei, enzima prezenta in neutrofile. In urma acestei reactii se elibereaza acidul hipocloros - alt agent oxidant puternic, care poate elibera clor molecular - compus puternic toxic.
![]()
![]()
Ionul hipoclorit poate reactiona cu peroxidul la randul lui, eliberand alt compus ROS - oxigenul singlet:
![]()
Radicalul hidroxil (HO.) - alaturi de 1O2, radicalul HO. Este cea mai puternica specie a O2. Radicalul hidroxil reactioneaza cu viteze mari cu absolut orice molecula organica (glucide, aminoacizi, lipide, acizi nucleici, acizi organici).
Radicalii de tipul hidroxilului se formeaza pe baza reactiei Fenton:
![]()
sau a reactiei Haber-Weiß:
![]()
Peroxizii - dintre toate speciile active ale oxigenului, peroxizii si produsii lor de descompunere sunt cei mai stabili si universal raspanditi. Peroxizii sunt veriga finala a activarii O2. Peroxizii apar nu numai in organisme, dar si in obiectele din jur precum plastice, cauciuc, vopsele.
Ozonul (O3) - este ul alt radical liber al oxigenului, care produce alterari caracteristice reactiei de hipersensibilitate la plante.
Radicalii liberi ai azotului.
Oxidul nitric (NO) - este o molecula unica (gazoasa) care actioneaza fie ca oxidant, fie ca reducator, in functie de moleculele tinta. NO nu este o specie chimica agresiva asa ca el nu ataca moleculele la o rata semnificativa. Totusi NO poate fi usor transformat intr-o varietate de molecule inrudite ca: -S-NO (S nitrozotiol), Fe-NO (nitrozil feric), NO2 (nitrogen dioxid), peroxinitrit (ONOO-), NO-2 (nitrat) si NO-3 (nitrit). Cateva din acestea sunt mult mai puternice in atacul moleculelor biologice decat NO. In particular s-a sugerat ca ONOO- este o specie implicata in leziunile tisulare, aceasta distrugere fiind datorata puternicei sale actiuni oxidante.
NO este un radical mic, gazos, paramagnetic, care este usor solubil in apa, dar direct solubil in lipide. Aceste proprietati fizice ii permit sa difuzeze direct prin membranele biologice si explica rapida difuzie in afara circulatiei si in celule sau circulatia componentilor sangvini unde el poate media functiile citotoxice. NO se dizolva in sange si se leaga ireversibil la hemoglobina pe care o face foarte toxica daca este administrat in concentratii ridicate. NO este constant eliberat in timpul conditiilor bazice si sinteza NO este mai departe crescuta de stimulii fizici si de numerosi compusi antagonisti (acetilcolina, serotonina).
S-a aratat ca NO joaca un rol important in functiile patofiziologice ale sistemului vascular.
Se stia initial ca NO potenta vasodilatatia ca raspuns la activitatea ischemica. Totusi, experientele au aratat ca NO are numeroase functii: vasorelaxarea dependenta de endoteliu, inhibitia agregarii si adeziunea plachetelor, reducerea aderentei si agregarii neutrofilelor la endoteliul vascular. In plus, NO, ca un potential vasodilatator endogen, cauzeaza relaxarea musculaturii netede. S-a demonstrat, de asemenea, ca NO inhiba sinteza ADN, functiile mitocondriilor si ale ribonucleotid reductazei [Rozalia Nitu, Delia Irina Carol, Toma N.].
Dereglarea producerii NO poate juca un rol in patogeneza catorva boli cardiovasculare incluzand: hipertensiunea, ateroscleroza, neoxigenarea post-ischemica, inflamatii acute si depresiile miocardice asociate cu socul septic.
Compusi aromatici
Pe langa radicalii liberi de tip semichinonic, unii compusi aromatici pot fi antrenati in reactii cu producere de radicali cationici cu delocalizare electronica la atomul de azot. Astfel, o gama larga de fenoli produc radicali fenoxi (R-O.). O alta grupa de compusi aromatici, care produc radicali liberi in organism este constituita de 5-nitrofurani, 5-nitrotriazoli si 5-nitroimidazoli. Acesti compusi isi exercita activitatea citolitica in urma reducerii gruparii nitro de catre nitroreductaze. Din pacate, reducerea gruparii nitro favorizeaza formarea unor radicali liberi cu mare afinitate pentru legare de ADN.
Compusi de tip chinonic si semichinonic
Flavin chinonele reprezinta o grupa din marea clasa a semichinonelor (SQ), care pot forma radicali liberi intermediari intre formele oxidate si cele reduse ale chinonelor. Chinonele sunt foarte raspandite in natura, in diferite stari redox, particiand in procesele de transport electronic, cum sunt respiratia mitocondriala si fotosinteza. Au mai fost detectate chinone printre poluantii atmosferici, fumul de tigara si medicamente.
Acizi nucleici
Radicalii liberi proveniti din acizi nucleici sunt cei mai interesatti. Acest domeniu este deosebit de fascinant, nu numai prin importanta deosebita a acizilor nucleici, ca substrat al transmisiei informatiei genetice si a proceselor biosintetice, ci si prin caracteristicile acestor radicali. Modificarile macromoleculelor de acizi nucleici rezulta in urma absorbtiei energiei radiante in fractiuni de secunda, rezultand excitari si ionizari. Daca moleculele excitate pierd energia absorbita tot in fractiuni de secunda, ionizarile sau scindarile produc radicali liberi cu viata mai lunga. Radicalii liberi ai acizilor nucleici rezulta deci prin impactul energiei absorbite (prin expunerea la radiatii ionizante sau UV) si care determina ruperea unor legaturi chimice, deteriorari ale unor componente (baze azotate).
Radicalul tiol
Existenta radicalului tiol (RS.) a fost foarte mult timp controversata deoarece mult timp nu a putut fi evidentiat nici spectrofotometric si nici ca semnal RES. Ca si alti radicali liberi si radicalul RS* a fost formulat teoretic prin studiul semnalelor RES ale proteinelor si aminoacizilor iradiati in vitro.
3.Mecanisme de aparare ale organismului impotriva ROS
In conditii normale exista un echilibru intre sistemele antioxidante si sistemele generatoare de specii reactive de oxigen. Perturbarea acestui echilibru in favoarea sistemelor prooxidante determina instalarea stresului oxidativ, cu implicatii patologice [Sies H., 1991; Morel Y., Barouki R., 1999].
Organismele sunt protejate de agresiunea speciilor reactive de oxigen prin mai multe modalitati: compartimentalizarea celulara, protectia conferita de compusii antioxidanti si sistemele enzimatice, capacitatea organismelor de a elabora raspusuri adaptative inductibile in conditii de stres oxidativ. In plus, procesele de reparare si turnover ajuta la minimalizarea leziunilor rezultate din atacul speciilor reactive de oxigen.
In conditii normale celulele aerobe poseda mecanisme de aparare antioxidante care pot contracara efectele nocive ale speciilor reactive de oxigen [Hockenbery DM. si colaboratorii, 1993]. Aceste mecanisme de aparare pot fi impartite in mecanisme primare si secundare. In categoria mecanismelor primare de aparare se incadreaza compusii cu actiune antioxidanta neenzimatici ca vitamina C si E, glutationul, β-carotenul si acidul uric si sistemul enzimatic de protectie reprezentat de superoxid dismutaza, catalaza, glutation peroxidaza, glutation transferaza, glutation reductaza si glucozo-6-fosfat dehidrogenaza [Hasegawa T. si colaboratorii, 1992]. Aceste enzime au o localizare preponderent intracelulara, mediul extracelular fiind mult mai expus atacului radicalic. In figura 7 avem reprezentarea schematica a compusilor antioxidanti implicati in procesul de aparare a organismului impotriva ROS.
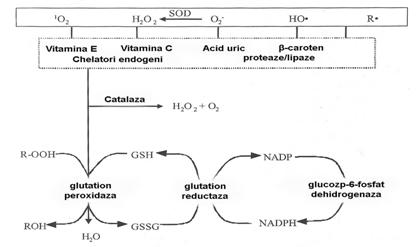
Figura 7: Reprezentarea schematica a sistemelor biologice de aparare antioxidanta
Compusii antioxidanti sunt clasificati dupa modul lor de actiune in: a) scavengeri - compusi ce previn stresul oxidativ prin captarea radicalilor liberi; b) antioxidanti "preventivi" - compusi ce actioneaza prin sechestrarea ionilor metalelor tranzitionale, prevenind reactia Fenton [Chapple ILC., 1997]. In Tabelul 4 sunt prezentati principalii compusi antioxidanti si mecanismul lor de actiune.
|
ANTIOXIDANT |
LOCALIZARE |
MOD DE ACTIUNE |
|
Proteine Feritina Transferina Lactoferina Ceruloplasmina Albumina |
- citoplasma - fluid extracelular - fluid extracelular - fluid extracelular - fluid extracelular |
- chelatare Fe2+ - chelatare Fe2+ - chelatare Fe2+ - chelatare Cu2+, oxidare Fe2+, scavenger O2- - chelatare Cu2+, scavenger OH., LOO., HOCl |
|
Compusi cu masa moleculara mica Vitamina E Ubichinona Carotenii Vitamina C Glutationul redus Acidul uric Bilirubuna |
- membrane - membrane - membrane - citoplasma - citoplasma, mitocondrii - sange - sange |
- scavenger OH., LOO., HOCl - scavenger OH., LOO., HOCl - scavenger OH., LOO., HOCl, 1O2 - scavenger OH., O2- - scavenger OH., O2- - previne peroxidarea lipidelor - previne peroxidarea lipidelor |
Tabelul 4: Principalii compusi antioxidanti, localizarea si mecanismul lor de actiune.
Glutationul (GSH) este un tripeptid hidrofilic si are capacitatea de a reactiona direct cu anionul superoxid, radicalul hidroxil si o serie de alti radicali liberi, avand o importanta majora in cadrul procesului de detoxifiere a organismului.
In cadrul mecanismelor secundare de aparare sunt incluse enzimele cu activitate lipolitica si proteolitica, cele doua tipuri de enzime avand rol in indepartarea lipidelor si proteinelor care au suferit modificari ca rezultat al stresului existent la nivel celular ca urmare a activitatii diferitilor poluanti, aceste molecule modificate putand genera alte reactii oxidative.
Aceste mecanisme de aparare existente la nivel celular au un rol major in supravietuirea organismelor aerobe.
Superoxid dismutaza (SOD)
SOD este un antioxidant enzimatic care descompune rapid radicalul superoxid (O2.-). Reactia catalizata de SOD are forma:
2O2.- + 2H+ O2 + H2O2
SOD exista sub mai multe forme:
forma cu zinc si cupru, care este localizata intracitoplasmatic;
forma cu mangan, care se afla in matricea mitocondriala;
forma cu fier, care se gaseste in bacterii si in plante.
SOD catalizeaza dismutarea anionului superoxid cu o rata de 10.000 de ori mai mare decat rata spontana de dismutare la pH fiziologic, determinand astfel anularea respingerii electrostatice dintre anionii superoxid. Situsul metalic al SOD este redus de un anion si apoi reoxidat de altul:
SOD-Me2+ + O2.- → O2 + SOD-Me+
SOD-Me+ + O2.- +2H+ → H2O2 + SOD-Me2+
Cea mai cunoscuta enzima este Cu/ZnSOD aflata in hematii si compusa dintr-o aglomerare de aminoacizi, in care atomii de Cu si Zn sunt chelati in comun prin ciclul imidazol al histidinei. Cu/ZnSOD este compusa din 2 subunitati identice, nelegate covalent, cotinand 2 atomi de Zn si 2 atomi de Cu, avand o masa molecular de 33 kDa.
La mamifere exista si o a doua SOD ce contine 2-4 atomi de Mn/molecula, compusa din patru subunitati si avand o masa moleculara de 80 kDa. Daca primele doua SOD au o localizare strict intracelulara, coexistand in aceeasi celula, exista o alta dismutaza, extracelulara, ce se afla in spatiul interstitial, mai ales in cel pulmonar si care contine 4 atomi de Cu si 4 atomi de Zn.
Putem afirma ca SOD se gaseste in toate celulele organismelor aerobe in cantitati mari. In ceea ce priveste localizarea SOD, aceasta s-a detectat nu doar in celulele endoteliate de la nivelul ficatului si rinichiului dar, de asemenea, in hepatocite, miocite, celulele musculare netede si striate, celulele acinare pancreatice, celulele epiteliale ale tubilor renali precum si ale intestinului subtire si colonului. Aceste constatari se coreleaza cu investigatiile imunohistochimice ce au localizat SOD, folosindu-se anticorpi impotriva Cu/ZnSOD si MnSOD. De asemenea, o activitate crescuta a SOD a fost evidentiata si extracelular, pe suprafata epiteliului traheei, esofagului, intestinului subtire si colonului, precum si in matricea extracelulara, cartilagii si tesut conjunctiv.
Se
remarca marea proportie de Cu/ZnSOD, comparativ cu celelalte
doua enzime. De asemenea, este evidenta marea concentratie a SOD
intracelulara in ficat, rinichi, creier, organe supuse unor procese
metabolice intense, spre deosebire de plamani la care predomina schimburile
respiratorii si unde SOD extracelulara este in concentratie
ridicata. Aceeasi diferenta de continut se poate
observa in cadrul aceluiasi organ (creier, rinichi), legata de
intensitatea proceselor metabolice; desigur conteaza nu numai intensitatea
proceselor metabolice, dar si natura lor. Leucocitele, desi sunt
sediul unor intense procese metabolice in care se dezvolta O2.-,
au totusi un continut destul de mic in SOD. Studiile biochimice au
demonstrat o remarcabila
Factorii implicati in reglarea SOD sunt complecsi:
O2 are un efect inductiv asupra SOD, demonstrat clar la bacteriile aerobe; continutul ridicat in SOD determina radiorezistenta bacteriei Micrococcus radiodurans;
tumorile localizate la nivelul unor organe interne si supuse tratamentului cu antibiotice antraciclinice isi maresc continutul in Cu/ZnSOD, deoarece aceste medicamente actioneaza prin eliberarea de O2.- si H2O2;
incarcarea cu Cu induce cresterea activitatii Cu/ZnSOD si scaderea nivelului de glutation; in plus, cresterea continutului de Cu in ficat determina si cresterea peroxidarii lipidelor.
Pe baza acestor date si observatii s-a inceput si experimentarea clinica a utilizarii terapeutice a SOD purificate in conditii patologice foarte variate: cataracta, displazie bronhopulmonara, intoxicatii chimice, artrita reumatismala [www.doctor.info.ro/Sisteme antioxidante cu rol protector].
Catalaza (CAT)
Majoritatea celulelor aerobe contin catalaza. La animale, este prezenta in aproape toate organele, fiind concentrata in special in ficat. In celula, catalaza se gaseste in peroxizomi si in cantitati mult mai mici, in mitocondrie si reticulul endoplasmatic. De aceea, in vivo H2O2 generat nu poate fi substrat al catalazei decat daca acesta difuzeaza in peroxizomi.
Enzima este alcatuita din patru subunitati proteice, fiecare dintre ele continand o molecula de hem legata in centrul activ (avand un ion Fe3+) si o molecula de NADPH. Hemul se afla intr-o fosa nepolara, conectata cu suprafata prin canale inguste care limiteaza accesul moleculelor mai mari decat H2O2.
Reactia catalizata de aceasta enzima este de disproportionare, o molecula de H2O2 fiind redusa, in timp ce alta este oxidata:
Catalaza-Fe(III) + H2O2 → Compus I + H2O
Compus I + H2O2 → Catalaza-Fe(III) + H2O + O2
Structura exacta a complexului I nu este cunoscuta cu exactitate. Este foarte dificila saturarea enzimei, vmax pentru disocierea H2O2 fiind foarte mare.
Enzima prezinta si activitate peroxidazica, limitarea datorandu-se accesibilitatii substratelor la hem. Prezenta substratelor functiei peroxidazice scade concentratia compusului I, ceea ce face ca majoritatea enzimei sa fie in stare libera.
Cantitatea mare de catalaza din ficat si hematii justifica implicarea ei in procese unde se produc cantitati crescute de H2O2. Formarea H2O2 este foarte riguros controlata in organisme, pentru descompunerea acesteia actionand trei enzime: catalaza, glutation peroxidaza si peroxidazele. Asa se explica de ce in deficite congenitale ale uneia dintre ele, persoanele respective nu au prea mult de suferit.
4.Metaloproteinaze-markeri ai stresului oxidativ
Metaloproteinazele (MMP), cunoscute si ca matrixine, sunt o familie de endoproteinaze, inrudite structural si functional, implicate in degradarea matricii extracelulare (MEC). Din punct de vedere fiziologic, aceste enzime joaca un rol esential in remodelarea tesuturilor normale, intervenind in dezvoltarea embrionara, angiogeneza, ovulatie, involutia glandei mamare si vindecarea ranilor. Expresia anormala a acestor proteine contribuie la diferite procese patologice precum: artrita reumatoida si osteoartrita, emfizemul pulmonar, invazia si metastazarea. Metaloproteinazele sunt capabile sa 'digere' tesuturile din jurul celulelor canceroase. Acestea pot apoi sa se deplaseze cu usurinta prin torentul sangvin, capacitatea lor de invazie si metastazare fiind astfel mult potentata.
In sistemele mamaliene se cunosc in prezent nouasprezece metaloproteinaze diferite. Toate metaloproteinazele au domenii specifice conservate la toti membrii grupului. Activitatea lor catalitica depinde de prezenta ionilor de zinc in situsul catalitic activ. Majoritatea metaloproteinazelor sunt sintetizate si secretate sub forma de zimogene, activarea lor fiind insotita de pierderea domeniului aminoterminal de 10 kDa.
Fiecare metaloproteinaza cliveaza cel putin un component al MEC. Activitatea lor proteolitica este inhibata de inhibitori tisulari cunoscuti ca inhibitori tisulari ai metaloproteinazelor (TIMPs).
Metaloproteinazele au fost clasificate conform specificitatii de substrat in vitro si a structurii domeniilor in 4 subgrupuri principale:
-colagenazele interstitiale (MMP 1, MMP 8 sau colagenaza neutrofilelor, MMP 13 sau colagenaza 3). Aceste metaloproteinaze catalizeaza degradarea formelor fibrilare de colagen.
-gelatinazele cunoscute si ca colagenaze de tip IV degradeaza gelatina dar si colagenul de tip IV, V, VII, IX, X (MMP 2 sau gelatinaza A si MMP 9 sau gelatinaza B).
-stromelizinele (MMP 3 sau stormelezina 1, MMP 10 sau stormelezina 2, MMP 11 sau stormelezina 3, MMP 7 sau matrisilina). Stromelizinele au specificitate de substrat larga, catalizand degradarea multor substraturi ale MEC. Printe acestea se numara proteoglicanii, lamininele, fibronectina si regiuni nonhelicale din colagenul IV. Stromelizina 3 pe de alta parte nu degradeaza nici o proteina matriciala, dar s-a demonstrat ca ea hidrolizeaza inhibitorul serinproteazelor.
MMP membranare sunt proteine care poseda un domeniu transmembranar. S-au descris 5 membri ai acestui grup, cel mai cunoscut fiind MMP membranar de tip I. Aceasta metaloproteinaza catalizeaza activarea progelatinazei A, degradeaza substrate variabile ale MEC si functioneaza ca o enzima fibrinolitica in absenta plasminei.
OBIECTIVE
Lucrarea de fata isi propune sa evalueze rolul prooxidant si antitumoral al extractului de Pleurotus ostreatus la nivelul liniei celulare de adenocarcinom colorectal - Caco-2. Studiul pe culturi de celule epiteliale intestinale umane, Caco-2, a fost realizat in vederea punerii in evidenta a raspunsului adaptativ care apare la nivelul celulei intestinale, in urma tratamentului cu o anumita concentratie de extract de Pleurotus ostreatus, in prezenta de 20% ser fetal bovin in mediul de cultura MEM (Modified Eagle Medium).
Concentratia optima de extract de Pleurotus ostreatus, pentru tratamentul culturii de celule epiteliale intestinale a fost stabilita in urma realizarii unui test de citotoxicitate folosind MTT [bromura de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazoliu], care permite evaluarea metabolismului oxidativ [Richard, M.J. si colaboratorii, 1992], pe baza transformarii MTT-ului intr-un formazan sub actiunea enzimelor NAD(P)H-dependente. Culoarea (galben pana la albastru) este proportionala cu numarul celulelor active metabolic.
In continuare, mentinand constanta doza de tratament si variind intervalul de timp vom analiza modificarile unor enzime implicate in stresul oxidativ precum si modificari de expresie proteica pentru metaloproteinazele 2 si 9. Aceste modificari vor fi urmarite prin experimente de zimografie, Western Blot si dozari enzimatice.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Proiecte pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








