
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Analiza unei probe de acid acetic prin titrare potentiometrica de neutralizare - lucarae de laborator |
Analiza unei probe de acid acetic prin titrare potentiometrica de neutralizare - lucarae de laborator
Scopul lucrarii este de a determina cantitatea de acid acetic dintr-o proba prin titrare potentiometrica acido-bazica. Se va inregistra curba de titrare, evidentiindu-se diverse modalitati de determinare a volumului de echivalenta.
Sectiunile lucrarii:
1. Principiul metodei
1.1. Caracteristici generale ale analizei indirecte
1.2. Curba de titrare potentiometrica
2. descrierea experimentului
Anexa 1 - Descrierea electrodului de chinhidrona
Anexa 2 - Procedee de determinare a volumului de echivalenta
PRINCIPIUL METODEI
Caracteristici generale ale analizei indirecte
Metoda potentiometrica se poate aplica atat in determinari analitice directe cat si in determinari indirecte. In varianta indirecta metoda potentiometrica se utilizeaza pentru a urmari desfasurarea unei reactii de titrare, care poate fi o reactie de neutralizare, de precipitare, de complexare sau redox.
Principiile
cunoscute din volumetria clasica se aplica si in cazul
determinarilor titrimetrice prin metode instrumentale. Astfel, reactia de
titrare trebuie sa fie stoechiometrica, sa se
desfasoare rapid si complet, fara a fi
insotita de reactii
secundare. Titrantul se adauga in solutia analitului in incremente mici cu ajutorul biuretei. In cazul in care
titrarea se realizeaza printr-o metoda instrumentala, dupa
fiecare adaos solutia analitului se omogenizeaza prin agitare
dupa care se masoara o anumita proprietate (semnalul
analitic, y) a analitului sau a altui
participant la reactia de titrare (titrant, produs de reactie) cu
ajutorul instrumentului analitic. Setul de date obtinute sub forma semnal
analitic - volum de titrant adaugat probei se reprezinta grafic,
rezultand curba de titrare, y -

Punctul
de echivalenta este momentul cand in proba s-a adaugat
acel volum din solutia titrantului care contine o cantitate de
reactiv echivalenta
cu cantitatea de analit din proba, in conformitate cu reactia de
titrare. In cazul metodelor instrumentale
conditiile de lucru se aleg astfel incat curba de titrare sa prezinte
un punct caracteristic, usor de evidentiat, corespunzator
punctului de echivalenta. Acesta va indica volumul de echivalenta.
Cantitatea de analit se calculeaza cu ajutorul functiei de etalonare cunoscute din volumetria clasica, dedusa pe baza principiilor stoechiometriei:
![]() (2)
(2)
in care a este coeficientul stoechiometric al analitului in reactia de titrare, t este coeficientul stoechiometric al titrantului in reactia de titrare, cT este concentratia molara a reactivului de titrare (in mol l-1), MA este masa molara a analitului si Ve este volumul de echivalenta (exprimat in relatia (2) in l).
Se remarca faptul ca valorile semnalului analitic (y) nu intervin in calculul cantitatii de substanta, m, ceea ce justifica atributul "indirect" conferit acestor procedee.
Semnalul analitic poate fi selectat astfel incat sa depinda de concentratia uneia sau a mai multor specii implicate in reactia de titrare (analit, titrant sau produsi de reactie).
Pentru a defini cat mai corect punctul de echivalenta este necesara inregistrarea unui numar cat mai mare de puncte experimentale, ceea ce face ca metoda sa fie destul de laborioasa. Durata analizei se reduce considerabil atunci cand se utilizeaza instrumentatie de laborator automatizata, cum ar fi titratoarele automate.
Curba de titrare potentiometrica
Se considera reactia de titrare a unui acid slab, HA (de exemplu acid acetic) cu o baza tare, BOH (de exemplu NaOH):

AH + BOH A- + B+ + H2O
Curba de titrare, reprezentata in forma pH - volum de titrant adaugat (Va) poate fi trasata experimental, punct cu punct, daca exista posibilitatea de a determina pH-ul solutiei (sau o marime proportionala cu pH-ul) dupa fiecare adaos de reactiv de titrare.
Masurarea potentiometrica a pH-ului unei solutii implica masurarea T.E.M. a unei celule electrochimice constituite din:
- electrod indicator al ionului hidroniu
- electrod de referinta;
- proba mentinuta sub agitare continua, uniforma.
Tensiunea electromotoare (T.E.M) a celulei electrochimice de mai sus (exprimata in volti) este data de expresia:
![]() (3)
(3)
Deoarece potentialul electrodului de
referinta, ![]() , este constant iar pentru un electrod indicator al ionilor
hidroniu functia de etalonare are expresia generala:
, este constant iar pentru un electrod indicator al ionilor
hidroniu functia de etalonare are expresia generala:
![]() (4)
(4)
in care k este o
marime
![]() (5)
(5)

![]() (6)
(6)
|
Titrarea analitului este insotita de modificarea concentratiei ionilor de hidroniu din solutie, iar acest fapt se poate pune in evidenta prin masuratori de T.E.M. pentru celula electrochimica descrisa mai sus.
Curba de titrare va fi descrisa astfel
prin setul de date ecel Va. Atunci cand
scala instrumentului este gradata direct in unitati de pH, curba
de titrare se va reprezenta direct in coordonate pH -
Curba de titrare are forma sigmoidala si prezinta un salt de cateva unitati de pH in jurul echivalentei. Determinarea volumului de echivalenta pe baza datelor obtinute prin titrare potentiometrica se poate face prin diverse cai, cum ar fi:
- Metoda grafica (metoda tangentelor) descrisa in Fig. 1, Anexa 2.
- Derivatizarea curbei sub forma primei derivate DpH/DV - v si a derivatei secunde D ph/DV2 - V (Fig. 2, Anexa 2)
- Liniarizare prin metoda diagramei Gran (detalii in lucrarea 'Metode electrochimice in analiza chimica', autori Ana Ion si F. G. Banica, Editura Ars Docendi, Bucuresti, 2002).
2. descrierea experimentului
Reactivi, ustensile si aparatura
- Solutie standard de reactiv de titrare (NaOH 0,1 mol/l);
- Biureta de 25 ml;
- Pahar Berzelius pentru titrare (150 - 200 ml, forma inalta);
- Electrod cu membrana de sticla;
- Electrod de referinta;
- Bara magnetica pentru omogenizarea solutiei;
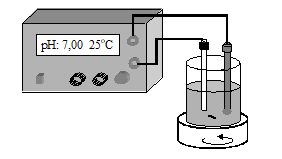 - Agitator magnetic;
- Agitator magnetic;
- Milivoltmetru (pH-metru).
Mod de lucru
Proba, continand o cantitate necunoscuta de acid acetic, se dilueaza cu apa distilata la un volum de circa 50 ml, astfel incat electrozii sa se afle in contact cu solutia.
Cei doi electrozi se spala cu apa distilata si se imerseaza in paharul cu proba, astfel incat sa se asigure contactul membranei si a jonctiunii cu solutia iar bara magnetica sa nu atinga corpul electrozilor.
Se conecteaza cei doi electrozi la instrumentul de masura (pH-metru) si se porneste agitarea solutiei (viteza moderata).
Se citeste
valoarea initiala a semnalului analitic (T.E.M. sau pH).
Se titreaza proba cu o solutie standard de NaOH, adaugand titrantul in incremente de 0,2 ml. Dupa fiecare adaos se asteapta un timp pentru omogenizarea solutiei, dupa care se citeste indicatia aparatului de masura.
Dupa inregistrarea saltului de valori a semnalului analitic in jurul echivalentei se continua titrarea, adaugand suplimentar 2 - 3 ml solutie titrant.
Rezultatele se trec intr-un tabel de tipul urmator.
Tabelul 1 - Date obtinute la titrarea potentiometrica a acidului acetic.
|
|
pH |
DpH/DV * |
D ph/DV2* |
|||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
Prelucrarea datelor experimentale
 Cu ajutorul datelor experimentale se traseaza curba de
titrare in coordonate pH - Va,
conform modelului de reprezentare din Fig. 1. La indicatia asistentului se
traseaza si curbele derivate.
Cu ajutorul datelor experimentale se traseaza curba de
titrare in coordonate pH - Va,
conform modelului de reprezentare din Fig. 1. La indicatia asistentului se
traseaza si curbele derivate.
Se determina grafic volumul de echivalenta (Ve, ml) si se calculeaza cantitatea de acid acetic din proba cu ajutorul unei relatii derivate din relatia (2):
![]()
Se va face o apreciere a acuratetii analizei prin calculul erorii absolute (ea) si a erorii relative (er
![]() (7)
(7)
![]() (8)
(8)
in care m este cantitatea de analit din proba analizata (se solicita aceasta valoare asistentului) iar m este cantitatea de acid determinata experimental.
ANEXA 1 - Descrierea electrodului de chinhidrona
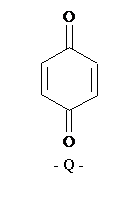
Electrodul
de chinhidrona consta dintr-un fir de Pt sau Au imersat in proba
de analizat in care s-au introdus cateva cristale de chinhidrona (amestec
echimolecular de chinona (Q) si hidrochinona (H2Q)).
La dizolvare se stabilesc echilibrele:
Q H2Q(s) ⇄ Q H2Q(aq) ⇄ Q(aq) + H2Q(aq) (9)
Acest electrod se reprezinta schematic astfel:
Pt Q, H2Q
Reducerea chinonei conduce la dianionul Q2-:
Q + 2e- ⇄ Q2- (10)
In prezenta ionilor H+, forma Q2- poate participa la echilibrul acido-bazic de mai jos:
Q2- + 2H+ ⇄ H2Q (11)
Prin insumarea ecuatiilor chimice (11) si (12) rezulta reactia totala:
Q + 2e- + 2H+ ⇄ H2Q (12)
Potentialul de electrod va fi determinat de cuplul redox Q/H2Q, conform relatiei:
 (13)
(13)
Concentratiile speciilor Q si H2Q se pot considera constante, data fiind solubilitatea lor redusa, in conditiile in care disocierea acido-bazica a hidrochinonei nu este importanta (pH < 8). Ca urmare, relatia (13) se poate rescrie intr-o noua forma prin regruparea tuturor marimilor constante intr-un singur termen, k:
![]() (14)
(14)
sau:
![]() (15)
(15)
Aceasta ultima relatie indica faptul ca potentialul electrodului metalic redox se coreleaza cu concentratia ionilor hidroniu din proba. Factorul b este 0,0592 V la 25s C si reprezinta sensibilitatea electrodului de chinhidrona.
Electrodul de chinhidrona functioneaza ca senzor de pH in domeniul de pH 2 - 8. La pH > 8 sau in medii cu taria ionica ridicata determinarile sunt afectate de erori (eroare alcalina, respectiv salina). Electrodul de chinhidrona se poate utiliza in medii oxidante deoarece chinhidrona este un agent reducator slab.
Anexa 2 - Procedee de determinare
a volumului de echivalenta
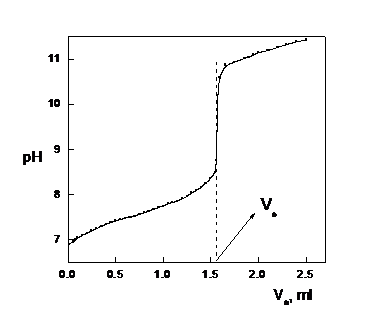
Fig. 1A - Curba de titrare pH - Va. Daca saltul de pH din jurul echivalentei este brusc si practic vertical, volumul de echivalenta se afla in punctul de intersectie a perpendicularei coborate pe axa Va pe directia saltului.
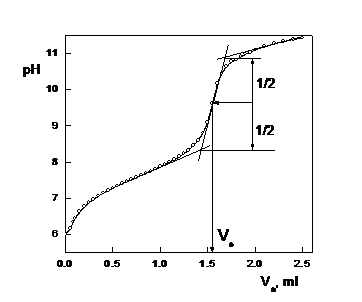
Fig. 1B - Curba de titrare pH -
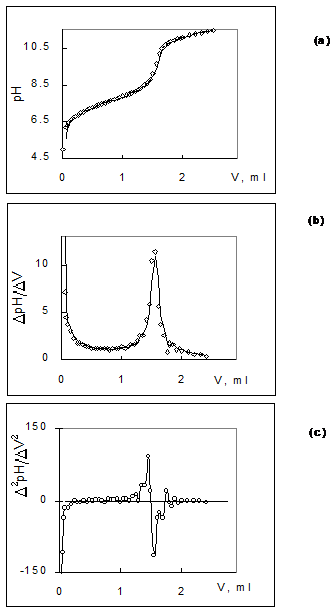
Fig. 2 - (a) Reprezentarea reprezentarea grafica a curbei de titrare pH - V si a formelor prelucrate prin derivare: prima derivata (b) si, respectiv, derivata secunda (c).
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Analize pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||









