
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Echilibre cu transfer de protoni - teoria disociatiei electrolitice, teoria transferului de protoni |
Echilibre cu transfer de protoni - teoria disociatiei electrolitice, teoria transferului de protoni
Se confunda de fapt in echilibrele de neutralizare, echilibre care au loc intre acizi si baze.
1. TEORII ASUPRA ACIZILOR SI BAZELOR
O prima teorie este teoria disociatiei electrolitice elaborata in 1887 de Svante Arrhenius.
Conform acestei teorii:
- un acid este orice substanta care, prin dizolvare in apa, disociaza, eliberand ioni de hidrogen (H+):
HA ↔ H+ + A-;
- o baza este orice substanta care, prin dizolvare in apa, disociaza, eliberand ioni oxidril (HO-):
BOH ↔ B+ + HO-.
Aceasta definitie a acizilor si bazelor a fost multa vreme unanim acceptata. In timp s-a dovedit ca teoria este limitata:
- ea nu prevede posibilitatea existentei acizilor si bazelor in afara solutiilor apoase;
- conform acestei teorii aminele organice nu pot fi considerate baze, pentru ca, neavand grupari oxidril nu le pot elibera la dizolvarea lor in apa.
Pentru a corecta teoria lui Svante Arrhenius in 1923 este elaborata teoria transferului de protoni propusa simultan de J. N. Brönsted si T. M. Lowry. Conform acestei teorii:
- se numeste acid orice substanta care are tendinta de a pierde un proton;
- se numeste baza orice substanta care are tendinta de a aditiona un proton.
Dar, prin pierderea unui proton acidul (A1) se transforma in baza (B1)
A1 ↔ B1- + H+
Donor ↔ Acceptor + proton
HCN ↔ CN- + H+
H2O ↔ HO- + H+
H3O+ ↔ H2O + H+
NH4+ ↔ NH3 + H+
A aparut notiunea de Acid - Baza conjugata si cea de Baza - Acid conjugat.
Conform acestei teorii se extinde mult aria de existenta a acizilor si bazelor.
Altfel, in general: - acizii pot fi molecule neutre sau cationi;
- bazele pot fi molecule neutre sau anioni.
Pentru prima data se poate explica existenta substantelor cu caracter amfoter, ca fiind substante cu rol dublu de acid si de baza:
H2O ↔ HO- + H+
Acid Baza conjugata
H2O + H+ ↔ H3O+
Baza Acid conjugat
2 H2O ↔ H3O+ + HO-
In sens direct reactia este de disociere sau reactie de autoprotoliza. In sens invers reactia este de amfoterizare.
Pana in prezent teoria lui Bronsted - Lowry este cea mai importanta si cea mai folosita in chimie.
Ea prezinta o serie de insuficiente printre care cea mai importanta este faptul ca similar cu apa se comporta si alti compusi ca SO2, I2 etc.
SO2 ↔ SO2+ + O2-
SO2 + O2- ↔ SO32-
_____ _______ ______ ______
2 SO2 ↔ SO2+ + SO32-
I2 ↔ I- + I+
I2 + I- ↔ I3-
__________________
2 I2 ↔ I+ + I3-
SO2 si I2 sunt solventi. SO2 dizolva cauciucul si se comporta tot ca apa. Existenta unor astfel de substante care nu elibereaza protoni prin disociere ci ioni a dus la elaborarea unor noi teorii asupra acizilor si bazelor.
Astfel Usanovici elaboreaza teoria transferului de ioni.
Conform acestei teorii:
- acizii sunt substante care cedeaza cationi sau accepta anioni;
- bazele sunt substante care cedeaza anioni sau accepta cationi.
Ulterior s-a constatat ca unele substante nu cedeaza si nu accepta protoni si nici ioni dar cedeaza sau accepta o pereche de electroni liberi neparticipanti.
A aparut astfel teoria transferului de electroni sau teoria electronica a acizilor si bazelor, lansata in 1923 de G. N. Lewis.
Conform acestei teorii:
- acizii sunt substante care accepta o pereche de electroni de la o baza donoare pentru a forma un produs de neutralizare;
- bazele sunt substante care cedeaza o pereche de electroni unui acid acceptor pentru a forma un produs de neutralizare.
Cl3B + :NH3 ↔ Cl3B ← NH3
Acid Baza Produs de neutralizare
Aceasta teorie are foarte putine aplicatii, la fel ca si alte teorii care au mai fost emise.
Exemplu:
Teoria Cady-Elsey sau teoria solvosistemelor conform careia:
- acizii sunt substante care dizolvate intr-un solvent ionolitic disociaza eliberand ioni pozitivi identici cu ionii solventului;
- bazele sunt substante care dizolvate intr-un solvent ionolitic disociaza eliberand ioni negativi identici cu ionii solventului.
Exemplu:
- pentru acizi:
- in apa (solvent care disociaza H2O ↔ HO- + H+) acizii trebuie sa puna in liberate protoni;
- in alcool (C2H5-OH ↔ C2H5O- + H+) acizii trebuie sa elibereze protoni;
- in acid acetic (CH3COOH ↔ CH3COO- + H+) acizii trebuie sa elibereze protoni;
- in SO2 (2 SO2 ↔ SO2+ + SO32-) acizii sunt toate sarurile de tionil;
- in NH3 (2 NH3 ↔ NH4+ + NH2-) acizii sunt toate sarurile de amoniu.
In concluzie, cele mai importante teorii asupra acizilor si bazelor raman teoria lui Svante Arrhenius si teoria Bronsted - Lowry
2. CLASIFICAREA ACIZILOR SI BAZELOR
Pentru a realiza o astfel de clasificare se poate lua in considerare doua criterii:
- taria acizilor si bazelor;
- numarul gruparilor de oxidril sau al protonilor continuti in molecula.
Dupa tarie:
- acizii se clasifica in:
acizi tari (HCl, HBr, HI, HNO3, HClO4, HMnO4, H2SO4, acizi sulfonici, heteropoliacizi etc.) - considerati total disociati in solutii diluate;
acizi slabi (H2CO3, HCN, acizii organici etc.) - considerati partial disociati in solutii diluate.
- bazele se clasifica in:
baze tari (NaOH, KOH, CsOH, Ca(OH)2, Ba(OH)2, saruri cuaternare de aminiu etc.) - considerate total disociate in solutii diluate;
baze slabe (hidroxizi metalici, amine organice etc.) - considerate partial disociate in solutii diluate.
Dupa numarul protonilor disponibili din molecula acizii pot fi:
- acizi monobazici:
- acizii monobazici tari - complet disociati in solutii diluate:
HA → H+ + A-
Exemplu: HCl, HBr, HClO4, HMnO4 etc.
|
- acizi monobazici slabi - partial disociati in solutii diluate:
HA ↔ H+ + A-
Exemplu: HCN, CH3-COOH etc.
- acizi polibazici - care disociaza in trepte (H3PO4, H2CO3, H3BO3 etc.).
Disocierea in trepte a acizilor polibazici:
H3PO4 ↔ H+ + H2PO4-;
![]() ;
;
H2PO4- ↔ H+ + HPO42-;
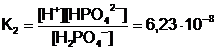 ;
;
HPO42- ↔ H+ + PO43-;
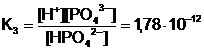 .
.
Pentru un acid de forma HnA:
HnA ↔ H+ + Hn-1A-;
![]() ;
;
Hn-1A- ↔ H+ + Hn-2A2-;
![]()
HA(n-1)- ↔ H+ + An-;
![]() .
.
Totdeauna K1 > K2 > K3 > . .. > Kn.
Dupa numarul gruparilor oxidril din moleculele bazelor acestea pot fi:
- baze monoacide:
- baze monoacide tari - total disociate in solutii diluate:
BOH → B+ + HO-
Exemplu: NaOH, KOH etc.
- baze monoacide slabe - partial disociate in solutii diluate:
BOH ↔ B+ + HO-
Exemplu: LiOH etc.
- baze poliacide - care disociaza in trepte:
Al(OH)3 ↔ Al(OH)2+ + HO-;
![]() ;
;
Al(OH)2+ ↔ Al(OH)2+ + HO-;
![]()
Al(OH)2+ ↔ Al3+ + HO-;
![]() .
.
Pentru o baza poliacida de forma B(OH)n:
B(OH)n ↔ B(OH)n-1+ + HO-;
![]() ;
;
B(OH)n-1+ ↔ B(OH)n-22+ + HO-;
![]()
B(OH)(n-1)+ ↔ Bn+ + HO-;
![]() .
.
Totdeauna K1 > K2 > K3 > . .. > Kn.
3. SARURILE
Sarea - se defineste ca fiind orice substanta care dizolvata intr-un solvent ionolitic disociaza eliberand ioni pozitivi si ioni negativi, nici unul asemanator cu ionii solventului.
NaCl + H2O ↔ Na+ + Cl- + H2O.
Marea majoritate a sarurilor sunt electroliti tari, exceptie facand unele halogenuri si pseudohalogenuri de mercur, cadmiu, staniu, stibiu etc.
4. REACTIA DE NEUTRALIZARE
Se defineste ca fiind reactia dintre o substanta cu caracter acid si o substanta cu caracter bazic in urma careia rezulta o sare si un solvent.
Dupa natura solventului intalnim:
- neutralizare in apa:
HX + NaOH ↔ NaX + HOH
acid baza sare apa
- neutralizare in alcool:
HX + C2H5ONa ↔ NaX + C2H5OH
acid baza sare alcool
- neutralizare in amoniac:
NH4Br + KNH2 ↔ KBr + 2 NH3
acid baza sare amoniac
- neutralizare in dioxid de sulf:
SOCl2 + Na2SO3 ↔ 2 NaCl + 2 SO2
acid baza sare dioxid de sulf
In categoria reactiilor de neutralizare se incadreaza si reactia dintre sarurile cu caracter acid si bazele alcaline:
FeCl3 + 3 NaOH ↔ Fe(OH)3 ↓ + 3 NaCl
pp. rosu brun sare
Deci, neutralizarea poate avea loc intre un acid si o baza sau intre o sare cu caracter acid si o sare cu caracter bazic din care se formeaza sare si un compus slab disociat (de obicei solvent).
5. AMFOLITI ACIDO-BAZICI
Sunt substante care pot juca rol atat de acid cat si de baza:
Exemplu:
Al(OH)3 ↔ AlO(OH)2- + H+
Al(OH)3 ↔ Al(OH)2+ + HO-
In forma generala un amfolit este reprezentat ca HAOH
HAOH ↔ HAO- + H+
HAOH ↔ HA+ + HO-
Cel mai cunoscut amfolit este apa:
HOH ↔ HO- + H+
HOH + H+ ↔ H3O+
_____ _______ ______ __________
2 HOH ↔ HO- + H3O+
Apa poate fi considerata un solvent protolitic, un solvent ionolitic, un solvent amfiprotolitic (amfiprotic) pentru ca prin disociere elibereaza atat protoni (H+) cat si ioni oxidril (HO-)
CALCULAREA CONCENTRATIEI IONILOR DE HIDROGEN, A pH-ULUI SI pOH-ULUI IN SOLUTII DE ACIZI, BAZE, SARURI
1. Calcularea concentratie ionilor de hidrogen, a pH-ului si a pOH-ului apei pure
Reprezinta o aplicatie importanta a legii echilibrului chimic sau a legii actiunii maselor.
La purificarea apei prin distilari repetate, conductibilitatea electrica scade pana atinge o anumita marime constanta. Experimental s-a demonstrat ca apa tridistilata, in conditii de puritate inaintata, in absenta aerului si in vase de platina, conduce totusi curentul electric. Apa fiind un electrolit slab disociaza conform reactiei:
HOH ↔ HO- + H+;
![]() ;
;
[H2O] = C;
[H+] = [HO-] = [H2O]disociat = α · C;
[H2O]nedisociat = C - α · C = (1 - α) · C
![]()
Prin masurarea
conductometrica se poate determina α ca fiind ![]() .
.
Unde: λc = conductivitatea echivalenta la concentratia data; se masoara cu conductometrul;
λ∞ = conductivitatea echivalenta la dilutie infinita; se calculeaza din mobilitatile ionilor, mobilitati care sunt tabelate.
![]()
La 22oC se determina
![]() = 1,8 ∙ 10-16
mol/L.
= 1,8 ∙ 10-16
mol/L.
Deoarece [H2O]nedisociat este o constanta reprezentand concentratia molara a apei pure initiala, atunci:
KW
= ![]() ∙ [H2O]nedisociat = [HO-]
∙ [H+]
∙ [H2O]nedisociat = [HO-]
∙ [H+]
La o anumita temperatura, KW este o marime constanta si poarta denumirea de produsul ionic al apei.
![]() ;
;
![]() ;
;
![]() ;
;
d = 1 g/mL
![]() ;
;
[H+] ∙ [HO-] = [H2O]nedisociat ∙ 1,8 ∙ 10-16 = 55,55 ∙ 18 ∙ 10-16 = 1 · 10-14 mol2/L2
[HO-] ∙ [H+] = 1 ∙ 10-14 mol2/L2;
![]() ;
;
![]() ;
;
Dar cum [HO-] = [H+], se obtine:
[H+]2 = [HO-]2 = 1 ∙ 10-14 mol2/L2 = KW;
[H+]
= [HO-] = ![]() .
.
![]() are valori diferite,
in functie de temperatura.
are valori diferite,
in functie de temperatura.
Intr-o solutie acida [H+] > 1 ∙ 10-7 mol/L, respectiv [HO-] < 1 ∙ 10-7 mol/L.
Intr-o solutie alcalina [HO-] >1 ∙ 10-7 mol/L, respectiv [H+] < 1 ∙ 10-7 mol/L.
Intr-o solutie neutra [HO-] = [H+] = 1 ∙ 10-7 mol/L.
In practica, de cele mai multe ori concentratia ionilor de hidrogen este o fractiune subunitara, motiv pentru care Sörensen, in 1909, a propus sa se exprime concentratia ionilor de hidrogen in forma logaritmica, introducand notiunea de exponent al ionului de hidrogen sau pH.
[H+] = 10-pH
de unde:
- pH = lg [H+];
pH =
- lg [H+] = lg ![]() .
.
Definim pH-ul ca fiind logaritmul cu semn schimbat al concentratiei molare a ionilor de hidrogen [H+], sau mai corect al concentratiilor ionilor de hidroniu din acea solutie.
El defineste in mod analog exponentul ionilor de hidroxil, pOH, ca fiind logaritmul cu semn schimbat al concentratiei molare a ionilor de hidroxil [HO-].
pOH =
- lg [HO-] = lg ![]() .
.
Pentru apa pura:
pH = - lg 1 ∙ 10-7 = 7;
pOH = - lg 1 ∙ 10-7 = 7.
Deoarece in solutii aproape totdeauna:
[H+] ∙ [HO-] = KW = 1 ∙ 10-14 mol/L;
- lg ([H+] ∙ [HO-]) = - lg [H+] - lg [HO-] = pH + pOH = - lg Kw = 14;
pH = 14 - pOH;
pOH = 14 - pH.
Pentru solutii acide pH < 7 iar pOH > 7.
Pentru solutii bazice pOH < 7 iar pH > 7.
Pentru solutii neutre pH = pOH = 7.
In tabelul 1. sunt redate legaturile dintre [H+], [HO-], pH, pOH si caracterul mediului:
Tabelul 1. Legatura intre [H+], [HO-], pH, pOH si caracterul mediului
|
pH |
pOH |
[H+] |
[HO-] |
Caracterul mediului |
|
|
|
|
|
Foarte puternic acid |
|
|
|
|
|
Puternic acid |
|
|
|
|
|
Acid |
|
|
|
|
|
Acid |
|
|
|
|
|
Acid |
|
|
|
|
|
Slab acid |
|
|
|
|
|
Foarte slab acid |
|
|
|
|
|
Neutru |
|
|
|
|
|
Foarte slab alcalin |
|
|
|
|
|
Slab alcalin |
|
|
|
|
|
Alcalin |
|
|
|
|
|
Alcalin |
|
|
|
|
|
Alcalin |
|
|
|
|
|
Puternic alcalin |
|
|
|
|
|
Foarte puternic alcalin |
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Documente online pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








