
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Reglarea biosintezei si activitatii enzimelor - reglarea cantitatii enzimelor |
Reglarea biosintezei si activitatii enzimelor - reglarea cantitatii enzimelor
1. ASPECTE GENERALE
Insusiri cum sunt capacitatea catalitica deosebita, specificitatea, inhibarea prin diversi compusi etc, se studiaza in detaliu urmarind comportarea enzimelor extrase, purificate si dizolvate in mediu apos; in aceste conditii, atunci cand se studiaza actiunea unui anumit factor, de exemplu a unui inhibitor, ceilalti parametrii cum sunt temperatura, pH-ul, concentratia enzimei si substratului, prezent cofactorilor etc, se mentin la valorile dorite (de regula cele optime).
Si pentru enzimele care isi desfasoara activitatea in organismele vii, o parte dintre factorii mentionati se mentin la valori constante sau variaza in limite restranse. Apar totusi relativ frecvent si situatii deosebite; intre acestea variatiile mari m timp ale concentratiei substratului (de exemplu a glucidelor, lipidelor si proteinelor in tractul digestiv) si acumularea peste limite a produsilor finali a cailor metabolice sunt cele mai frecvente.
Se mentine in astfel de situatii in celule, organe sau organismul intreg o concentratie stationara si o activitate constanta a tuturor enzimelor?
Raspunsul la aceasta intrebare a venit mai intai din studiul unor procese metabolice la organismele simple (bacterii) la care s-au remarcat, functie de conditiile create in mediu, cresteri si scaderi in limite foarte mari ale cantitatii unor enzime, sau, in alte cazuri, variatii insemnate ale activitatii enzimelor. Aceste variatii cantitative sau calitative, constituie de fapt modalitati de reglare care sunt atributul biocatalizatorilor. Prin intermediul reactiilor catalizate de astfel de enzime (dar si prin prezenta sau absenta cofactorilor, a inhibitorilor etc.) bacteriile isi mentin homeostazia in raport cu mediul extern. Pe baza cunostintelor actuale, se poate afirma ca si in organismele superioare toate procesele care au o baza moleculara sunt reglate prin enzime; la aceste organisme, datorita specializarii celulelor si organelor, pe de o parte, si a functiei integrate, pe de alta parte, reglajul cantitativ sau calitativ al enzimelor la un anumit nivel poate avea ecou la nivelul organismului intreg. in afara conditiilor mentionate (exces sau lipsa de substrat, exces de produs etc.) se mentioneaza aici ca actiunea hormonilor se realizeaza final prin intermediul unor enzime de reglaj specializate (vezi capitolul 'Hormoni').
In cele ce urmeaza se prezinta reglarea cantitatii enzimelor (pe scurt) si cele doua variante majore de reglare a activitatii enzimelor reglarea alosterica si reglarea covalenta.
2 REGLAREA CANTITATII ENZIMELOR
Cantitatea oricarei proteine din organism, deci si a enzimelor, rezulta din dinamica proceselor de biosinteza si degradare. Viteza de schimb (turnoverul proteinelor) exprimata prin timpul de injumatatim, Tl/2, este foarte variata (vezi 'Metabolismul proteinelor si al aminoacizilor'). Se stie ca proteinele se sintetizeaza din aminoacizi; pe de alta parte, produsii de degradare ai proteinelor sunt, de asemenea, aminoacizii. Se poate scrie relatia:
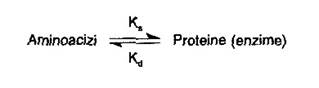
unde Ks este o constanta generala a procesului de sinteza, iar Kd este o constanta generala a procesului de degradare.
Dependent de valorile celor doua constante generale se disting situatiile:
Ks > Kd concentratie crescuta a enzimei;
Ks = Kd concentratie stationara a enzimei;
Ks < Kd concentratie scazuta a enzimei;
Majoritatea enzimelor au Ks = Kd; ele se numesc enzime constitutive. Enzimele la care Ks > Kd, se numesc inductibile, cele la care Ks < Kd, se numesc represibile. Se face precizarea ca inductia sau represia sintezei enzimelor nu au caracter permanentele sunt declansate doar atunci cand celulele reclama unul sau altul dintre aceste reglaje.
Inductia sintezei se poate restrange la o singura enzima dintr-o cale metabolica (de ex. inductia prin substrat a -aminolevulinatsintetazei, -ALAS, in calea biosintezei hemului).
Sau poate fi o inductie simultana a mai multor enzime; de exemplu, inductia enzimelor hepatice ilustrata prin aceea ca la o dieta bogata in proteine, in decurs de 1-2 zile sunt sintetizate cantitati mari de enzime din caile metabolice de degradare ale aminoacizilor si din gluconeogeneza.
Represia sintezei enzimelor se face de regula prin intermediul unor compusi cu molecula mica, numiti corepresori.
Inductorii si represorii actioneaza prin intermediul unor proteine specializate cu care formeaza complexe.
Mecanismele inductiei si represiei sintezei enzimelor, bine cunoscute in prezent, nu pot fi intelese decat in contextul mai larg al mecanismului biosintezei proteinelor.
3. REGLAREA ALOSTERICA A ACTIVITATII ENZIMELOR
In subcapitolul referitor la cinetica reactiilor catalizate de enzime s-a mentionat ca pentru unele dintre acestea curba variatiei lui v0 in functie de aSs are un aspect sigmoidal (Fig.18).
Viteza mica a reactiei la inceput urmata de cresterea marcata la concentratii mai mari ale substratului, sunt rezultatul unor mecanisme particulare de actiune a enzimelor ce catalizeaza aceste reactii.
Hotaratoare pentru elucidarea acestor mecanisme au fost cercetarile efectuate de J. Monod, J.P. Changeux si F. Jacob, in anii '60, asupra reglarii activitatii unor enzime bacteriene. S-a constatat de exemplu ca in biosinteza L-izoleucinei din L-treonina (care consta din cinci reactii catalizate de tot atatea enzime), L-izoleucina in exces inhiba intreaga cale metabolica. Nu sunt insa inhibate toate enzimele ci doar prima dintre ele, L-treonin-dehidrataza; ea catalizeaza transformarea L-treoninei in -cetobutirat + amoniac (Fig. 19).

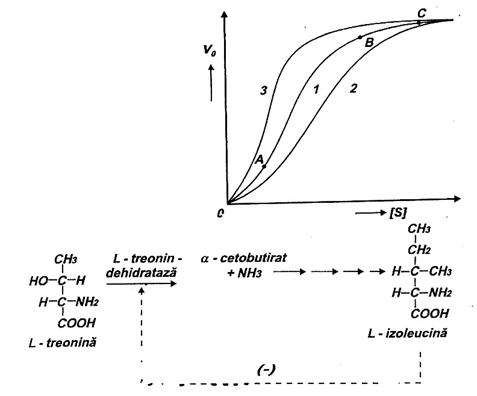
Fig. 1 Inhibarea activitatii L-treonin-dehidratazei de catre
L-izoleucina aflata in exces.
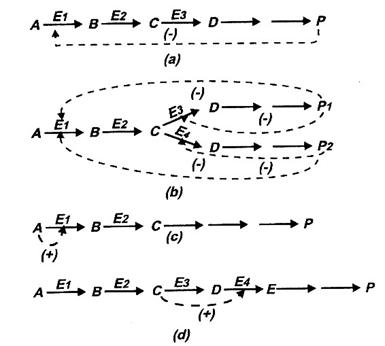
Fig. 20. Modularea activitatii enzimelor alosterice:
(a) inhibitie intr-o cale metabolica lineara;
(b) inhibitii tn cale metabolica cu ramificatii;
(c) activare prin substrat; (d) feed-forward stimulare.
Studiind si alte cai de biosinteza, Monod si colaboratorii au fost in masura sa generalizeze ca produsul final, acumulat peste necesitatile de moment, devine inhibitor al enzimei care catalizeaza prima sau una din primele reactii ale sirului celor implicate in biosinteza sa (Fig. 20.a).
In cazul cailor metabolice cu ramificatii, produsii finali sunt inhibitori ai enzimelor care catalizeaza reactiile de la nivelul ramificatiilor; deseori, fiecare dintre produsii finali inhiba si activitatea primei enzime (Fig. 20.b). Monod si colaboratorii au denumit acest tip de inhibitie, inhibitie prin produs final, inhibitie feedback sau retroinhibitie; enzimele inhibate s-au denumii enzime alosterice iar inhibitorii, inhibitori alosterici sau modulatori (efectori) negativi.
Au fost identificate si enzime alosterice a caror activitate creste in prezenta unor compusi care au fost numiti activatori alosterici sau modulatori pozitivi. Asemenea modulatori pot fi substratul (care activeaza prima enzima) (Fig. 20.c), unul dintre intermediari care activeaza o enzima aflata in continuarea caii metabolice (feed-forward stimulare) (Fig. 20.d), diferiti alti compusi. Alaturi de denumirile deja enumerate se utilizeaza si aceea de efectori alosterici in legatura cu totalitatea compusilor cu rol activator sau inhibitor.
Pentru cele mai multe enzime alosterice exista atat modulatori pozitivi cat si negativi.
Modulatorii intensifica sau scad activitatea enzimelor ca urmare a fixarii lor pe acestea. Locurile de fixare sunt distincte pentru modulatorii pozitivi si cei negativi si altele decat centrul activ. De aici denumirile de enzime alosterice, inhibitori alosterici (allo = alt loc).
Exista in prezent mai multe argumente, bazate pe cercetari experimentale, privind locurile distincte de fixare pe enzime a activatorilor si inhibitorilor de acest tip. Astfel, s-au realizat 'desensibilizari' ale unor enzime alosterice prin actiuni fizice sau chimice: pH-uri extreme, enzime proteolitice, ureea, temperaturi scazute sau crescute, unele radiatii; s-au realizat astfel de modele experimentale incat sa fie afectate numai locurile de legare ale modulatorilor nu si centrul activ. In alte experiente s-a putut proteja centrul activ de actiunea unor agenti denaturati prin intermediul modulatorilor.
|
Si alte insusiri ale enzimelor alosterice, a reactiilor catalizate de ele, precum si a conditiilor in care se desfasoara aceste reactii au importanta pentru cunoasterea fie a mecanismului de actiune, fie a rolului de reglatori a cailor metabolice. Intre acestea se citeaza:
din punct de vedere structural, aproape toate enzimele alosterice sunt oligomeri, de regula cu numar par de monomeri: doi (mai rar), patru, sase etc;
reactiile catalizate de aceste enzime au G0' negativ, sunt deci exergonice si ireversibile; ele imprima sensul unic al cailor metabolice din care fac parte; situarea chiar la inceputul caii metabolice a acestor reactii asigura nu numai un control al intensitatii caii, dar si imposibilitatea parcurgerii ei in sens invers, ceea ce se traduce printr-o economicitate maxima;
compusii chimici cu rol reglator a enzimelor alosterice (efectorii) sunt prezenti permanent (rareori doar intermitent) la locul de actiune al acestor enzime; variaza doar concentratia lor.
Mecanismele (modele) propuse pentru explicarea, cu respectarea datelor experimentale aratate, a actiunii enzimelor alosterice au fost numeroase. Dintre acestea s-au impus doua: modelul concertat (simetric) imaginat de Monod, Wyman si Changeux (modelul MWC) si modelul secvential propus de Koshland, Nemethy si Filmer (modelul KNF).
Cele doua modele au cateva elemente comune:
a. fiecare monomer al oligomerului are centrul sau activ;
b. monomerii 'coopereaza' in fixarea substratului si deci in desfasurarea procesului catalitic. Prin cooperare se intelege ca la fixarea substratului monomerii se influenteaza. De exemplu un monomer care a fixat substratul mareste capacitatea de fixare a acestuia de catre ceilalti monomeri (cooperare pozitiva); fixarea substratului de catre un monomer poate avea ca efect diminuarea capacitatii de fixare a lui de catre ceilalti monomeri (cooperare negativa); in aceste cooperari substratul insusi este efector, ele sunt de tip homotrop. Daca avem insa in vedere cele aratate anterior si anume ca enzimele alosterice sunt controlate si de modulatori (care se leaga in alte pozitii decat substratul) interactia se face si la nivelul locusurilor pe care se leaga modulatorii; astfel de interactii se numesc de tip heterotrop; cele mai multe enzime alosterice sunt de tip mixt, homotrop-heterorop;
c. interactiunile intre monomeri in oligomer, atat in cazul efectului homotrop cat si a celui heterotrop, nu implica modificari profunde (formare sau rupere de legaturi covalente) ci doar modificari conformationale. De aceea reglarea alosterica se face cu consum minim de energie.
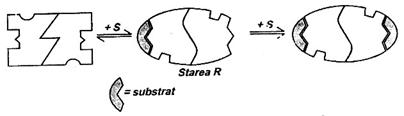
Fig. 21. Fixarea substratului si tranzitia T R in cazul unei enzime
alosterice formata din doi monomeri.
Modelul simetric postuleaza suplimentar:
- Oligomerul trebuie sa indeplineasca permanent conditia de simetrie, respectiv centrele active ale monomerilor sa fie echivalente in interactia cu ceilalti monomeri; de fapt, oligomerul poate exista numai in doua stari: conformatia T (tensionata, constransa) in care enzima are afinitate mica fata de substrat si conformatia R (relaxata) cu afinitate mare pentru substrat. Starea T are centrul activ preformat, starea R il are definitivat. Cele doua stari se afla in echilibru, constanta de echilibru fiind L (constanta alosterica). Termenii T si R se refera la flexibilitatea otigomerului, respectiv felul si numarul interactiunilor intre monomeri. in lipsa substratului starea predominanta este starea T.
Daca se considera numai interactiunea de tip homotrop, fixarea substratului la starea T se face cu atat mai greu cu cat concentratia lui este mai mica (Fig. 18, portiunea O-A pe curba 1). Intr-o enzima alosterica formata numai din doi monomeri fixarea substratului la unul dintre acestia determina tranzitia T R; in virtutea postulatului simetriei, dar si al principiului cooperarii, al doilea monomer dobandeste automat conformatia R si el va fixa mult mai usor substratul (Fig. 21; portiunea A-B, pe curba, din Fig. 18), portiunea B-C pe aceeasi curba, corespunde saturarii enzimei cu substrat.
La o enzima alosterica formata din patru sau mai multi monomeri efectul cooperativ este mult mai pronuntat deoarece fixarea substratului la un singur monomer determina tranzitia T R la intreg oligomerul.
La enzimele homotrop-heterotrope, efectul madulatorilor se suprapune peste cel al substratului. Cei pozitivi (activatorii) stabilizeaza conformatia R, deci favorizeaza deplasarea echilibrului T R spre dreapta; cei negativi (inhibitorii) stabilizeaza conformatia T (Fig. 22; curbele 2, respectiv 3 pe Fig.18).
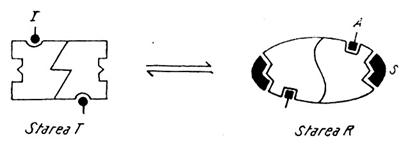
Fig. 22. Stabilizarea starii T a enzimelor alosterice
de catre inhibitori si a starii R de catre activatori.
Diferenta esentiala intre modelul secvential si modelul simetric consta in aceea ca primul abandoneaza principiul simteriei. Legarea substratului de catre un monomer reclama si in acest caz tranzitia T R dar nu este exclusa interactia starii R a acestuia cu starile T ale celorlalti monomeri. Cooperativitatea se restrange de asta data la influenta monomerilor T si R vecini. Legarea substratului de catre primul monomer se face si in acest caz cu dificultate datorita starii T a tuturor monomerilor enzimei. Modificandu-si conformatia prin legarea substratului, acest monomer va induce modificarea corespunzatoare doar la monomerul vecin care va fixa substratul cu mai multa usurinta. Chiar daca numarul enzimelor cu cooperativitate negativa este foarte mic (dintre acestea se citeaza tirozil-ARNt-sintetaza), modelul secvential s-a dovedit a fi mult mai potrivit decat cel simetric in cazul acestora.
Ulterior elaborarii celor doua modele, Eigen a demonstrat ca ele sunt cazuri particulare ale unei scheme mult mai complexe; dependent de particularitatile structurilor tertiara si cuaternara, unele enzime alosterice actioneaza dupa modelul simetric, altele dupa cel secvential, altele dupa modelul generalizat (cel propus de Eigen).
Sub aspect cinetic, Hill a stabilit o ecuatie cu valabilitate atat pentru enzimele Michaeliene cat si pentru cele alosterice:
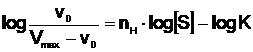
unde v0, Vmax si S au semnificatiile cunoscute, K este constanta specifica pentru interactiunea enzima-ligand; nH este coeficientul Hill, o constanta empirica care reflecta atat numarul locusurilor de fixare a liganzilor cat si intensitatea interactiunii acestora.
Reprezentand grafic log v0/Vmax - v0 in functie de log aSs (Fig. 23) se obtine dreapta 1 (pornind din origine) pentru enzime lipsite de cooperativitate, dreapta 2 (intersectie abscisa) pentru cele cu cooperativitate pozitiva si 3 (intersectie ordonata) pentru cele cu cooperativitate negativa. Panta dreptelor 2 si 3 reda gradul de cooperativitate.
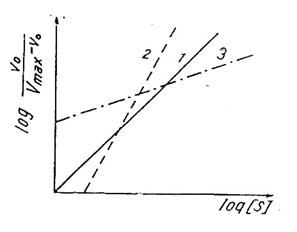
Fig. 23. Dreptele obtinute la reprezentarea grafica a ecuatiei
Hill pentru enzime lipsite de cooperativitate (1), cu cooperativitate pozitiva (2) si cooperativitate negativa (2).
In ultimii 15-20 ani s-au evidentiat la unele enzime alosterice structuri si mecanisme de actiune mult mai complexe. Un exemplu este aspartat-transcarbamilaza, enzima cu rol de reglare in calea de biosinteza a nucleotidelor pirimidinice (vezi si capitolul 'Metabolismul nucleotidelor purinice si pirimidinice'). Enzima are 12 subunitati dintre care sase sunt 'catalitice' si sase sunt 'reglatorii'. In starea T, subunitatile catalitice sunt grupate in doi trimeri iar subunitatile reglatorii sunt grupate in trei dimeri, intreg ansamblul avand o anumita simetrie si o maxima compactizare. Tranzitia T R consta in trecerea spre un aranjament cu o alta simetrie, in care ansamblul subunitatilor este mult mai deschis. Cele doua substrate se leaga numai la unitatile catalitice: legarea si transformarea se realizeaza printr-un mecanism cooperativ sofisticat si deosebit de eficient. Produsul final al caii metabolice, acidul citidintrifosforic (CTP) se leaga numai la subunitatile reglatorii producand o inhibitie feed-back.
4. REGLAREA ALOSTERICA A FUNCTIEI HEMOGLOBINEI
Reglarea alosterica nu se restrange numai la enzime. Functia hemoglobinei este reglata tot printr-un asemenea mecanism.
Hemoblobina (Hb) si mioglobina (Mb) sunt hemoproteine care in organism indeplinesc functii esentiale: prima transporta 02 de la plamani Ia celelalte tesuturi si CO2 in sens invers, cea de a doua depoziteaza si disperseaza oxigenul in muschi. Structurile componentelor proteice ale Mb si Hb sunt prezentate in alte capitole ('Proteine', 'Metabolismul hemoproteinelor'). Cunoasterea acestora este necesara pentru intelegerea reglarii alosterice a functiei Hb.
Din punct de vedere functional, comun pentru Mb si Hb este fixarea O2 la nivelul hemului: mai precis, O2 se dispune intre Fe2+ (legandu-se coordinativ la acesta) si histidina distala (cu aceasta interactioneaza electrostatic). Din faptul insa ca Mb nu are structura cuaternara si deci fixeaza o singura molecula de O2, in timp ce Hb are structura tetrametrica si fixeaza patru molecule de O2, rezulta diferente importante intre ele. Acestea se reflecta in aspectul hiperbolic al curbei de oxigenare a Mb fata de cel sigmoidal in cazul oxigenarii Hb in conditiile fiziologice (Fig. 24). Valorile presiunii de semisaturare calculate din curbele specifice sunt, de asemenea, net diferite: 1 mm Hg pentru Mb si 26 mm Hg pentru Hb (presiunea de semisaturare, notata P50, reprezinta presiunea partiala a O2 la care Mb si Hb se oxigeneaza in proportie de 50%).
Efectul cooperativ, responsabil de curba sigmoidala a Hb (si de P50 ridicata) este complex, de tip homotrop-heterotrop.
Pentru simplificare, se prezinta mai intai aspectul homotrop al efectului. El poate fi studiat pe Hb izolata din eritrocite, adusa in solutie apoasa din care O2 este apoi indepartat; Hb complet lipsita de O2 se numeste deoxigenata. Daca in aceasta solutie se introduce O2 a carui presiune creste treptat de la 0 la 100 mm Hg si se determina pe parcurs cata Hb a fixat O2, se obtine o curba sigmoidala apropiata de cea din Fig 1 (diferenta fata de aceasta tine de influenta in conditiile fiziologice a factorilor care determina caracterul homotrop-heterotrop al efectului). Interpretarea, bazata si pe alte masuratori experimentale directe, este ca Hb deoxigenata este in starea T, cu afinitate foarte redusa pentru O2. Structural, aceasta stare se caracterizeaza printr-un numar maxim de interactiuni atat intracatenare cat si intercatenare; intereseaza mai ales un numar de opt legaturi ionice stabilite intre grupari carboxil si amino (Fig. 25).
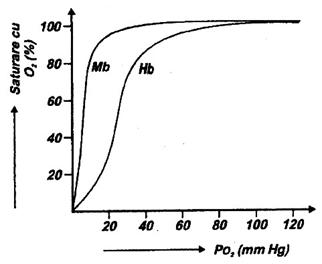
Fig. 24. Curbele de oxigenare ale miogiobinei (Mb) si hemoglobinei (Hb).
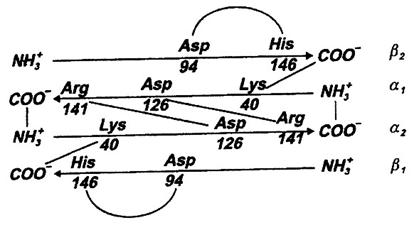
Fig. 25. Legaturi ionice intre subunitatile Hb in starea T; acestea se scindeaza cand Hb se oxigeneaza.
Importanta deosebita are si faptul ca in starea T Fe2+ din fiecare subunitate este situat in afara planului protoporfirinei IX (la o distanta de 0,6 A) ca urmare a legarii lui de histidina proximala (Fig. 26.)
Neinsemnata la inceput, acceptarea O2 de catre Hb se face simtita pe masura ce se 'forteaza' prin cresterea presiunii. Fixarea O2 la o prima subunitate (sau, dupa Perutz, deodata la cele doua subunitati a), este corelata cu modificari structurale relativ insemnate nu numai la nivelul acesteia (acestora) ci, in concordanta cu modelul simetric (considerat potrivit pentru Hb), la nivelul tuturor subunitatilor. Semnalul este dat de revenirea in planul protoporfirinei DC a Fe2+ ca urmare a legaturii ce se stabileste intre acesta si O2 care se plaseaza intre planul hemului si histidina distala. Cum legatura Fe2+ cu histidina proximala nu se scindeaza in urma fixarii O2 (Fe2+ trece doar din starea pentacoordinata in starea hexacoordinata), sunt antrenate prin acest rest aminoacidic modificari in structurile secundara si tertiara ale fiecarei subunitati Se scindeaza totodata si cele opt legaturi ionice fiind angajate modificari semnificative in structura cuatemara. S-a stabilit de altfel, in urma unor analize prin difractia razelor X, ca un dimer se roteste in raport cu celalalt, considerat fix, cu 150. Aceste modificari (influentate si factorii de care se face deocamdata abstractie) constituie de fapt tranzitia T R a Hb. Afinitatea mare pentru O2 a starii R se traduce printr-o rapida fixare a acestuia de catre subunitatile 2, 3 si 4 (sau 3 si 4). Doar in apropierea presiunii de 100 mm Hg, capacitatea de fixare diminua ca urmare a saturarii.
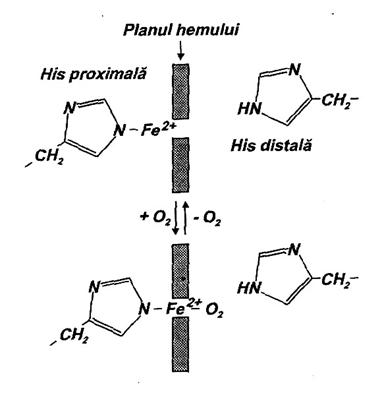
Fig. 26. Pozitia Fe2+ fata de planul hemului in Hb neoxigenata si oxigenata.
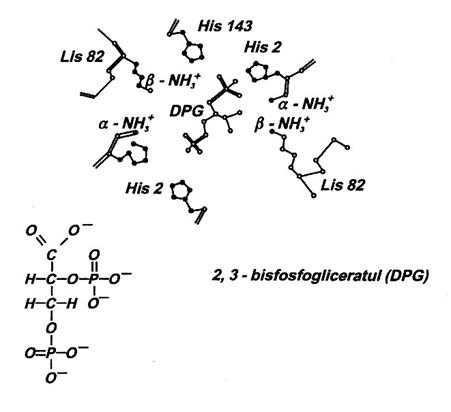
Fig. 27. Structura 2,3-DPG si intercalarea acestuia
in cavitatea centrala a Hb neoxigenate.
O variatie atat de mare a presiunii partiale a O2 pentru ca acesta sa se fixeze pe Hb ar constitui, in vivo, un dezavantaj. In plamani insa presiunea partiala a O2 nu variaza intre 0 si 100 mm Hg ca in conditiile experimentale descrise ci ea este constant la nivelul valorii maxime. Aceasta inseamna ca doar ultima portiune a curbei din Fig. 24 este valabila pentru conditiile fiziologice, ceea ce si explica oxigenarea extrem de usoara a Hb.
Pe de alta parte, cedarea O2 la nivelul tesuturilor este favorizata si chiar determinata de conditiile fixarii redate in Fig. 24. Evident, disocierea O2 de Hb se face dupa aceeasi curba dar parcursa in sens invers; presiunea partiala a O2, care este in tesuturi de cea 30 mm Hg, favorizeaza procesul cedarii sale de catre Hb dar il si intrerupe in momentul cand Hb este inca oxigenata in proportie de 50-60%. Deci, Hb va prelua in plamani doar restul de 40-50% O2 ceea ce favorizeaza suplimentar oxigenarea.
Conditiile descrise ale oxigenarii si deoxigenarii Hb asigura si alte avantaje functionale:
a) in muschi, O2 cedat de Hb este deosebit de usor preluat de Mb (a se compara curbele de oxigenare din Fig. 24);
a) tot cu usurinta este cedat O2 in timpul sarcinii, de la Hb mamei (HbA2) la Hb embrionului (HbE =22) si Hb fatului (HbF = =22) ale caror curbe de oxigenare sunt, de asemenea, sigmoidale, dar deplasate la stanga in raport cu cea a HbA2.
Efectul homotrop avut in vedere pana acum pentru fixarea O2 pe Hb (dar si pentru disociere), este completat de actiunile compusilor 2,3-bisfosfoglicerat si CO2 precum si ale ionilor H+; de aceea, pe ansamblu, efectul cooperativ este in acest caz de tip homotrop-heterotrop.
2,3-bisfosfogliceratul (2,3-DPG), sintetizat in cursul glicolizei si prezent in eritrocite intr-o concentratie egala cu aceea a Hb, intervine astfel: in starea T se intercaleaza in chiar cavitatea centrala a Hb ca urmare a atractiilor electrostatice intre gruparile sale ionizate negativ si grupari ionizate pozitiv (amino) ale lanturilor de tip a si, mai ales, de tip (Fig. 27). Prin aceasta starea T a Hb este suplimentar consolidata, dificultatea fixarii O2 crescand (curba 2 in Fig. 18). Dupa ce insa Hb a fixat O2 la o subunitate (sau la doua) modificarea conformationala a tuturor subunitatilor, responsabila de tranzitia T R, face incompatibila ramanerea 2,3-DPG in cavitatea centrala (care se micsoreaza). De aceea curba de oxigenare a Hb lipsita de 2,3-DPG isi pierde in buna masura aspectul sigmoidal. Invers se petrec evenimentele la nivelul tesuturilor unde 2,3-DPG favorizeaza cedarea O2.
Christian Bohr (tatal celebrului fizician Niels Bohr) a facut, in anul 1904, observatia ca Hb cedeaza mai usor O2 daca pH-ul este mai scazut decat cel fiziologic si presiunea partiala a CO2 este mare; in literatura de specialitate aceste constatari sunt cunoscute sub numele de 'efect Bohr'.
Explicatia data efectului Bohr, despre care se stie in prezent ca este mult mai complicat, se restrange aici la aspectele esentiale. Astfel, in vivo, concentratii mari ale CO2 si ionilor de hidrogen sunt la nivelul tesuturilor unde rezulta prin procesele catabolice; ionii de hidrogen mai rezulta:
a) la formarea intre Hb (dar si alte proteine din plasma) a carbamatilor sub forma carora cca. 15% din CO2 este transportat la plamani in vederea eliminarii; gruparile amino care reactioneaza cu CO2 sunt ale unor aminoacizi N-terminali din lanturile Hb si celorlalte proteine:
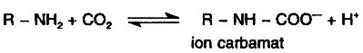
b) la transformarea marei majoritati a CO2 (cc.85%) in ionul bicarbonat, compus solubil, care este transportat de asemenea la plamani:
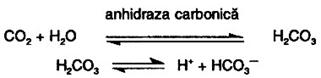
Valoarea mai mica decat 7,4 a pH-ului (cat este valoarea normala in sange) si presiunea partiala mare a CO2 favorizeaza cedarea O2, curba de oxigenare fiind deplasata spre dreapta (Fig. 28).
In plamani echilibrele reactiilor de la punctele a si b sunt deplasate spre stanga datorita eliminarii CO2 prin respiratie. Concentratia ionilor H+ descreste, pH-ul depaseste usor valoarea de 7,4; curba de oxigenare se deplaseaza la stanga fiind favorizata fixarea O2 pe hemoglobina.
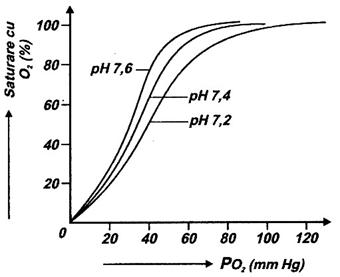
Fig. 28. Deplasarea curbei de oxigenare
a Hb in functie de valoarea pH-ului.
5. REGLAREA COVALENTA A ACTIVITATII ENZIMELOR
In prezent se cunosc multe enzime cu rol reglator a caror conversie forma inactiva - forma activa are loc prin modificari chimice care implica formarea sau ruperea unor legaturi covalente.
Cazul cel mai frecvent este al enzimelor care se activeaza prin fosforilare-defosforilare. Fosforilarea se face de catre ATP care transfera, de regula, un singur rest de acid fosforic; acesta esterifica grupari hidroxil ale unor resturi de serina, mai rar tirozina sau treonina, care nu fac parte din centrul activ. Reactiile de fosforilare sunt catalizate de kinaze specifice, care, la randul lor, pot exista in forme fosforilate numite fosfokinaze si defosforilate numite defosfokinaze. Fiind puternic exergonice, reactiile de fosforilare sunt ireversibile. Transformarea inversa, forma defosforilata - forma fosforilata, se face hidrolitic in prezenta unor fosfataze specifice-, si aceste reactii sunt ireversibile (Fig. 29).
Enzimele interconvertibile prin fosforilare-defosforilare apar numai in celulele organismelor superioare. Dupa caz, unele enzime interconvertibile pe aceasta cale sunt active in forma fosforilata (glicogenfosforilaza) sau defosforilata (glicogensintetaza). Activarea unor enzime prin fosforilare (defosforilare) este, de multe ori, etapa ultima intr-o cascada de evenimente declansata odata cu fixarea de catre celule a unor hormoni sau alti compusi chimici cu rol reglator. Aceste mecanisme sunt tratate in capitolul 'Hormoni'.
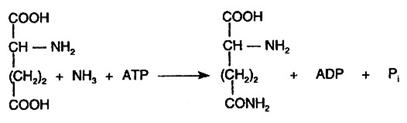
O activare-inactivare printr-un mecanism covalent aparte este intalnita la enzima glutaminsintetaza care catalizeaza reactia:
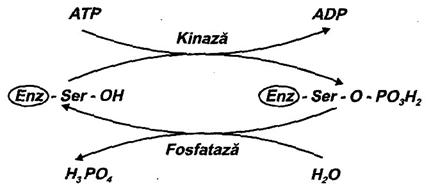
Fig. 2 Reglarea activitatii enzimelor prin fosforilare-defosforilare.
Forma activa a enzimei este transformata in forma inactiva prin adenililare' (atasarea printr-o legatura covalenta a unui rest de AMP). Ca si fosforilarea, adenililarea se face cu ATP dar la un rest de tirozina; reactia este ireversibila. Revenirea la forma activa se face si in acest caz prin hidroliza (Fig.30).
Glutaminsintetaza este o enzima a carei activitate este reglata atat alosteric cat si covalent. Reglarea covalenta este cea aratata. Reglarea alosterica prezinta doua aspecte: este multipla in sensul ca exista noua compusi cu rol de modulatori negativi (intre care histidina, triptofanul, carbamilfosfatul) si cativa modulatori pozitivi; pe de alta parte, este cumulativa in sensul ca modulatorii pot actiona simultan (in totalitate sau numai unii) si atunci efectul lor se insumeaza.
Tot activari de tip covalent sunt si transformarile proenzimelor de tipul pepsinogenului, tripsinogenului, chimotripsinogenului, procarboxidazei etc. in enzimele pepsina, tripsina, chimotripsina, carboxipeptidaza.
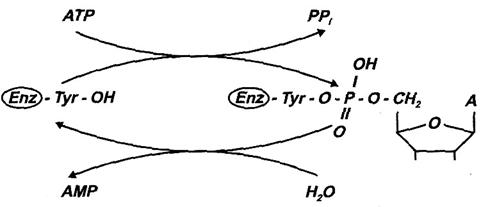
Fig. 30. Reglarea activitatii glutamin-sintetazei
prin adeninilare-deadeninilare.
Formele inactive (zimogenii) sunt cele produse la locul de sinteza (mucoasa gastrica pentru pepsinogen, pancreasul pentru toate celelalte); activarile se produc la locul de actiune (stomac, intestinul subtire). Aceste activari au loc atat sub actiunea unor factori locali cat si autocatalitic, dupa schema generala:
Zimogen Factor local (pH, enzima, autocatalitic) Enzima activa
![]()
Transformarile acestea sunt unidirectionale, nu exista posibilitatea refacerii zimogenului din enzimele active. Modalitatile particulare de activare a acestor enzime se pot urmari in capitolul 'Metabolismul proteinelor si al aminoacizilor'.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Analize pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








