
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Sisteme disperse - sistemul eterogen: Solutii. Solubilitate. Concentratia solutiilor |
Sisteme disperse - sistemul eterogen: Solutii. Solubilitate. Concentratia solutiilor
Sistemul dispers este imaginat ca fiind compus dintr-o substanta, repartizata sub forma de particule mici intr-o alta substanta cu care vine in contact. Dupa gradul de amestecare, sistemele disperse pot fi: omogene si eterogene. Sistemul este omogen daca are aceleasi proprietati in orice punct al sau sau daca acestea variaza continuu de la un punct la altul. Asa, de exemplu, un vas umplut cu o solutie de CuSO4 constituie un sistem omogen, pentru ca are aceeasi concentratie in orice loc al vasului. Cu alte cuvinte, sistemele disperse omogene nu prezinta suprafete de separare, adica componentii sistemului formeaza o singura faza.
Sistemul eterogen este alcatuit din doua sau mai multe componente si prezinta salturi ale proprietatilor in anumite locuri ale sistemului. Locurile in care se produc salturi ale proprietatilor se numesc suprafete de separare iar domeniile omogene delimitate de suprafete de separare se numesc faze. Daca intr-o topitura de staniu se introduce o bucata de fier, acesta ramane in stare solida; sistemul este eterogen pentru ca este format din faza lichida (topitura) si faza solida (fierul), separate intre ele prin suprafata de separare. Tot asa, intr-un pahar, uleiul si apa formeaza doua faze distincte.
Sistemele disperse sunt formate din: mediu de dispersie (componenta predominanta) si faza dispersata (substanta dispersata in mediul de dispersie). Exemple de sisteme disperse:
- gazoase - mediul de dispersie este gaz si faza dispersata poate fi gaz, lichid sau solid
g - g aerul (80% N2, 20% O2)
g - l ceata (picaturi de apa dispersate in aer)
g - s fumul (particule solide dispersate in aer)
- lichide - mediul de dispersie este lichid si faza dispersata poate fi gaz, lichid sau solid
l - g apa carbogazoasa (CO2 dizolvat in apa la presiune)
l - l amestec alcool - apa
l - s amestec zahar (sare) cu apa
- solide - mediul de dispersie este solid si faza dispersata poate fi gaz, lichid sau solid
s - g H2 absorbit pe Pd sau Pt
s - l apa in unt, geluri
s - s aliaje
Experimental s-a dovedit ca proprietatile sistemelor disperse depind foarte mult de marimea particulelor fazei dispersate. Daca particulele fazei dispersate sunt mai mari de 100mm, sistemele disperse sunt instabile, adica faza dispersa se poate separa de mediul de dispersie prin operatii de filtrare, centrifugare, decantare etc. Daca marimea particulelor fazei dispersate este mai mica de 1mm, sistemele disperse sunt foarte stabile, adica faza dispersa nu se poate separa de mediul de dispersie prin nici o metoda fizica. Aceste sisteme disperse, la care gradul de dispersie a componentilor este de ordinul de marime al moleculelor se numesc dispersii moleculare sau solutii. Un loc intermediar il ocupa dispersiile coloidale sau coloizii, unde particulele fazei dispersate sunt mai mari de 1mm, dar mai mici de 100mm. In cazul dispersiilor moleculare (solutiilor), mediul de dispersie se va numi solvent sau dizolvant si dispersatul se va numi solvat sau substanta dizolvata. De exemplu, in solutia de NaCl in apa, NaCl este substanta dizolvata si apa, solventul.
Solutii. Solubilitate. Concentratia solutiilor. Solutiile sunt amestecuri omogene de doua sau mai multe substante. Dupa numarul componentilor, solutia poate fi binara, ternara, etc.
Unele substante solide se dizolva usor, altele se dizolva cu multa dificultate. Se pune intrebarea care este cauza care determina dizolvarea substantelor solide? La dizolvarea unei substante solide concureaza trei tipuri de forte de atractie: intre ionii sau moleculele substantei solide (energia de retea), intre moleculele solventului (legaturi de hidrogen sau forte van der Waals), intre ionii sau moleculele substantei care se dizolva si moleculele solventului (energie de solvatare sau energie de hidratare cand solventul este apa). Atunci cand fortele de solvatare depasesc celelalte forte, substantele se dizolva usor. In caz contrar, substantele se dizolva cu mare dificultate.
In general, cand doua sau mai multe substante se amesteca pentru a forma o solutie, volumul solutiei rezultate nu este egal cu suma volumelor substantelor amestecate, ci se produce o contractie de volum.
In functie de cantitatea de substanta dizolvata, solutiile pot fi: infinit diluate, diluate, concentrate, saturate, nesaturate si suprasaturate. Solutiile infinit diluate sunt solutii care rezulta prin dizolvarea unei cantitati infime de substanta intr-o cantitate foarte mare de solvent. Solutiile diluate sunt solutii care rezulta prin dizolvarea unei cantitati mici de substanta dizolvata in comparatie cu cantitatea de solvent. Solutiile concentrate sunt solutii care rezulta prin dizolvarea unei cantitati de substanta de acelasi ordin de marime cu cantitatea de solvent. Solutiile saturate sunt solutii care rezulta prin dizolvarea cantitatii maxime de substanta dizolvata intr-o anumita cantitate de solvent, la o temperatura data (aceasta concentratie, corespunzatoare saturarii, se numeste solubilitate). Solutiile nesaturate sunt solutii care contin o cantitate de substanta dizolvata inferioara celei necesare saturarii. Solutiile suprasaturate sunt solutii care contin o cantitate mai mare de substanta dizolvata fata de cea necesara saturarii.
Starea de suprasaturare este o stare metastabila si ajunge o mica actiune din exterior pentru ca excesul de substanta dizolvata sa se separe din solutie. De exemplu, daca intr-o solutie saturata de NaCl se adauga cateva grame de sare solida, aceasta nu se mai dizolva. Incalzind solutia, sarea adaugata in exces se dizolva. Prin racirea precauta a solutiei rezultate se poate micsora temperatura fara ca procesul de cristalizare sa inceapa, astfel se obtine o solutie suprasaturata.
Caracterul metastabil al starii solutiei suprasaturate reiese din aceea ca agitarea solutiei, frecarea peretelui vasului cu o bagheta de sticla sau adaugarea unui cristal mic, poate declansa recristalizarea excesului de substanta dizolvata si solutia devine saturata. Solutia saturata poate fi considerata ca o solutie concentrata (in cazul substantelor usor solubile) dar poate fi si o solutie foarte diluata (in cazul substantelor greu solubile).
Concentratia unei solutii este o marime definita prin cantitatea de substanta dizolvata intr-o cantitate de solutie sau solvent. Principalele moduri de exprimare a concentratiei unei solutii sunt:
- concentratia procentuala de masa (C%) - masa de substanta dizolvata in 100g solutie,
- concentratia molara sau molaritatea (CM) - numarul de moli de substanta dizolvata in 1 litru solutie,
- concentratia normala sau normalitatea (CN) - numarul de echivalenti gram de substanta dizolvata in 1 litru solutie,
- titrul solutiei (T) - masa de substanta dizolvata in 1cm3 solutie,
- concentratia molala sau molalitatea (Cm) - numarul de moli de substanta dizolvata in 1000g solvent,
- fractia molara - numar de moli din fiecare component raportat la numarul total de moli din solutie.
O solutie are concentratia procentuala x% daca 100g solutie contin x g substanta dizolvata si (100-x) g solvent. Se introduc notatiile: md - masa de substanta dizolvata, msolvent - masa de solvent, ms - masa de solutie.
![]()
C - concentratia in procente de masa a solutiei
![]()
Calculele care implica o concentratie procentuala presupun folosirea masei ca marime dimensionala in g sau kg. In cazul masurarii unor volume de solutii, pentru a le utiliza in calcule cu concentratii procentuale, se aplica formula densitatii solutiilor:
![]()
|
O solutie 1M contine 1mol de substanta dizolvata in 1l sau 1000 cm3 solutie.
![]()
M - masa molara a substantei dizolvate
O solutie 1N contine 1 echivalent gram (val) de substanta dizolvata in 1l sau 1000 cm3 solutie.
![]()
Eg - echivalentul gram al substantei dizolvate
![]()
![]()
![]()
Considerand o solutie binara ce contine n moli de substanta dizolvata si n moli de solvent, atunci fractiile molare X1 (substanta dizolvata) si X2 (solvent) sunt:
![]()
![]()
si ![]() .
.
Exista anumite marimi care in cazul solutiilor foarte diluate sunt direct proportionale cu concentratia solventului dar la concentratii mai mari apar abateri de la aceasta proportionalitate directa. In asemenea situatii, se foloseste o concentratie corectata, numita concentratie activa sau activitate. Intre activitatea a si concentratia C a solutiei exista relatia:
![]()
unde f este factorul de activitate si este, in general, subunitar.
Solubilitatea este proprietatea substantelor de a se dizolva intr-un solvent oarecare. Din punct de vedere al solubilitatii, substantele pot fi: usor solubile, moderat solubile si greu solubile. Nu se poate considera ca exista substante absolut insolubile, ci exista substante care au coeficient de solubilitate foarte mic (BaSO4, AgCl) incat practic sunt considerate insolubile.
Solubilitatea substantelor (notata S) se determina usor pe cale experimentala si este egala cu numarul maxim de grame (solubilitate exprimata in grame) sau numarul maxim de moli (solubilitate molara) de substanta care se dizolva intr-o cantitate data de solvent sau intr-un litru de solutie.
Substantele greu solubile se caracterizeaza printr-o constanta importanta, numita produs de solubilitate (notata PS). Daca se considera o solutie saturata a unei sari MmNn care se afla in echilibru cu cristalele sale:
![]()
constanta de echilibru este:
![]()
Pentru o temperatura data,
concentratia molara a fazei solide ![]() este o constanta
si atunci se include in expresia constantei de echilibru.
este o constanta
si atunci se include in expresia constantei de echilibru.
![]()
Pentru fiecare substanta, produsul de solubilitate se calculeaza in functie de solubilitate. Cum solubilitatea este data de relatiile:
![]()
se observa usor ca intre solubilitate si produsul de solubilitate exista relatia:
![]()
O substanta este cu atat mai solubila, cu cat solubilitatea sa este mai mare si cu atat mai insolubila, cu cat produsul de solubilitate este mai mic.
Solubilitatea substantelor are importanta deosebita atat in controlul analitic al materiilor prime si a produsilor finiti, cat si in alegerea diferitelor tehnologii de separare a substantelor, in laborator sau in practica industriala.
Solubilitatea substantelor solide depinde de natura substantei dizolvate si a solventului si de temperatura. In literatura chimica exista curbe de solubilitate pentru o serie de substante solide astfel incat pe baza analizei curbelor de solubilitate se poate determina solubilitatea substantelor la anumite temperaturi.
Solubilitatea substantelor lichide. Alcoolul se dizolva in apa, dar si invers, fenomenul se numeste miscibilitate reciproca. S-a constatat ca lichidele care se prezinta sub forma de asociatii moleculare prin legaturi de hidrogen si care dispun de o presiune interna foarte mare, sunt miscibile intre ele (apa, alcooli, glicerina, acizi carboxilici inferiori, etc.). Aceste lichide sunt nemiscibile cu lichide neasociate (benzen, toluen, ulei, etc.). Astfel, se intalnesc:
- lichide total miscibile: apa - alcool, apa - glicerina, apa - acid acetic, benzen - toluen,
- lichide partial miscibile: apa - eter, apa - fenol,
- lichide nemiscibile: apa - ulei, alcool - toluen.
Miscibilitatea creste cu cresterea temperaturii. S-a constatat ca doua lichide partial miscibile la o anumita temperatura, pot deveni total miscibile peste o temperatura mai ridicata, numita punct critic de miscibilitate.
Solubilitatea substantelor gazoase. Un gaz se dizolva intr-un lichid pana se atinge un echilibru de saturatie, dependent de temperatura, presiune, compozitia solutiei. Nu se poate afirma ca solubilitatea gazelor in lichide scade cu cresterea temperaturii. De exemplu, solubilitatea NH3 in apa scade puternic cu cresterea temperaturii dar in cazul sistemelor N2 - apa si O2 - apa se constata ca initial solubilitatea scade cu cresterea temperaturii, dupa care de la o anumita temperatura creste cu cresterea temperaturii.
Influenta presiunii asupra solubilitatii substantelor gazoase este indicata de legea solubilitatii gazelor, cunoscuta si sub numele legea lui Henry. Legea lui Henry stabileste ca masa unui gaz dizolvat intr-un anumit volum de solvent, la temperatura constanta, este proportionala cu presiunea partiala a gazului aflat in echilibru cu solutia.
![]()
K - constanta lui Henry, m - masa de gaz dizolvat, p - presiunea partiala a gazului.
Daca exista un amestec de gaze, solubilitatea fiecarui gaz este determinata de presiunea partiala a gazului care se dizolva si nu de presiunea totala a amestecului gazos.
![]()
pi - presiunea partiala a gazului i din amestecul de gaze, xi - proportia gazului i in amestecul de gaze, P - presiunea totala a amestecului gazos.
Proprietati coligative ale solutiilor. Se numesc proprietati coligative ale solutiilor acele proprietati care sunt proportionale cu concentratiile molare ale substantelor dizolvate si sunt independente de natura chimica a acestora. Astfel, cand se dizolva o substanta are loc o micsorare a presiunii de vapori a solutiei fata de solvent, o crestere a punctului de fierbere, o micsorare a punctului de inghetare si aparitia unei presiuni osmotice.
La dizolvarea unei substante nevolatile (zahar, sare, etc.) intr-un solvent (apa, alcool, eter, etc.) se constata ca presiunea de vapori a solutiei obtinute este mai mica decat a solventului pur, la aceeasi temperatura. Pe baza acestei constatari, Raoult a stabilit o lege potrivit careia: "Scaderea presiunilor de vapori ai unei solutii fata de presiunea de vapori a solventului este direct proportionala cu fractia molara a substantei dizolvate".
Notand cu p0 presiunea de vapori a solventului, cu p presiunea de vapori a solutiei si cu x2 fractia molara a substantei dizolvate, legea lui Raoult poate fi scrisa astfel:
![]() .
.
Inlocuind fractia molara:
![]()
unde: ![]() si
si ![]() , in care: n si n reprezinta numarul de moli de solvent,
respectiv de substanta dizolvata, m1 cantitatea de
solvent, a carui masa moleculara este M1, m2
cantitatea de substanta dizolvata cu masa moleculara M2,
legea lui Raoult capata urmatoarea forma:
, in care: n si n reprezinta numarul de moli de solvent,
respectiv de substanta dizolvata, m1 cantitatea de
solvent, a carui masa moleculara este M1, m2
cantitatea de substanta dizolvata cu masa moleculara M2,
legea lui Raoult capata urmatoarea forma:
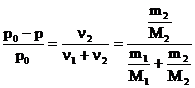 .
.
In cazul solutiilor foarte diluate, n >>n incat n de la numitor poate fi neglijat iar legea lui Raoult devine:
![]()
de unde:
![]() ,
,
relatie care arata ca prin masurarea scaderii presiunii de vapori a unei solutii se poate calcula masa moleculara a substantei dizolvate M2, marimile p0, m1, m2 si M1 fiind cunoscute. Solutiile ce se supun legii lui Raoult se numesc solutii ideale. Foarte putine solutii au comportare ideala, motiv pentru care se abat de la aceasta lege. Totusi, in cazul solutiilor foarte diluate, aceste abateri sunt mici, putand fi neglijate.
Asadar, legea lui Raoult permite sa se calculeze presiunea de vapori a unei solutii cand se cunoaste concentratia si presiunea de vapori a solventului si masa moleculara a substantei dizolvate. Scaderea presiunii de vapori a solutiei conduce la alte doua consecinte: cresterea punctului de fierbere si scaderea punctului de congelare (inghetare) a solutiilor in raport cu solventul. De studiul fierberii solutiilor se ocupa ebulioscopia iar studiul inghetarii solutiilor se numeste crioscopie.
Un lichid fierbe cand presiunea lui de vapori este egala cu presiunea atmosferica. Micsorarea presiunii de vapori a unei solutii va avea drept consecinta cresterea punctului ei de fierbere in raport cu solventul. Din aceasta cauza, solutiile apoase fierb la o temperatura mai mare de 1000C. Pentru acelasi solvent, cresterea punctului de fierbere Dtf este proportional cu cantitatea de substanta dizolvata intr-o anumita cantitate de solvent, adica cu concentratia molara c a substantei dizolvate:
Solutiile ingheata la temperaturi mai coborate decat solventii puri, si anume: cu atat mai scazute, cu cat concentratia lor este mai mare. Ca si in ebulioscopie, scaderea punctului de topire nu este dependenta de natura substantei dizolvate, ci numai cu natura solventului. Depresiunea produsa de un mol de substanta dizolvata in 1000g solvent poarta numele de constanta crioscopica (K). Pentru acelasi solvent, scaderea punctului de topire Dtc este proportional cu concentratia molara a substantei dizolvate:
Se obtine:
![]() ,
,
Osmoza este fenomenul care se produce atunci cand doua solutii de concentratii diferite sau o solutie si solventul adecvat sunt separate printr-o membrana semipermeabila, caz in care are loc o patrundere a moleculelor de solvent prin membrana. Osmometrul consta dintr-un vas cilindric de sticla inchis la partea inferioara cu o membrana semipermeabila si la partea superioara legat etans cu un tub de sticla. Datorita osmozei, in solutia din celula osmotica ia nastere o presiune (numita presiune osmotica) care se opune tendintei solventului de a mai trece prin membrana. Presiunea osmotica reprezinta presiunea ce trebuie aplicata unei solutii pentru a realiza echilibrul dintre solutie si solvent. Marimea presiunii osmotice p poate fi calculata din diferenta de inaltime h care se realizeaza intre nivelul solutiei din celula osmotica si nivelul solventului:
![]()
![]()
analog legii Boyle-Mariotte, unde: ![]()
2. La o concentratie constanta, presiunea osmotica p a unei solutii este direct proportionala cu temperatura solutiei:
![]()
analog cu legea lui Gay-Lussac pentru gaze: ![]()
Prin combinarea celor doua legi ale presiunii osmotice, van't Hoff a formulat legea generala a presiunii osmotice:
![]()
in care: c - concentratia molara a solutiei, R - constanta generala a gazelor, T - temperatura absoluta a solutiei, lege valabila doar pentru solutii ideale de neelectroliti.
Analogia cu legile gazelor ideale a condus la formularea: presiunea osmotica a unei solutii este egala cu presiunea pe care ar exercita-o substanta dizolvata, daca ar fi in stare gazoasa la temperatura data si ar ocupa un volum egal cu cel al solutiei.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








