| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Stari de agregare |
Stari de agregare
STARI DE AGREGARE
Materia se poate prezenta in patru stari de agregare; plasma (99,98% din materia din univers ), gazoasa, lichida si solida. Pentru studiul materialelor de constructii intereseaza numai starile in care se gaseste materia in conditiile de pe pamant - temperatura si presiune - adica starile: gazoasa, lichida si solida.
Intr-un material aflat in conditii fizice bine determinate (temperatura si presiune) exista doua tendinte care actioneaza in sens opus si duc la realizarea starii sale proprii:
prima tendinta este datorata fortelor de legatura interparticulare (forte Van den Walls, legaturi de hidrogen etc.) sub actiunea carora particulele tind sa se dispuna ordonat, realizand o stare de echilibru saraca in energie;
a doua tendinta este datorata agitatiei termice a particulelor, ce nu dispare niciodata, marimea sa depinzand de temperatura si care duce la distrugerea structurii ordonate.
In functie de ponderea acestor tendinte, intr-un material se poate realiza una din cele trei stari de agregare
Starea solida la care predomina tendinta de ordonare, agitatia termica a particulelor manifestandu-se sub forma unor oscilatii de amplitudine mica in jurul unei pozitii de echilibru (considerata fixa in spatiu) si din acest motiv solidele au volum si forma proprie.
Starea lichida la care particulele constituente, sub influenta agitatiei termice executa o miscare de oscilatie si una de translatie, fara a produce modificari importante asupra distantei intre particule (care se gasesc la o distanta medie constanta, apropiata de echilibru) ceea ce determina ca lichidele sa aiba numai volum determinat.
Starea gazoasa caracterizata prin forte de atractie interparticulare foarte mici, particulele constituente sub actiunea agitatiei termice au o miscare de translatie haotica si din aceasta rezulta starea cu forma si volum nedeterminat.
1. Starea solida
La starea solida particulele se gasesc unele fata de altele la o distanta d0 (rezultata din tendinta de ordonare) proprie fiecarui material pentru o temperatura data.
1.1. Starea solida cristalina
Materia solida care are tendinta de a-si aseza particulele componente (ioni, atomi, molecule) in ordine (tipare geometrice regulate), caracterizata printr-o energie interna minima, formeaza starea solida cristalizata.
In solidele cristalizate ordinea particulelor componente este prezenta in tot volumul de material.
Aranjarea ordonata, in spatiu, a locurilor care pot fi ocupate de particulele starii cristaline, determina o retea spatiala, numita retea cristalina.
Locurile unde se dispun particulele in reteaua cristalina se numesc noduri ale retelei cristaline.
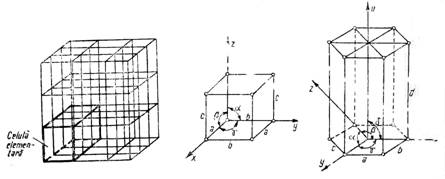
O unitate din retea prin translatia careia, dupa cele trei directii (muchii) se obtine o retea cristalina poarta denumirea de celula elementara (fig.1).
|
|
Fig. 1. Celula elementara
Directiile muchiilor celulei elementare se numesc axe cristalografice. Marimile relative ale muchiilor celulei elementare formeaza constantele retelei cristaline.
Ca elemente geometrice de baza in clasificarea solidelor cristalizate se iau in considerare marimile relative ale muchiilor a,b,c si unghiurile a b c din celula elementara.
Toate solidele cristalizate au ca baza de a forma sapte tipuri de celule elementare ce se numesc sisteme de cristalizare; fiecare sistem de cristalizare poate prezenta mai multe clase de simetrie (in total 32) fig.2.
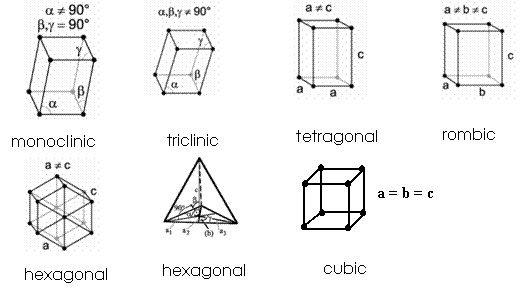
Fig.2. Sisteme de
cristalizare
Cristalele sunt solide cu forma poliedrica delimitata prin fete care se intretaie in muchii iar muchiile se intalnesc in colturi (noduri).
Aranjarea particulelor in nodurile retelei cristaline conduce la realizarea unei serii de elemente de simetrie ce definesc gradul de simetrie al cristalului. Elementele de simetrie sunt:
centrul de simetrie - punctul imaginar fata de care toate fetele, muchiile si nodurile sunt simetrice doua cate doua;
axa de simetrie - dreapta imaginara fata de care la rotirea celulei elementare particulele ocupa aceeasi pozitie de doua ori, trei, patru sau sase ori (axele de simetrie fiind astfel binare, ternare, cuaternare sau senare);
planul de simetrie - plan imaginar care imparte celula elementara in doua parti identice care se gasesc una fata de alta ca imaginea dintr-o oglinda.
Cu cat un cristal are mai multe elemente de simetrie cu atat are gradul de simetrie mai mare cu o structura mai compacta, cu legaturi mai puternice etc. Astfel, sistemul cubic si hexagonal au cele mai multe elemente de simetrie si formeaza solide compacte, intalnindu-se la majoritatea metalelor.
Natura particulelor din noduri si tipurile de legaturi dintre particule determina o serie de retele cristaline care pot fi:
a) Retele ionice
formate din ioni de semn contrar, monoatomice sau ioni complecsi
asezati alternativ in nodurile de retea si intre care se
realizeaza legaturi de natura electrostatica. Clorura de
sodiu formeaza o retea cristalina ionica, cu ioni
monoatomici de Na+ si Cl-; carbonatul si
sulfatul de calciu formeaza o retea cristalina cu ioni de Ca2+
si ioni complecsi de ![]() , respectiv
, respectiv ![]() . Datorita fortelor de legatura slabe
(electrovalente) solidele cu retele ionice se caracterizeaza prin
duritate, temperaturi de topire si rezistente mecanice medii, ruperi
casante etc. b) Retele moleculare
realizate cu molecule in nodurile de retea ce se leaga prin forte slabe de tip Van der Walls in
cazul moleculelor nepolare si forte de natura
electrostatica in cazul moleculelor polare si forte de
natura electrostatica in cazul moleculelor polare cu dipolmomentul
mare precum si prin legaturi de hidrogen (cazul ghetii).
Majoritatea substantelor organice cristalizeaza in astfel de
retele. Substantele cristaline cu retele moleculare se
caracterizeaza prin duritate mica, punct de topire redus etc.
. Datorita fortelor de legatura slabe
(electrovalente) solidele cu retele ionice se caracterizeaza prin
duritate, temperaturi de topire si rezistente mecanice medii, ruperi
casante etc. b) Retele moleculare
realizate cu molecule in nodurile de retea ce se leaga prin forte slabe de tip Van der Walls in
cazul moleculelor nepolare si forte de natura
electrostatica in cazul moleculelor polare si forte de
natura electrostatica in cazul moleculelor polare cu dipolmomentul
mare precum si prin legaturi de hidrogen (cazul ghetii).
Majoritatea substantelor organice cristalizeaza in astfel de
retele. Substantele cristaline cu retele moleculare se
caracterizeaza prin duritate mica, punct de topire redus etc.
c) Retele metalice - cu particulele sub forma ionica si legaturi metalice, ceea ce conduce la o mai mare compactitate a sistemului (cristalizari in sistemul cubic si hexagonal cu cel mai ridicat grad de simetrie). Metalele se caracterizeaza prin luciu specific, conductivitate termica si electrica ridicata, rezistente mecanice superioare, deformabilitate mare pana la rupere etc.
Solidele cristalizate se caracterizeaza prin energia retelei cristaline ce reprezinta energia necesara pentru distantarea constituentilor retelei cristaline la o distanta la care nu mai pot interactiona intre ei si este egala cu energia eliberata la formarea cristalului din particulele constituente in ipoteza ca acestea s-ar gasi in stare de gaz ideal, la temperatura cristalului. De energia retelei cristaline depinde elasticitatea, duritatea, rezistentele mecanice, punctele de topire, dizolvarea substantelor etc. De asemenea, stabilitatea unui cristal este direct proportionala cu energia retelei cristaline.
In natura solidele cristalizate nu se prezinta in forma ideala (retele ideale), caz in care pentru a intra intr-o reactie chimica ar fi necesar un consum foarte mare de energie pentru a strica echilibrul fortelor interioare; cristalii naturali (reali) prezinta diferite defecte si imperfectiuni formand retele reale.
Imperfectiunile si defectele pot sa apara in timpul formarii retelei cristaline sau se datoreaza actiunii unor forte exterioare asupra cristalilor formati.
Defectele de structura aparute in timpul formarii cristalelor sunt datorate (fig.2):
- lipsei unor particule din nodurile retelei , cand intre particule raman legaturi neechilibrate ) fig.a);
- ocuparea unor noduri din retea de catre particule de alta natura, cu alte dimensiuni ce produc deformatii cu atat mai mari cu cat particulele straine au dimensiuni mai mari (fig.b);
- prezenta unor particule de aceeasi natura sau straine intre nodurile retelei, cu deformarea corespunzatoare a retelei (fig.c).
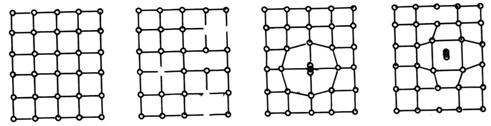
a. b. c.
Fig. Defecte de retea
Solicitarile exterioare produc deformatii ale retelei cristaline - dislocari - ce pot fi de urmatoarele tipuri (fig.4):
- distorsiuni (fig.4.b) provocate de actiuni sub forma de pana;
- translatii (fig.4.c) sub forma de alunecari ale unor pachete, unele peste altele, insotite de deformatii in retea, fiind urmare a unor forte de forfecare;
- maclari (fig.4.d) produse de rotiri partiale ale retelelor fata de un plan de maclare (A-B) sub actiunea unor forte de compresiune.
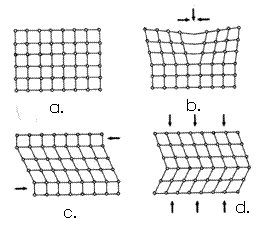
Fig.4. Dislocari in retele cristaline
Cu cat o retea este mai deformata, ca urmarea a defectelor de structura si dislocarilor, cu atat substanta este mai putin stabila la actiunile chimice. La un numar foarte mare de defecte si dislocari, o structura cristalina se comporta ca un solid amorf iar fenomenul poarta denumirea de amorfizare.
Amorfizarea este folosita in practica pentru a mari reactivitatea chimica a unor materiale. Practic, procesul consta in macinarea materialului cu ocazia careia se produc o serie de dislocari. De exemplu, caolinul care in stare naturala prezinta o structura cristalina, nu se dizolva in acid clorhidric concentrat, supus macinarii, se amorfizeaza si devine solubil in acid clorhidric (dupa o mie de ore de macinare se dizolva in proportie de 58% in acid clorhidric diluat, la temperatura camerei).
Macinarea impreuna a unor materiale conduce la avantaje tehnologice cum ar fi reducerea temperaturii si a timpului de reactie.
Solidele cristalizate prezinta anizotropie fizica si mecanica (caracteristicile sunt diferite la variatia directiei de testare). Aceasta caracteristica a permis sa se realizeze studii asupra cristalelor - caracteristici de retea, defecte, dislocari - si sa se realizeze recunoasteri de cristale din structura unor minerale si roci.
Studiul cristalelor cu ajutorul razelor Röntgen sau in lumina monocromatica sau polarizata se bazeaza pe modificarile caracteristicilor razelor monocromatice in reteaua cristalina (reflectii, refractii, duble refractii cu rezultate nule - extensie - sau duble - luminozitate maxima etc.). S-a determinat distanta intre planurile retelelor si intre noduri, ceea ce a permis sa se realizeze primele aprecieri asupra marimii razelor atomice sau ionice, s-au pus in evidenta defectele de structura si dislocarile, incluziunile etc.
Izomorfism, polimorfism, alotropie
Substantele care pot cristaliza impreuna, in acelasi sistem de cristalizare, formand o serie izomorfa, se numesc substante izomorfe.
Doua substante pot forma o serie izomorfa daca au raze ionice sau atomice apropiate si structuri chimice asemanatoare (alcatuite din acelasi numar de atomi sau ioni) si parametri de retea apropiati. In cazul cand razele ionilor difera cu mai putin de 10% se formeaza serii izomorfe complete (clorura si bromura de potasiu, la care ionii de Cl- si B- se inlocuiesc reciproc in proportii nelimitate) iar cand difera razele ionice cu mai mult de 10% se poate forma o serie izomorfa limitata (carbonatii de calciu si magneziu formeaza carbonatul dublu, numit dolomit, la care inlocuirea in retea a ionilor de Ca2+ si Mg2+ se poate realiza intr-o proportie de maximum 8%).
Feldspatii pot forma serii izomorfe deosebite; astfel, feldspatii calco-sodici (plagioclasi) sunt stabili la orice temperatura in timp ce seria izomorfa albit-ortoza este stabila numai la temperaturi joase iar seria izomorfa anortit-ortoza este instabila la orice temperatura.
Substanta compusa care se poate prezenta in mai multe sisteme de cristalizate, in functie de temperatura la care se gaseste, poseda proprietatea de polimorfism.
Cuartul (SiO2)
prezinta caracteristica de
polimorfism cu stari metastabile, importante pentru studiul materialelor
de constructii. Exista trei puncte critice (temperaturi) cand se
produc transformari reversibile ale cuartului. Prima transformare are
loc la
|
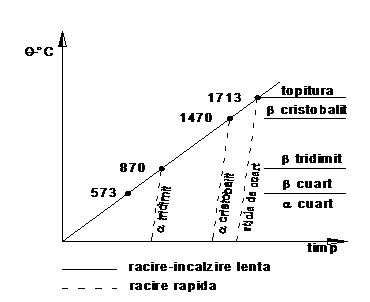
Fig. 5. Transformarile polimorfe ale cuartului
Tridinitul si
cristobalitul sunt stabili in anumite limite de temperatura, dar pot
prezenta stari polimorfe, la raciri rapide, cu caracteristici
diferite (a tridinitul se topeste
la temperatura de
Transformarile polimorfe ale cuartului sunt insotite de modificari de volum ce pot constitui defecte in unele procese de obtinere a materialelor de constructii - la arderea caramizilor se pot produce distrugeri - sau determina comportarea unor materiale la variatii de temperatura - materialele refractare, beton etc.
Substantele formate dintr-un singur fel de atomi (elemente) care se pot prezenta in mai multe sisteme de cristalizare, in functie de temperatura la care se gasesc, poseda proprietatea de alotropie.
Fierul
prezinta proprietatea de alotropie, cu mari implicatii pentru
practica. Astfel, ferita (fier impurificat cu 0,03% C) prezinta
urmatoarele stari alotropice: pana la 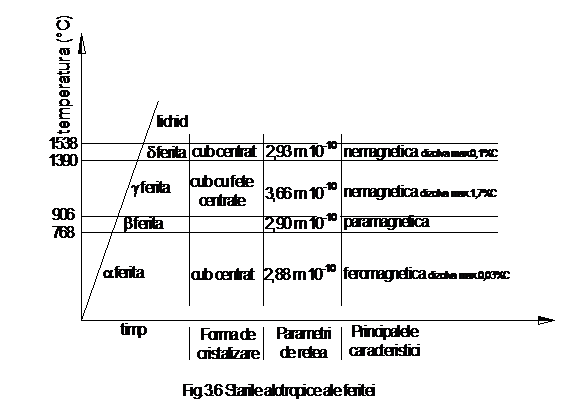
starea lichida.
Diferitele stari alotropice ale feritei confera acesteia caracteristici distincte ca urmare a razelor ionice diferite (2,88 Å la a ferita si 2,93 Å la ferita) si a numarului de coordinatie diferit (8 la a ferita si 12 la γ ferita). Starea a ferita prezinta proprietati magnetice, γ ferita se poate alia cu carbonul, care patrunde prin difuzie in centrele libere ale cuburilor etc.
Materialele formate dintr-un numar foarte mare de cristale reale (dimensiunile cristalelor sunt mici in comparatie cu dimensiunile materialului) prezinta o structura policristalina, la care caracteristicile anizotrope ale cristalelor nu se mai manifesta in masa materialului ce capata caracteristici izotrope (cazul rocilor, metalelor etc.).
1.2. Solide amorfe
Solidele la care nu se observa o aranjare ordonata, in toata masa lor, a particulelor constituente formeaza starea amorfa, care, prin asemanare cu sticlele obisnuite, se mai numeste si stare sticloasa sau stare vitroasa .
Cu toate ca la solidele amorfe particulele nu se aseaza in mod ordonat, studiile röntgenografice au pus in evidenta si aranjari ordonate (aparitia unor zone slabe de interferenta).
Aparitia unor zone cu particule asezate ordonat , este urmare a modului de formare a solidelor din starea lichida intr-un timp mai scurt sau mai lung.
Solidele amorfe sunt mai bogate in energie decat solidele cristalizate si, din acest motiv, sunt mai putin stabile, cu tendinta de cristalizare - devitrefiere. Intrucat deplasarea particulelor de solid, pentru aranjarea ordonata, se realizeaza foarte lent, devitrefierea decurge intr-o perioada de timp foarte mate, de ordinul anilor. Astfel, se explica de ce unele materiale (cum este sticla) transparente devin opace sau se distrug prin pulverizare (cazul rocilor bazaltice) ca urmare a presiunii datorate maririi de volum a microcristalelor formate prin devitrefiere.
Fata de solidele cristalizate, solidele amorfe prezinta izotropie in privinta proprietatilor fizico-mecanice, dar si o fragilitate si duritate marita. Instabilitatea in timp a solidelor amorfe impune realizarea unor teste speciale in scopul caracterizarii si alegerii conditiilor de lucru.
2. Starea lichida
Particulele constituente ale starii lichide pot fi alcatuite din molecule sau, in cazul topiturilor metale sau unele saruri, din ioni.
Energia particulelor dintr-un lichid este suficient de mare ca sa imprime acestora o miscare de oscilatie si translatie si sa aseze particulele la o distanta de echilibru d0, mai mare decat la solide, ceea ce se traduce la nivelul macroscopic prin lipsa formei proprii, a curgerii sub actiunea unor forte (gravitationale, presiune) etc.
Foarte mult timp s-a considerat ca lichidele au o structura dezordonata, dar studiile röntgenometrice au stabilit ca in aceasta stare exista o ordine determinata (care creste odata cu scaderea temperaturii). Asezarea ordonata a particulelor de lichid se pastreaza doar la distante mici, de ordinul a doua, trei straturi de particule si din acest motiv a fost denumita ordine locala, ceea ce inseamna ca daca ne raportam la o particula data, atunci toate particulele vecine sunt dispuse ordonat, dar pe masura ce ne indepartam de aceasta, dispunerea altor particule este din ce in ce mai putin ordonata si astfel ordinea dispare foarte repede.
Starea lichida fiind o stare complexa, nu exista o teorie unitara care sa caracterizeze complet aceasta structura.
Principalele proprietati caracteristice ale lichidelor sunt:
volum determinat si forma nedeterminata;
izotropie;
curgere si incompresibilitate
Proprietatile lichidelor depind de temperatura, apropiindu-se de a gazelor la temperaturi inalte si de a solidelor la temperaturi joase.
2.1. Patura superficiala
O substanta lichida este separata de atmosfera inconjuratoare (in care se gasesc si vaporii sai) printr-o patura superficiala, care determina unele caracteristici ale starii lichide.
Daca se analizeaza rezultanta fortelor de atractie interparticulara a unor particule situate in interiorul masei de lichid si a particulelor de la suprafata lichidului (fig.7) se constata urmatoarele: asupra particulelor
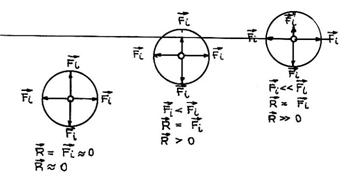
Fig.7. Rezultanta actiunilor interparticulare asupra particulelor de lichid
din interiorul lichidului , rezultanta fortelor de interactiune este apropiata de zero si influenteaza foarte putin miscarea libera a particulelor; asupra particulelor ce se gasesc la limita de separare intre starea lichida si atmosfera inconjuratoare, actioneaza atat fortele de interactiune cu particulele din lichid cat si cele din mediul gazos care, insa, sunt foarte mici, caracteristice acestei stari, deci rezultanta fortelor va actiona spre interiorul lichidului.
Se numeste patura superficiala stratul de particule de la suprafata unui lichid, care este in contact direct cu vaporii sai si se intinde in adancime la o distanta egala cu raza sferei de actiune a particulei.
Existenta paturii superficiale are urmatoarele consecinte:
particulele din patura superficiala actioneaza ca rezultante din interactiune spre interiorul lichidului, exercitand o presiune asupra straturilor de particule interioare - presiunea moleculara;
din cauza fortelor de coeziune, relativ mari, intre particulele lichidului, in comparatie cu fortele de interactiune cu particulele din atmosfera, presiunea moleculara este foarte mare, cea ce explica in principiu incompresibilitatea practica a lichidelor; pentru a realiza o comprimare observabila, un lichid trebuie supus unor presiuni comparabile cu presiunea moleculara sau chiar mai mari, avand in vedere cresterea fortelor de respingere , odata cu reducerea distantei intre particule.
2.2. Vascozitatea lichidelor
In conditii statice (forte constante) in fluide se manifesta numai forte de presiune (sub actiunea carora lichidele pot curge).
In conditii dinamice in fluide, pe langa fortele de presiune, se manifesta si forte de frecare interna sau frecare vascoasa, ca urmare a perturbarii echilibrului fortelor de interactiune intre particule si care se manifesta ca forte tangentiale ce se opun deplasarii unei paturi de lichid pe alta.
Daca intre doua placi plane paralele se gaseste un lichid sub forma unei pelicule subtiri si asupra unei placi se actioneaza cu o forta suficient de mare pentru a pune placa in miscare, se constata urmatoarele:
viteza placii depinde de grosimea peliculei de lichid, fiind cu atat mai mare cu cat grosimea peliculei este mai mica;
pentru suprafete diferite ale placilor, la aceeasi forta vitezele de deplasare se micsoreaza odata cu cresterea suprafetei;
la variatia intensitatii fortei (pentru aceeasi grosime a peliculei si suprafata) vitezele cresc odata cu cresterea fortelor;
viteza de deplasare depinde de natura lichidului (cand ceilalti parametri sunt constanti).
Rezulta ca la lichidele in miscare se nasc forte tangentiale ce se manifesta pe directia miscarii si care depind, ca marime, de variatia vitezei in functie de distanta intre straturile de lichid in miscare - gradientul de viteza (reopanta) si de natura lichidului.
Dupa cum exista proportionalitate intre tensiunea tangentiala si gradientul de viteza, se deosebesc lichide normal-vascoase) (newtoniene) si anormal-vascoase (nenewtoniene).
Pentru lichidele normal-vascoase Newton a stabilit urmatoarea lege:
![]()
![]() (1)
(1)
in care:
![]() = tensiunea tangentiala ce apare la deplasarea de
catre o forta a unei portiuni dintr-un
lichid peste alta portiune;
= tensiunea tangentiala ce apare la deplasarea de
catre o forta a unei portiuni dintr-un
lichid peste alta portiune;
![]() gradientul de viteza (reopanta)
gradientul de viteza (reopanta)
![]() = coeficientul de vascozitate dinamica
sau vascozitate ce depinde de natura lichidului
= coeficientul de vascozitate dinamica
sau vascozitate ce depinde de natura lichidului ![]()
La lichidele normal-vascoase (newtoniene) nu mai este o proportionalitate intre tensiunea tagentiala reopanta si coeficientul de vascozitate dinamica; legatura dintre acestia este de forma:
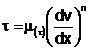 (2)
(2)
in care: ![]() o functie neliniara de
o functie neliniara de ![]()
n = constanta ce depinde de natura lichidului .
Se disting urmatoarele moduri de comportare la scurgere a lichidelor nenewtoniene:
lichide la care gradientul de viteza este o functie neliniara de tensiunea tangentiala dar independenta de timp;
sisteme la care relatia dintre gradientul de viteza si tensiunea tangentiala depinde de timp si alte influente;
sisteme care au atat caracteristicile solidelor cat si ale lichidelor (fluide vascoelastice).
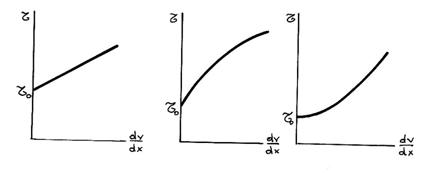
Pentru studiul
materialelor de constructii intereseaza, in special, lichidele din
categoria unu si doi la care dependenta dintre gradientul de
viteza si tensiunea tangentiala poate fi de tipul:
a. b. c.
Fig.8. Dependentia tensiune tagentiala - gradient de viteza la lichidele cu curgere plastica si cvasiplastica
Lichide cu prag de
tensiune (fig.8) plastice si cvasiplastice, care se
caracterizeaza prin aceea ca pentru a curge trebuie sa
depaseasca un prag de tensiune (![]() . Din aceasta categorie fac parte vopselele de ulei,
pastele de argila, betonul proaspat etc.
. Din aceasta categorie fac parte vopselele de ulei,
pastele de argila, betonul proaspat etc.
Lichidele caracterizate prin curba din fig.8.a (curgere plastica), se numesc lichide Bingham; acest mod de curgere presupune ca lichidele au in repaus o anumita rigiditate ca urmare a unei structuri tridimensionale, fiind capabile sa reziste la eforturi unitare mai mici decat pragul de tensiune. Odata distrusa aceasta structura, lichidul curge, comportandu-se ca un lichid newtonian (asa se explica faptul ca vopselele raman in straturi subtiri pe suport).
Lichidele pseudoplastice care curg la orice valoare a tensiunii tangentiale si la care vascozitatea descreste odata cu cresterea gradientului de viteza (fig.8.b). Din aceasta categorie fac parte suspensiile si unele paste de la procesul de fabricare a cimentului.
Lichidele dilatante, ca si cele pseudoplastice curg la orice valoare a tensiunii tangentiale, dar la care vascozitatea creste odata cu cresterea tensiunii tagentiale (fig.8.c). Din aceasta categorie fac parte suspensiile foarte concentrate.
Vascozitatea lichidelor depinde de temperatura si presiune, crescand odata cu scaderea temperaturii si cresterea presiunii, dupa legi exponentiale de forma:
![]()
![]()
in care:
![]() = vascozitatea lichidului la temperatura si presiunea
atmosferica normala
= vascozitatea lichidului la temperatura si presiunea
atmosferica normala
q = temperatura;
p = presiunea
a si b = constante experimentale
Variatia vascozitatii cu temperatura explica de ce, pentru ungerea optima a organelor de masini, se folosesc, dupa anotimp, lubrifianti cu vascozitati diferite.
In practica vascozitatea se poate exprima si sub forma de vascozitate cinematica, definita ca raportul dintre vascozitatea dinamica si densitatea lichidului pentru o temperatura data
![]()
![]()
Pentru unele materiale, cum sunt: vopselele, lacurile, produsele petroliere etc. se foloseste vascozitatea relativa, definita fie ca raportul dintre timpii de scurgere a doua volume de lichid, dintre care unul (in mod obisnuit apa) cu timp de scurgere cunoscut - vascozitatea Engler cu unitatea de masura grade Engler, 0E - sau definita prin timpul de scurgere, in secunde, a unui volum determinat de lichid, printr-un aparat standardizat - vascozitate Saybald.
Marimea inversa a vascozitatii se numeste fluiditate (j m). Unele substante - fluidizanti - au proprietatea de a reduce vascozitatea lichidelor, avand largi aplicatii in tehnica transportului lichidelor prin conducte si in procesele de prelucrare.
Starea gazoasa
In starea gazoasa, particulele se caracterizeaza printr-o mare libertate de miscare, ce conduce la ciocniri elastice intre particule (la temperatura si presiune normala se produc 1010 ciocniri/secunda) urmate de un nou traseu. Urmare a acestei comportari a particulelor, caracteristicile gazelor sunt determinate de temperatura, presiune (ce influenteaza miscarea)si de concentratia particulelor in uniate de volum.
Se numeste stare gazoasa, situatia in care se gaseste materia, caracterizata prin aceea ca nu are volum si forma proprie, ocupand tot spatiul disponibil.
Dintre proprietatile specifice gazelor, ce intereseaza studiul materialelor de constructii, mai importante sunt:
Presiunea gazelor reprezinta masura actiunii particulelor gazului asupra suprafetelor ce delimiteaza spatiul in care se gasesc.
Presiunea este functie directa de numarul de particule aflate in spatiul delimitat -Legea lui Avogadro - si de temperatura la care se gaseste gazul - Legea lui Gay Lussac.
Difuzia gazelor consta in caracteristica acestora de a ocupa tot spatiul ce al au la dispozitie, printre particulele altui gaz, pana la realizarea aceleeasi concentratii in intregul spatiu disponibil, fara interventia unor forte din afara.
Ionizarea gazelor este procesul de formare de ioni (simpli sau complecsi) sub actiunea unor factori exteriori (radiatii ultraviolete, descarcari electrice, radiatii nucleare sau cosmice etc.)
Ionizarea explica modificarea conductivitatii electrice urmate de coroziune etc.
Umiditatea gazelor reprezinta masura in care particulele de apa sau aglomerarile de apa (picaturi) contribuie la formarea volumului de goluri.
De o importanta deosebita pentru studiul materialelor de constructii o constituie umiditatea aerului, ce influenteaza procesele de formare a materialelor de constructii, comportarea in timp a acestora.
Cantitatea de vapori din atmosfera reprezinta umiditatea aerului iar domeniul stiintific ce se ocupa cu cercetarea fenomenelor legate de acest aspect poarta denumirea de higrometrie.
Umiditatea absoluta sau densitatea vaporilor de apa reprezinta cantitatea de apa existenta in unitate de volum.
Pentru nevoile practice se foloseste in mod curent umiditatea relativa.
Umiditatea relativa reprezinta raportul dintre presiunea "p" a vaporilor existenti la un moment dat in aer si presiunea "ps" a vaporilor saturati la aceeasi temperatura cu a aerului.
![]() (3)
(3)
Umiditatea aerului se poate determina experimental cu o serie de instrumente - higrometre - care sunt alcatuite pe diferite principii, cum ar fi: modificarea presiunii aerului in functie de umiditate, modificarile unui volum de aer la variatii de umiditate, modificarea lungimii unui fir (higrometru cu fir de par etc.).
Efectul Joule-Thomson reprezinta proprietatea gazelor de a-si scadea temperatura atunci cand se destind - trec de la presiuni foarte mari, printr-un orificiu ingust, la presiunea atmosferica
Fenomenul poate fi explicat prin consumul de energie necesar ruperii legaturilor interparticulare la gazele existente la presiuni ridicate (100200 atm.); la aceste presiuni particulele sunt foarte apropiate astfel incat apare posibilitatea realizarii de legaturi interparticulare tip van der Waals.
Aceasta proprietate este folosita la obtinerea unor temperaturi joase necesare la unele testari ale materialelor de constructii sau in tehnica frigului.
4. Transformarile starilor de agregare
O substanta se poate prezenta in stari de agregare diferite, in functie de temperatura, presiune, volum specific, ce reprezinta principalii parametri de stare, caracterizand energia interna.
Temperatura este marimea fizica prin care se caracterizeaza starea termica (gradul de incalzire) a unui corp aflat in stare de echilibru termodinamic.
Unitatea de
masura pentru temperatura este in S.I. Kelvinul - K; pentru
practica se mai foloseste si gradul Celsius
Presiunea este parametrul de stare numeric egal cu forta care se realizeaza de catre particulele unui gaz pe suprafata ce delimiteaza volumul ocupat de catre acesta.
Unitatile de masura folosite curent pentru presiune sunt:
pascalul - Pa = N/m2
atmosfera fizica - atm. - = 1,01105 Pa
torrul )un mm coloana de Hg) - torr - = 1,33 . 105 Pa
barul = 105 Pa
Volumul specific este parametrul de stare numeric egal cu raportul intre portiunea din spatiul pe care il are un gaz la dispozitie si masa gazului.
Unitatea de masura a volumului specific este m3/kg.
Le Chatelier (1885)a formulat principiul constrangerii aratand ca prin exercitarea unei constrangeri asupra unui sistem in echilibru, acesta se deplaseaza astfel incat constrangerea sa fie minima.
Prin constrangerea unui sistem se intelege modificarea unuia dintre parametrii ce determina echilibrul, in cazul transformarilor starilor de agregare, temperatura, presiune si volumul specific.
La ridicarea temperaturii unei substante, creste energia cinetica - cresc in amplitudine miscarile particulelor - si echilibrul se deplaseaza spre starea caracterizata prin mai multe posibilitati de miscare a particulelor; starea solida trece in starea lichida, care ofera o mai mare libertate de miscare (vibratie si translatie cu amplitudine mai mare decat la solide) iar lichidele trec in gaz, ce ofera cea mai mare libertate de miscare. La reducerea temperaturii, energia cinetica scade, ceea ce determina transformarile in sens invers, gaz - lichid - solid.
Presiunea, ca parametru de stare, determina concentratia particulelor dintr-o unitate de volum cu influenta asupra libertatii de miscare. Se poate enunta principiul ca, la presiune marita, va fi stabila starea care are un volum specific mai mic si deci o presiune mai mare.
Tranzitia unei substante dintr-o stare de agregare in alta se numeste schimbare de stare de agregare sau schimbare de stare fizica.
4.1. Transformarea reciproca intre starile solida si lichida
Transformarile solid-lichid si lichid-solid se produc ca urmare a modificarii temperaturii; presiunea, ca parametru de stare la aceste transformari, nu se poate manifesta intrucat aceste stari se caracterizeaza prin volum constant. Presiunea determina insa temperatura la care se produc transformarile.
Transformarea solid-lichid se numeste topire iar transformarea lichid-solid se numeste solidificare. Solidificarea substantelor, care, in conditii normale de temperatura se gasesc in stare lichida, se numeste congelare.
Transformarile solid-lichid si lichid-solid nu se produc toate dupa aceleasi legi, ci diferit la solidele cristalizate, solidele amorfe si la vitezele extreme de variatie a temperaturilor (fig.9).
Fig.9. Transformari solid-lichid si lichid-solid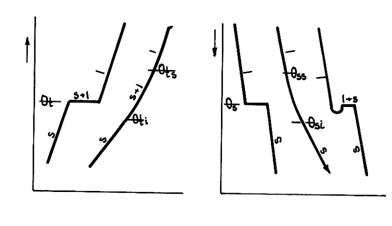
La incalzirea solidelor creste energia cinetica a particulelor ce are ca urmare marirea distantei intre acestea si reducerea posibilitatilor de revenire la pozitia de echilibru a fortelor de atractie intre particule devin mai mici si corpul solid isi reorganizeaza local structura.
La temperatura de topire fortele de atractie sunt atat de mici incat nu mai pot tine particulele in vechile pozitii de echilibru, astfel incat structura se distruge si substanta trece in stare lichida.
a) Topirea si solidificarea solidelor cristalizate
In conditii normale, topirea unei substante cristalizate se produc la o temperatura bine determinata numita temperatura de topire (θt - figura 5 ), care ramane constanta in timpul topirii.
Temperatura de topire depinde de presiunea la care se realizeaza topirea.
Topirea si solidificarea sunt fenomene inverse si se produc la aceeasi temperatura, daca presiunea este aceeasi.
La temperatura de topire (solidificare) starile solida si lichida se gasesc in echilibru.
b) Topirea si solidificarea solidelor amorfe
Solidele amorfe trec din starea solida in stare lichida intr-un interval de temperatura (fig.9), printr-un proces de inmuiere.
Starea amorfa se apropie mai mult de starea lichida, topirea putand fi considerata ca o modificare a vascozitatii - solidul poseda o vascozitate foarte mare care scade odata cu cresterea temperaturii.
Un caz deosebit il prezinta solidificarea cu scaderea rapida a temperaturii cand starea lichida se poate pastra sub temperatura de solidificare (fig.9) ca stare instabila ce se distruge rapid la agitare, in prezenta unui cristal etc. cand temperatura se ridica foarte repede la temperatura de solidificare.
Daca starea subracita nu este distrusa sau viteza de racire este foarte mare (fig.9) vascozitatea lichidului creste foarte repede, particulele isi pierd mobilitatea si se produce solidificarea, cu formarea structurii amorfe (numite din acest motiv si lichide subracite).
Topirea si solidificarea sunt insotite de modificari de volum. In mod obisnuit, topirea este insotita de o marire de volum iar solidificarea se produce cu micsorare de volum, fenomene explicabile ca urmare a distantelor interparticulare diferite la cele doua stari de agregare.
Exista insa si exceptii de la aceasta regula, apa, fonta etc. la care se observa o crestere de volum la solidificare, explicabila in cazul apei prin legaturile de hidrogen ce conduc la aglomerari.
Marirea de volum a
apei la solidificare (inghetare) cu circa 10% (fig.10) constituie un
defect pentru materialele de constructii, care se pot distruge, dar este esentiala pentru existenta vietii in lacuri
si rauri (gheata mai usoara decat apa pluteste pe
aceasta avand si rolul de 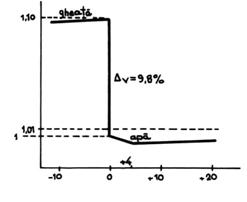
izolator termic
pentru apa din adancime, care nu mai ingheata).
Fig.10. Variatia de volum la inghetarea apei
Experimental, s-a pus in evidenta ca: la substantele care isi maresc volumul la topire , creste temperatura de topire odata cu cresterea presiunii; la substantele care isi micsoreaza volumul la topire, temperatura de topire scade odata cu cresterea presiunii.
4.2. Mecanismul cristalizarii din topituri
S-a aratat ca modul de solidificare depinde de viteza de racire si de natura chimica a topiturii - la o racire rapida solidificarea substantelor se realizeaza in forma amorfa; unele substante se solidifica sub forma amorfa indiferent de modul de racire.
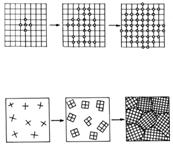
Daca un lichid
se solidifica printr-o racire moderata, fara
fenomene de subracire, in
apropierea temperaturii de solidificare, asociatiile moleculare din lichid
se maresc, devin stabile si formeaza centre de cristalizare sau cristalite
(fig.11), cu reprezentarea in plan a fenomenului.
Fig.11. Cristalizarea din solutii
raspandite in toata masa topiturii. Cand se ajunge la temperatura de solidificare, particulele se dispun in jurul cristalitelor, nu la intamplare, ci in lungul axelor viitorului cristal, realizand formatiuni arborescente denumite dentrite (fig.11). La racirea topiturii de metal, tendinta de cristalizare este atat de pronuntata incat, la suprafata topiturii, dentritele se observa cu ochiul liber. In timp, la temperatura de solidificare, particulele din topitura ocupa locurile dintre ramificatiile dentritelor - umpland ordonat golurile - si astfel cristalul ia forma plina pe toate directiile.
Urmarind procesul de cristalizare in toata masa topiturii, in prima faza cristalitele sunt raspandite in toata masa topiturii si din acestea iau nastere dentritele iar in jurul dentritelor se formeaza cristale izolate care cresc continuu pana in momentul cand se intalnesc. Deoarece intalnirea intre cristale se face la intamplare, cresterea cristalelor se opreste dupa suprafete de contact intamplatoare, asa incat in solidul cristalizat, format din topituri, nu se gasesc cristale de forma regulata - ideala - ci cristale grauntoase, de forma neregulata. Structura fiecarui graunte este insa ordonata, caracteristica starii cristaline. In acest mod se explica caracteristicile izotrope ale structurilor cristaline grauntoase (roci, metale etc.).
Transformarile lichid-gaz si gaz-lichid
Transformarile lichid-gaz si gaz-lichid se produc la variatia tuturor parametrilor de stare (temperatura, presiune si volumul unitatii de masa) care se conditioneaza reciproc.
a) Transformarile lichid-gaz
Procesul de trecere a unei substante din stare lichida in stare gazoasa intr-un volum limitat se numeste vaporizare.
Procesul de trecere a unui lichid in vapori numai prin suprafata libera a lichidului si intr-un volum nelimitat (aer liber) se numeste evaporare.
In anumite conditii de temperatura si presiune se poate ajunge in situatia in care numarul particulelor care se evapora sa fie egal cu numarul particulelor care revin in lichid (se condenseaza). In aceasta situatie vaporii si lichidul se gasesc in echilibru dinamic.
Vaporii care se gasesc in echilibru dinamic cu lichidul din care provin se numesc vapori saturati.
Presiunea pentru care, la o anumita temperatura determinata, se realizeaza echilibrul dinamic se numeste presiunea vaporilor saturati (pvs).
Vaporii care au presiunea mai mica decat presiunea vaporilor se numesc vapori nesaturati.
In cazul vaporizarii se poate ajunge la realizarea vaporilor saturati ceea ce nu este posibil in cazul evaporarii.
Daca un lichid este supus incalzirii, aerul absorbit de catre lichid, sub forma de aglomerari (bule) isi mareste volumul in care se vaporizeaza lichidul, sub forma de vapori saturati. Cand volumul bulelor este suficient de mare, inving vascozitatea lichidului si se ridica la suprafata libera, unde se distrug, realizandu-se astfel procesul de fierbere.
Fierberea este procesul de evaporare care are loc in toata masa lichidului si se desfasoara la o temperatura constanta, numita temperatura de fierbere.
Fierberea incepe numai atunci cand presiunea vaporilor saturati, din interiorul bulelor, devine egala cu presiunea exterioara (de la suprafata libera a lichidului).
Cu cresterea presiunii exterioare, temperatura de fierbere creste.
Daca un lichid este
incalzit intr-un spatiu inchis, presiunea ce se exercita asupra
sa este egala cu suma dintre presiunea aerului si presiunea vaporilor
saturati si deci lichidul nu poate ajunge la fierbere. Pe
masura ce creste temperatura, creste si presiunea
vaporilor saturati, deci si presiunea ce se exercita asupra
lichidului, astfel incat acesta poate fi adus la temperaturi ridicate
fara sa fiarba. Aceasta caracteristica a
vaporizarii la presiuni ridicate este folosita la realizarea autoclavelor, spatii inchise in
care apa poate fi incalzita peste
b) Transformarea gaz-lichid
Trecerea unui lichid din stare gazoasa in stare lichida se numeste condensare, daca starea normala a substantei este lichida si lichefiere daca substanta in stare normala este gaz
Condensarea se poate realiza ca urmare a coborarii temperaturii, contactului cu suprafete reci (la ciocnirea particulelor de gaz cu particulele reci cedeaza energia) - principiul peretelui rece a lui Wald etc.
Printre aplicatiile practice ale transformarilor gaz-lichid sunt si distilarea, lichefierea, obtinerea temperaturilor joase.
Distilarea este vaporizarea partiala a unui lichid urmata de condensarea vaporilor si colectarea lichidului format.
Prin fierbere, lichidul se transforma in vapori, care se condenseaza in contact cu un perete rece. Tinand seama ca temperatura de fierbere depinde de natura lichidului , se poate realiza separarea diferitelor lichide dintr-un amestec-distilare fractionata - sau purificarea unui lichid.
Lichefierea se poate realiza prin coborarea temperaturii, ridicarea presiunii, reducerea volumului gazului, parametri ce se conditioneaza reciproc.
O substanta in stare gazoasa este numita gaz, daca se gaseste la o temperatura mai mare decat temperatura critica si poarta denumirea de vapori, daca se gaseste la o temperatura mai mica decat cea critica.
Lichefierea se poate realiza prin mai multe procedee:
Comprimarea izoterma a gazului, la o temperatura mai mica decat cea critica - procedeul este folosit in cazul gazelor usor lichefiabile (cu temperatura critica ridicata) cum sunt: dioxidul de carbon si amoniacul;
Racirea si comprimarea simultana - pentru racire se foloseste gheata sau un alt gaz lichefiat;
Racirea in trepte (metoda Kamerling Omers) prin care se lichefiaza in trepte gazele permanente cum sunt: oxigenul, azotul, hidrogenul.
5. Obtinerea temperaturilor joase
Temperaturile joase (mai mici de -150C, corespunzatoare temperaturii de inghet a apei naturale) se folosesc la testarea materialelor de constructii la actiunile distructive rezultate din marirea de volum a apei in timpul inghetarii.
Procedeul frecvent folosit pentru reducerea temperaturii, intr-un spatiu inchis si izolat termic, se bazeaza pe vaporizarea unui lichid la o presiune careia ii corespunde o temperatura de saturatie joasa; prin vaporizare se consuma o cantitate de caldura, care se ia din spatiul inchis. Ca agent frigorigen se foloseste amoniacul si freonul (derivat al metanului si etanului).
6. Temperatura punctului de roua
Temperatura punctului de roua este temperatura la care trebuie racit aerul umed, la presiune constanta, pentru ca vaporii de apa sa devina saturati
Fenomenul este foarte important pentru asigurarea confortului in spatiul construit sau protejarea elementelor de constructii de umiditate. In cazul cand temperatura punctului de roua se gaseste in interiorul unui element de constructii sau pe fata interioara a acestuia, vaporii din spatiul construit se vor condensa si aduna in/pe elementele de constructii sub forma de picaturi.
Sublimarea
Vaporizarea corpurilor solide se numeste sublimare.
La unele substante solide, la cresterea temperaturii iau nastere vapori inainte ca solidul sa se lichefieze; in cazul cand presiunea vaporilor saturati egalizeaza presiunea atmosferica la temperatura mediului ambiant are loc transformarea solid-gaz. Iodul, acidul benzoic etc. sunt substante care sublimeaza.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||