
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Utilizarile carbonatilor - proprietati si reactii |
Utilizarile carbonatilor - proprietati si reactii
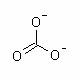
Carbonati sunt saruri disociate a acidului carbonic H2CO3. Aici apartine legatura realizata prin anionul de carbonat CO32-
Sunt de asemenea numiti carbonati, esterul acidului carbonic, cu formula strcturala R-O-C(=O)-O-R, unde R si R' sunt resturi ce contin carbon. Daca apartin R si R' de aceasi molecula se formeaza un inel ciclic pentagonal care ca fi numerotat dupa cum urmeaza:
- oxigen (-O-)
- oxid de carbon (-C(=O)-)
- oxigen (-O-)
- alchil (-C(CH3)H-)
- metilen (-CH2-)
Proprietati
Carbonatii saruri ionice de acea la temperatura camerei se prezinta sub forma solida cristalizata. Anionul de carbonat nu are culoare, din aceasta cauza culoarea este determinata de cationi. Carbonatii nu au miros (sunt inodori). Cu exceptia carbonatilor alcalini se dizolva greu in apa.
Reactii
Raportul
dintre acid carbonic si carbonat: carbonat de calciu + apa + bioxid de carbon --> hidrocarbonat de calciu:
![]()
Aceasta reactie arata formarea apei dure (bogata in carbonati)
Disocierea in apa: carbonat de magneziu -->ion de magneziu +
bioxid de carbon ![]()
Descompunerea la
caldura: carbonat de calciu --> oxid de calciu + bioxid de
carbon ![]()
Aceasta reactie ne arata producerea varului nestins.
Ciclul: silcati-carbonati:
1.Ciclul incepe prin formarea acidului carbonic:
![]()
2.Apa de ploaie care contine acid carbonic erodeaza rocile care contin silicati de calciu astfel va rezulta ioni de calciu si ioni de bicarbonat.
![]()
Acesti ioni rezultati vor fi transportati de apele curgatoare in mari, unde microorganismele (planctonul) folosesc ionii de calciu la construirea cochiliilor, care dupa moartea lor vor alcatui sedimentele de carbonati de pe fundul marilor.
Aceste sedimente vor fi in urmatoarele perioade geologice prin miscari tectonice vor ajunge in interiorul straturile pamantului.
Prin procesele de vulcanism sub actiunea unei presiuni si temperaturi ridicate reactioneaza carbonatul de calciu cu cuartul (metamorfismul carbonatilor). Astfel iau nastere din nou prin eliminarea bioxidului de carbon silicatii.
- Determinarea carbonatilor se face prin: reactia efervescenta a carbonatului de calciu cu acidul clorhidric.
Raspandire si utilizare
Carbonatul de calciu este prezent in calcare, ciment, beton, sau ingrasaminte chimice (amendamente)
Se afla de asemenea carbonat de calciu ca:
- In marmura utilizat in constructii
- In creta folosit in scoli
- In medicina este folosit ca antiacid ii hiperaciditatea gastrica, sau tratarea rahitismului
- In farmacologie ca emulgator la prepararea de pulberi, alifii, drageuri
- In industria alimentara fiind notat E 170 (colorant netoxic)
- In cosmetica ca pulberi sicative
- In tehnica si agricultura, ingrasaminte chimice, ca prisme pentru aparate optice
- In biologie, in natura este folosit de organismele marine pentru alcatuirea cochiliilor
Carbonati mai importanti
- Carbonatul de potasiu
- Carbonatul de sodiu (soda)
- Carbonatul de calciu (calcar, creta)
- Carbonatul de magneziu si calciu (dolomitul)
- Ca si carbonat organic pot fi amintite:
- bimetil carbonatul (C3H6O3)
- polimerele ca policarbonatele,
Carbonat de sodiu
Carbonatul de sodiu (Na2CO3), cunoscut si sub denumirea de soda sau soda de rufe, este sarea de sodiu a acidului carbonic. Forma anhidra are un puternic caracter higroscopic, motiv pentru care, in natura, carbonatul de sodiu se gaseste cel mai frecvent sub forma de hidrati, ca, de exemplu, heptahidratul cristalin (Na2CO3.7 H2O) care, prin fenomenul de eflorescenta, pierde din apa de cristalizare, transformandu-se intr-o pulbere alba, monohidratul (Na2CO3.H2O). Are un gust puternic alcalin. In trecut se obtinea prin extractie din cenusa unor plante cu continut bogat in soda, cum ar fi saricica (Salsola soda). In prezent poate fi produsa sintetic, in cantitati mari, din sarea de bucatarie, prin procedeul Solvay.
|
Utilizare

Soda cristalina fiind higroscopica trebuie inchisa ermetic, este cunoscuta si utilizata din timpul Egiptului antic fiind folosita la prepararea mumiilor, ca si mai tariziu la fabricarea sticlei. Azi este foarte mult utilizat in industrie, de exemplu in anul 1997 au fost produse 39 milioane tone de soda pe glob, din care numai in Germania s-au produs in anul 1999 2,4 milioane de tone. Soda este utilizata in:
- Industria sticlei soda este una din materiile prime folosite la producerea sticlei
- Industria chmica, in albire, industria colorantilor, ca si in tabacirea pieilor
- Industria producerii detergentilor si dezinfectantilor
- Industria metalurgica, pentru indepartarea sulfului din fier
- Industria hartiei, importat la curatire si neutralizarea aciditatii si la albirea hartiei
Carbonat de calciu
Carbonatul
de calciu este o
substanta solida de culoare alba cu formula chimica
CaCO3 este o sare (carbonat) a calciului cu acidul carbonic,
raportul ionilor de Ca2+ si CO32- fiind de 1:1.
Carbonatul de calciu este raspandit in
natura sub forma de minerale: - calcit - aragonit, vaterit
si in organisme in oase, dinti, cochilii, corali si crusta
crustaceilor.
In roci se afla sub forma de calcar unde este aproape in stare pura si varianta dolomitilor care sunt un amestec de calcliu
si magneziu.
Carbonatul de calciu este aproape insolubil in apa, sub actiunea
intemperiilor si ploilor acide se formeaza hidratul de calciu, Ca(HCO3)2 care e usor
solubil in apa solubilitate accelerata de acidul carbonic, si
sulfuric format prin dizolvarea gazelor atmosferice in apa ploilor, dar mai
ales apa pesterilor.
Carbonatul de calciu are o legatura chimica simpla de CaCO3 alcatuind prin aceasta legatura mineralele Calcit si aragonit trei roci calcaroase diferite care cu toate ca din punct de veder chimic sunt identici, difera ca aspect morfologic:
- Creta este o roca microcristalina fina sedimentara,
poroasa care se formeaza prin depunnerea calcitului
(calcarelor), ca si a scheletelor fosilelor vietuitoarelor mici
(Coccolithe) a Coccolithophoridelor si scoicilor foraminiferelor
(Foraminifera).
Creta sub forma de depozite poate fi intalnita frecvent in natura unde este si exploatata ca in Marea Britanie, Franta, Insula Rügen, Germania de nord, sau pe fundul marilor ca creta marina. - Calcarul este la fel o roca biogena dar mai
compacta ca si creta, i-a nastere direct sau indirect din
scheletul vietuitoarelor. Direct poate proveni calcarul din
cochiliile melcilor, scoici, scheletul coralilor sau buretilor de mare. Indirect i-a nastere prin
organisme phototrophe, care asimileaza CO2 si prin alcalinizarea
mediului se formeaza calcarul dizolvat in apa.
Prin calcinare (la temperaturi ridicate) se formeaza piatra de var
folosita in constructii.Cristalele mari
de carbonat sunt intre creta si marmora.
Depozite mari de roci calcaroase sunt in Orgon , Burgberg in (Germania), ca si in Muntii Apuseni din Romania - vezi Lista de pesteri. - Marmora este o roca metamorfica
cu cristale relativ mari care i-a nastere prin transformarea si
recristalizarea cretei sau calcarului sub actiunea unor temperaturi
si presiuni ridicate.
Depozite mari de marmora sunt in America de Nord, Austria, Norvegia si renumita cariera de marmora de Carrara, din Italia de unde provin statuile sculptate de Michelangelo.
Cu toare ca scoarta contine mai mult de 5 % roci calcaroase (carbonat de calciu) numai o mica parte din aceasta cantitate corespunde exploatarii avand calitatilor necesare cautate de geologi ca si parametrii de culoare, puritate, omogenitat.
Carbonat de magneziu
Carbonatul
de magneziu MgCO3 poate fi gasit frecvent in
natura sub forma de magnezit (MgCO3 ˇ H2O) un izotip cu calcitul facand parte
din grupa calcitelor. El are o duritate de 4-4˝ pe
scara Mohs. Impreuna cu dolomitul face dintre principalele minerale cu magneziu. Carbonatul de magneziu care este
neutru din punct de vedere chimic se transforma prin hidratare cu degajare
de caldura in carbonat bazic de magneziu: ![]() Carbonatul de magneziu si carbonatul de
calciu determina duritatea apei, care reduce proprietațile
spumante ale sapunului.
Carbonatul de magneziu si carbonatul de
calciu determina duritatea apei, care reduce proprietațile
spumante ale sapunului.
Utilizare
- Magnesia alba (Nr.CAS 12125-28-9) 4MgCO3ˇMg(OH)2ˇ4-5H2O este suspensie apoasa care poate fi gasita in comerț, are un pH de ca. 10,5.
- Izolator termic, sau la producerea hartiei, cauciucului și materialelor plastice
- Ingredient in industria alimentara, pentru reducerea aciditații
- Producerea medicamentelor care reduc aciditatea gastrica
- Combinat cu talcul in sport la sportivii care fac exerciții la aparate ca inele, paralele etc.
- Producerea materialelor de construcție rezistente la foc
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Lucrari pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








