| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Apoptoza. Implicatii in patologia maligna |
Apoptoza. Implicatii in patologia maligna
Apoptoza. Implicatii in patologia maligna
1.Introducere
Moartea celulara fiziologica este esentiala pentru dezvoltarea si functionarea normala a organismelor multicelulare. Celulele non-necesare, deteriorate si potential nocive trebuie inlaturate din microclimatul celular sanatos pentru asigurarea homeostaziei structurale si functionale a tesutului. Exemple ale mortii celulare fiziologice au fost observate la aproape toate tipurile celulare pe parcursul dezvoltarii si maturarii. Pe parcursul dezvoltarii embrionare modelarea celulara specifica si organogeneza sunt asigurate de un program spatiotemporal definit genetic de proliferare si moarte celulara. In tesuturile adulte, moartea celulara fiziologica apare de asemenea proeminent in interiorul tesuturilor ciclic stimulate sau dependente hormonal, cum sunt endometrul, prostata si glanda mamara, dar si in turnoverul "stady-state" al multor alte tesuturi. Moartea selectiva a celulelor este fundamentala pentru dezvoltarea, reglarea si functionarea sistemului imun, incluzand eliminarea timocitelor auto-reactive, selectia negativa a limfocitelor T si B si distrugerea celulelor realizata de limfocitele T citotoxice. Celulele ce au suferit deteriorari genetice ireparabile sunt de asemenea detectate de procese endogene, probabil limitandu-se astfel diseminarea leziunilor genetice potential nocive. Limfocitele ce invadeaza tesuturi privilegiate din punct de vedere imunologic sunt rapid eliminate, astfel protejandu-se regiunile sensibile de o deteriorare produsa printr-un raspuns inflamator (1). Conceptul unificator al tuturor acestor circumstante diverse este acela ca procesul de moarte celulara este mediat de un set comun de evenimente si se desfasoara pe cai biochimice similare conducand la o dispunere stereotipa a modificarilor structurale. Aceasta moarte celulara este numita apoptoza.
Apoptoza este un proces innascut, conservat din punct de vedere evolutiv, prin care celulele sistematic isi inactiveaza, isi dezasambleza si isi degradeaza propriile componente structurale si functionale pentru desavarsirea propriului lor deces. Acest proces poate fi activat intracelular printr-un program de dezvoltare definit genetic sau extracelular prin intermediul proteinelor endogene, citokinelor si hormonilor ca si de componente xenobiotice, radiatii, stresul oxidativ si hipoxia. Abilitatea unei celule de a intra in apoptoza ca raspuns la un semnal de "moarte" depinde de statusul sau proliferativ, pozitia ciclului celular si de expresia controlata a genelor care promoveaza, inhiba si afecteaza programul de moarte. Reglarea stricta a acestor parametri modulatori ai mortii trebuie mentinuta pentru asigurarea contextului fiziologic propice aparitiei apoptozei. Disfunctiile ce apar in oricare dintre punctele caii de moarte programata, pot duce la un proces apoptotic eronat determinand astfel la exprimarea unor conditii fiziopatologice.
Importanta apoptozei deriva din natura sa activa si din potentialul sau de a controla sistemele biologice.
Moartea celulara a fost considerata la inceput un proces haotic. Totusi, asa cum o celula isi poate echilibra metabolismul, penduland intre anabolic si catabolic, tot astfel un organism multicelular trebuie sa echilibreze ratele de proliferare celulara si de moarte celulara pentru mentinerea homeostaziei. De asemenea, un organism trebuie sa indeparteze celulele senescente, deteriorate sau anormale care ar putea sa interfere cu buna functionare a unui organ sau s-ar putea transforma malign. Ca urmare, alterarile survenite in domeniul reglarii mortii celulare ar putea contribui la patogeneza bolilor degenerative si neoplazice. Desi moartea celulara "fiziologica" se cunoaste de decenii, interesul pentru aceasta problema a fost reactualizat in 1972, cand Kerr, Wyllie si Currie au descris in detaliu modificarile ultrastructurale caracteristice celulelor muribunde si au propus termenul de apoptoza pentru descrierea acestui proces (2). Ei au evidentiat faptul ca moartea celulara fiziologica nu este un proces randomic, ci are trasaturi morfologice distincte. De obicei apoptoza afecteaza celule individuale si, odata initiata, se propaga rapid.
Ingestia celulelor apoptotice de catre macrofage nu induce eliberarea enzimelor proteolitice sau a oxigenului singlet care e toxic. Fragmentarea celulelor are loc fara scurgerea continutului celular in spatiul extracelular, iar indepartarea celulelor apoptotice nu provoaca un raspuns inflamator. Absenta inflamatiei reprezinta o trasatura cruciala permitandu-se astfel moartea celulei fara deteriorarea celulelor adiacente.
Apoptoza versus necroza
Moartea celulara poate fi accidentala sau programata intr-un organism multicelular. Dovezile sprijina ipoteza existentei unui "program de sinucidere" inerent in celulele vertebratelor care este activat atunci cand moartea celulei este dorita pentru binele restului comunitatii celulare.
In tesuturile vertebratelor s-au descris doua modele de moarte celulara cu morfologie distincta: apoptoza si necroza (3, 4), insa mecanismele lor la nivel molecular nu sunt inca complet intelese.
NECROZA poate fi descrisa ca si colapsul metabolic celular si apare cand celula nu-si mai poate mentine homeostazia ionica. Pe masura ce nivelurile de ATP se epuizeaza si gradientul ionic transmembranar se disipa, celulele se umfla si organitele intracelulare se dilata. Initial se observa inmuguriri reversibile ale membranei, modificari timpurii in conformatia si functia mitocondriilor si celula devine rapid incapabila de a mentine homeostazia. Depasind un prag, procesul devinde ireversibil. Membrana celulara poate deveni situsul major al alterarilor pierzandu-si astfel capacitatea de reglare a presiunii osmotice, celula se umfla si crapa. Deteriorarile membranelor interne permit eliberarea enzimelor lizozomale, continutul celulei este imprastiat in spatiul tisular inconjurator si provoaca un raspuns inflamator nespecific.
Necroza este indusa tipic de modificari extreme in mediul inconjurator al celulei, ce determina leziuni severe si bruste, provocate de exemplu de ischemie, hipertermie mentinuta sau traume fizice sau chimice. Se presupune ca necroza nu este influentata genetic (5), (figura 1).
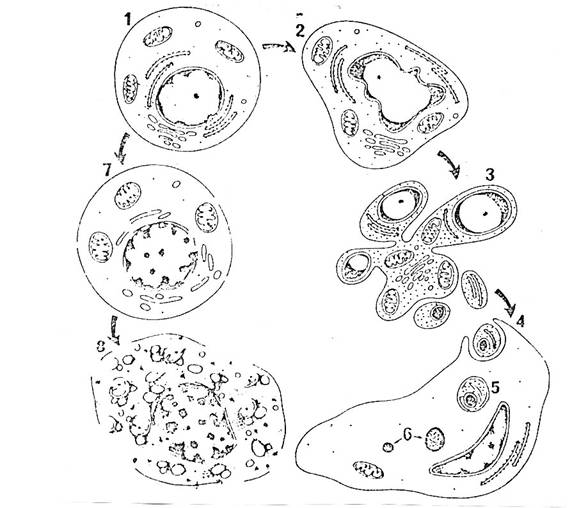
Figura 1. Ilustrarea secventei de modificari ultrastructurale care au loc in apoptoza (2-6) si necroza (7 si 8). (1)Celula normala. Apoptoza timpurie (2) se caracterizeaza prin compactarea si marginalizarea cromatinei, condensarea citoplasmei si plierea membranelor, nucleara si plasmatica (3). In ultima etapa, nucleul se fragmenteaza si protuberantele formate pe suprafata celulei se separa pentru a forma corpii apoptotici, care (4), sunt fagocitati de celulele vecine si (5 si 6) degradate in lizozomi (7). Necroza este asociata cu gruparea neregulata a cromatinei, umflarea organitelor si distrugerea focala a membranelor (8). Apoi membranele se dezintegreaza dar, in general, celula isi mentine intreaga conformatie pana la indepartarea ei de catre fagocitele mononucleare.
APOPTOZA este o forma de moarte celulara in care procesul este mult mai subtil. Este adesea echivalata cu moartea celulara programata, dar este bine sa mentinem cele doua concepte distincte - cel morfologic si cel escatologic. Apoptoza se refera la o serie de modificari morfologice pe parcursul procesului de moarte celulara, modificari diferite de cele observate in necroza, fiind asociata cu procesul normal de reglare a tesuturilor (fig. 1). La vertebrate, moartea celulara este acceptata ca un proces obisnuit si chiar accentuat previzibil, dar "programarea" ei nu se face in sensul acceptat la nevertebrate, ca o moarte a celulelor individuale, care in anumite cazuri poate fi apreciata, cu mare acuratete, ca fiind programata (6, 7). In ultima vreme suntem fortati sa acceptam observatia, aparent paradoxala, ca moartea celulara este atat programata cat si stohastica. De exemplu, pe parcursul dezvoltarii populatiilor de celule B, aproximativ 95 % din celule vor muri dintr-unul dintr-o varietate de motive (rearanjament genic imperfect sau absenta stimularii) dar este imposibil de prevazut dinainte care dintre ele se va produce.
Apoptoza apare in celule individuale dispersate, nu in grupuri de celule invecinate, asa cum se intampla in necroza.
Se pare ca apoptoza prezinta cea mai comuna morfologie atunci cand moartea celulara este determinata fiziologic. Referindu-ne la mamifere, exemplele includ moartea celulelor cu perioada de injumatatire scurta (neutrofile); eliminarea celulelor T autoreactive; involutia celulelor lipsite de factorii de crestere necesari; moartea morfologica a celulelor pe parcursul evolutiei embrionare si postembrionare timpurii; si omorarea celulelor care servesc drept tinte celulelor T, celulelor natural ucigase (NK), sau mecanisme citotoxice mediate celular dependente de anticorpi.
Motivul pentru care celulele trebuie sa moara este diferit de la un tip celular la altul la fel si mecanismul de declansare. Deseori semnalul de sinucidere provine din mediul inconjurator, ca in expunerea la sau retragerea dintr-un mediu cu hormoni sau factori de crestere. Acest aspect este incitant din punct de vedere conceptual, atata vreme cat se traduce prin faptul ca soarta unei celule este dependenta de activitatea alteia; chiar daca moartea este programata, locusul programului este in afara celulei care trebuie sa moara. In alte cazuri, de exemplu turnoverul neutrofilelor, se pare ca celula are un ceas intern autonom care ar controla programul de moarte a celulei (adevaratul program de moarte celulara autonom a fost identificat la nematode si genele ce controleaza acest proces au fost elucidate (8). Caile de activare a apoptozei vor fi diferite in diferite celule, dar mecanismul de moarte in sine va fi mereu acelasi, ceea ce inseamna ca exista o cale finala comuna. Este foarte important ca in studiul apoptozei sa incercam sa facem distinctia dintre procesele care sunt specifice celulei de cele care sunt specifice mortii. Se pare ca exista multe mecanisme declansatoare ale cailor de sinucidere, chiar si intr-un singur tip de celula. Nu toate acestea vor fi recunoscute imediat ca fiind "programate". De exemplu, pentru a activa calea apoptotica, timocitele pot fi semnalizate de catre glucocorticoizi sau de o cross-linkare a receptorului pentru antigen, in acest caz, ambii stimuli fiind considerati fiziologici. Dar, timocitele vor suferi un proces apoptotic identic dupa expunerea la o doza mica de radiatii ionizante sau la o otrava. Deoarece nici unul dintre acesti agenti nu este fiziologic, in acest caz moartea celulelor nu poate fi strict definita ca fiind programata. Totusi definitia poate fi largita in sensul ca in anumite celule, cand sunt deteriorate nespecific, se poate activa fiziologic o "moarte programata". Aceasta presupune ca deteriorarea sa nu fie foarte severa pentru ca programul sa poata fi exprimat: daca timocitele sunt mentinute la 43sC vor muri prin necroza, dar daca se revine, suficient de rapid, la o temperatura de 37sC, vor muri prin apoptoza. S-a sugerat ca, ar fi prea periculos pentru limfocite sa incerce repararea unor astfel de tipuri de leziuni, atata vreme cat o reparare imperfecta ar putea duce la instalarea autoimunitatii sau a leucemiei in astfel de cazuri celulele activandu-si mecanismul apoptotic.
3. Fazele procesului apoptotic
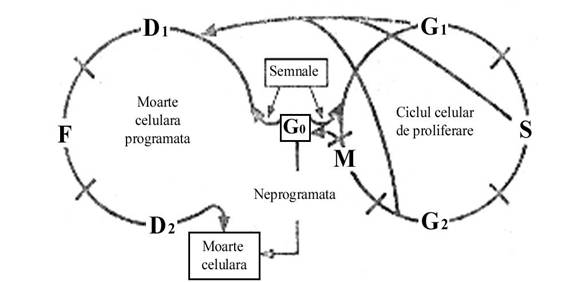
Controlul general al numarului de celule ce se efectueaza prin intermediul ciclului celular este compus dintr-un sistem multicompartimentat in interiorul caruia celula are cel putin 3 optiuni posibile (fig.2).
Celula poate fi:
metabolic activa dar nu desfasoara nici procesul de proliferare si nici cel de apoptoza (celula aflata in faza G0);
in curs de desfasurare a procesului de proliferare (G0→G1→S→G2→mitoza)
pe punctul de a desfasura procesul de moarte celulara fie pe calea programata (G0→D1→F→D2→fragmentare celulara apoptotica), fie pe calea neprogramata (necroza) (figura 2).
|
|
Figura 2. Schema desfasurarii ciclului celular care arata optiunile unei celule aflate in faza G0. D1 defineste perioada pe parcursul careia se activeaza noi gene a caror expresie proteica este ceruta pentru inducerea fragmentarii ADN (faza F). D2 defineste perioada insasi celula se fragmenteaza in corpi apoptotici.
Celulele pot fi induse sa intre pe calea mortii celulare programate din orice faza a ciclului celular de proliferare (G1, S sau G2). Semnalele locale sau sistemice ale factorilor de crestere ce regleaza progresia in interiorul ciclului celular sunt specifice tipului celular si sunt independent determinate ca parte a fenotipului de diferentiere a celulei in cauza. Astfel, acelasi factor de crestere (ex: factorul transformant de crestere - β1) poate avea efecte agoniste sau antagoniste in cadrul ciclului celular al diferitelor tipuri de celule (ex: inductor al proliferarii celulare in celulele mezemhimale sau inductor al arestului in G0 sau progresia prin fazele apoptozei pentru celulele epiteliale).
Procesul apoptotic poate fi impartit in trei etape distincte:
- angajarea, in care celula care a primit un stimul apoptotic letal devine ireversibil angajata pe calea mortii;
- executarea, pe parcursul careia apar majoritatea modificarilor structurale;
- clearance-ul, in cadrul caruia resturile celulare sunt indepartate prin fagocitoza.
Modificarile structurale ce apar pe parcursul fazei executorii au fost descrise pentru prima data de Kerr si colaboratorii (2), iar acum sunt din ce in ce mai bine intelese din punct de vedere al mecanismului.
4. Morfologia apoptozei
Pe parcursul fazei de executie, apar modificari morfologice si biochimice coordonate in interiorul nucleului, citoplasmei, organitelor si membranei plasmatice. Modificarile morfologice care se observa cel mai usor sunt cele care apar in interiorul nucleului. Cromatina condenseaza si formeaza agregate de-a lungul periferiei nucleare relevand un model conformational semilunar. Caracterizarea morfologica a cromatinei demonstreaza o degradare ordonata a ADN-ului de catre o nucleaza endogena dependenta de cation (9), intai in fragmente mari de 30-50 kilobaze (10) pana la fragmente nucleozomale de 180-200 perechi de baze (11). Totusi, clivarea cromatinei la fragmente nucleozomale nu are loc in toate tipurile celulare si poate fi inhibata fara a bloca celelalte modificari ale apoptozei (12,13). Odata cu condensarea cromatinei este alterata ultrastructura nucleara. Lamina nucleara si reteaua de filamente intermediare care mentine integritatea anvelopei nucleare si distributia porilor nucleari sunt clivate proteolitic (14-16). Astfel, distrugerea structurii retelei nucleare ar putea permite alaturarea porilor nucleari (17) si faramitarea nucleului in fragmente ce contin cromatina, care, majoritatea mentin vestigii ale membranei nucleare. Celelalte organite citoplasmatice raman intacte din punct de vedere structural cu toate ca difunctiile mitocondriale sunt asociate cu apoptoza (18) (figura 3).
Modificarile nucleare sunt precedate de reducerea potentialului transmembranar mitocondrial, necuplarea transportului de electroni de la sinteza ATP-ului si cresterea generarii de specii reactive de oxigen. In citoplasma apare cross-linkarea de proteine prin actiunea transglutaminazelor (19), filamentele citoscheletale se agrega in formatiuni paralele si reticulul endoplasmic se dilata si fuzioneaza cu membrana plasmatica creand cratere in forma de sac la nivelul fuziunii. Se poate specula faptul ca celula sufera o alterare profunda a citoscheletului. Cu toate ca, pana in momentul de fata, aceasta problema nu a fost studiata in detaliu, exista exemple in care distrugerea citoscheletului duce la angajarea celulei pe calea apoptotica, in timp ce, stabilizarea citoscheletului inhiba apoptoza. In apoptoza, membrana celulara se umfla si se cuteaza intr-o masura mult mai mare decat in necroza, fenomenul a fost numit zeioza. Integritatea structurala a membranei este ulterior compromisa prin pierderea asimetriei fosfolipidice, a microvililor si a jonctiunilor intercelulare. Celula se sfericizeaza, se indeparteaza de vecinii sai si se contracta dramatic si expulzeaza protuberante care se separa in "corpi apoptotici" inveliti in membrana. In interiorul tesuturilor, celulele apoptotice si corpii apoptotici sunt recunoscuti si fagocitati rapid de catre celulele vecine sau macrofage.
|
|
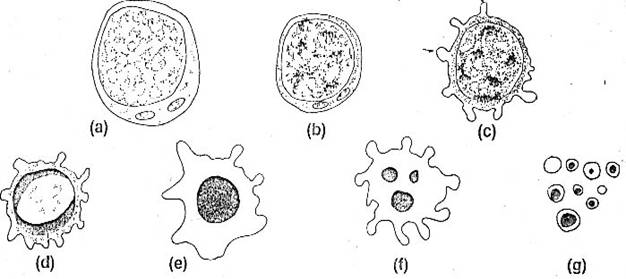
Figura 3. Stadiile apoptozei intr-un limfocit. Aceste stadii sunt observate mai bine in culturi izolate atata vreme cat in vivo ar interveni fagocitoza: (a) Celula normala are o citoplasma dispersata si cromatina nucleara heterogena. Volumul celulei e de aproximativ 90 fL. (b) Celula a pierdut o parte din volum si organitele citoplasmatice sunt strans impachetate, se observa ingramadiri ale cromatinei. In acest stadiu sunt prezente modificarile membranare care duc la fagocitoza. (c) Celula etaleaza zeioza. (d) Colapsul cromatinei cu aranjarea ei in forma de semiluna de-a lungul anvelopei nucleare. Volumul celular este acum de 70 fL. (e) Nucleul are acum aspectul unei gauri negre. (f) Nucleul se fragmenteaza in sfere, iar membrana se cuteaza vormand vezicule. (g) Fragmentele celulare continute in corpii apoptotici care, pentru o vreme, continua sa excluda colorantul vital.
Recunoasterea celulelor apoptotice de catre fagocite poate implica interactii ale lectinelor macrofagelor endogene cu resturi zaharidice N-acetil specifice exprimate pe suprafata celulelor apoptotice, interactiile specific mediate de receptori cu fosfatidilserina din stratul exterior al membranei plasmatice si interactiile trombospondina/receptori de suprafata celulara, ce contin resturi incomplet caracterizate, de pe suprafata celulelor apoptotice (20). Exista evidente ce sugereaza ca mecanismul de recunoastere poate fi diferit in functie de populatia de fagocite. Semnificativ pentru strategia centrala a acestui tip de moarte celulara este clerance-ul rapid si eficient al resturilor apoptotice de catre fagocitele vecine, amatoare sau profesioniste, deoarece previne raspunsul inflamator care, altminteri, ar urma calea distrugerii celulare si deversarea proteinelor intracelulare si a acizilor nucleici in spatiul extracelular.
Odata ce faza de executie a apoptozei este activata, intregul proces demareaza rapid si este complet terminat in cateva ore (21). Durata acestei faze este relativ invariabil in raport cu tipul celular si stimulul apoptotic sugerand ca stadiul final al apoptozei trece printr-o cale comuna. Totusi, stadiul de angajare, timpul de la receptarea stimulului apoptotic pana la initierea fazei ireversibile de executie este extrem de variabil si depinde de tipul celular, de stimulul apoptotic, de situarea in cadrul ciclului celular si de expresia diversilor factori modulatori ai mortii. Multi factori care influenteaza angajarea sau susceptibilitatea celulara la apoptoza sunt implicati direct in receptia si transmiterea semnalului apoptotic. Acesti factori reglatori sunt frecvent selectati pentru a bloca procesul pe parcursul transformarii neoplazice sau dezvoltarii rezistentei la medicamente si sunt subiectul modificarii virale.
Perioada de fragmentare a ADN (figura 2, faza F) poate fi utilizata pentru dividerea in serii temporale a evenimentelor implicate in apoptoza mai mult decat perioada sintezei de ADN (figura 2, faza S) ce este utilizata pentru impartirea ciclului celular proliferativ (22). Pe parcursul fazei D1 apoptotice, celula sufera o reprogramare genetica, proces pe parcursul caruia gene care erau normal exprimate acum sunt supresate si invers (23-26). Aceste modificari epigenetice au ca rezultat fragmentarea dublu catenara a ADN pe parcursul fazei F. Pe parcursul acestei faze F morfologia nucleara se schimba (marginalizarea nucleara a cromatinei urmata de condensarea nucleara si eventual de fragmentarea nucleului insusi), cu toate ca membranele plasmatica si lizozomala sunt inca intacte si mitocondria inca functionala. Pe parcursul urmatoarei faze, portiunea D2, apare inmugurirea membranei si eventual fragmentarea celulara in clustere de corpi apoptotici inveliti in membrana.
5. Biochimia apoptozei
Celulele care sufera apoptoza, se contracta considerabil, iar electrono-micrografiile evidentiaza o citoplasma extrem de condensata cu organite ce par a fi normale. Cea mai plauzibila explicatie ar fi aceea ca celula a pierdut apa si, cum nu se evidentiaza o umflare imediata, probabil a pierdut ioni izoosmotic. De asemenea, nu au fost descrise leziuni specifice ale organitelor citoplasmatice, sau ele nu au fost cautate intr-un mod adecvat. A fost observata umflarea cisternelor reticului endoplasmic.
Biochimic, in celula are loc reducerea sintezei de ARN si proteine urmata de degradarea lor, dar sincronizarea acestor evenimente in raport cu modificarile morfologice nu este inca bine caracterizata. Totusi, initial s-a crezut ca tranzitia de la normal la contractarea apoptotica se realizeaza atat de rapid incat nu poate fi observata o stare intermediara, citometria in flux poate ajuta la caracterizarea modificarii si in combinatie cu sortarea celulara poate inlesni o patrundere mai profunda in ordinea evenimentelor.
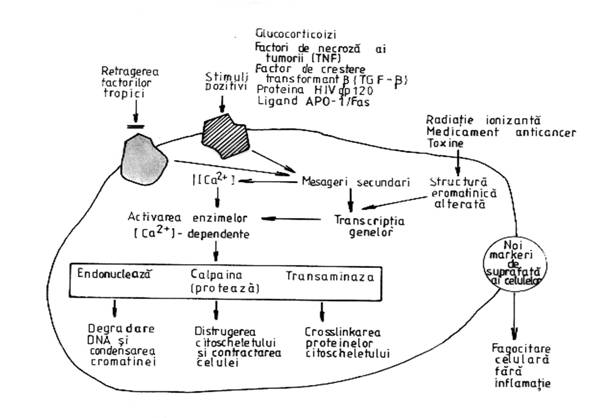
Desi apoptoza este un proces opus necrozei, reprezentand calea fiziologica de moarte celulara, poate fi de asemenea provocata de stimuli patologici. In general, orice stimul ce produce necroza prin distrugere celulara directa poate induce apoptoza, in cazul in care celula initial supravietuieste. In acest sens, apoptoza reprezinta un raspuns celular coordonat la stimuli vatamatori care nu sunt imediat letali. Nu se poate vorbi de o serie invariabila de evenimente metabolice ce au loc in cursul apoptozei. Totusi, timpuriu, in apoptoza, in multe tipuri celulare apare o crestere sustinuta a nivelului de calciu ionizat citosolic. Calciul, poate activa latent enzime care contribuie la modificarile structurale din cursul apoptozei. Aceste enzime includ o endonucleaza nucleara calciu dependenta care cliveaza invariabil ADN si o transglutaminaza care crosslinkeaza proteine citosolice. Proteazele calciu dependente (calpaina) degradeaza citoscheletul (figura 4) (27-29).
In general, procesul apoptotic are nevoie de energie sub forma de ATP, reclama sinteza activa a ARN si proteina depinde de tipul celular si stimulul apoptotic. In limfocitele mature, agentii care inhiba ARN-ul sau sinteza proteica in general duc la blocarea apoptozei; din contra, in neutrofilele imature si in unele linii celulare leucemice, aceeasi compusi amplifica apoptoza. Una din explicatiile acestei contradictii este ca majoritatea celulelor contin proteine reglatoare care pot inhiba sau promova moartea celulara fiziologica. Intr-un tip particular celular, comparand ratele catabolice ale inhibitorilor si promotorilor se poate determina daca sistarea sintezei de ARN si proteice previne sau induce apoptoza.
|
|
Figura 4. Evenimente metabolice ce au loc in apoptoza.
In celulele destinate sa sufere apoptoza creste mRNA pentru β-tubulina inainte de aparitia modificarilor morfologice si a clivajului DNA. Intr-o etapa ulterioara, apar si in citoplasma cantitati crescute de β -tubulina. Probabil ca, genele pentru β-tubulina sunt degradate impreuna cu restul DNA-ului nuclear indata ce endonucleaza devine activa (30). Agentii care interfera cu polimerizarea actinei, cum ar fi citocalasina B, s-a aratat ca previn inmugurirea celulara ce duce la formarea corpilor apoptotici fara a bloca fragmentarea nucleului sau clivajul DNA (31).
Activitatea endonucleazica, structura cromatinei si degradarea ADN in apoptoza
|
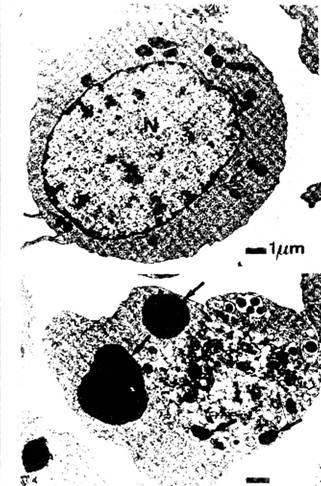
Nucleul este locul producerii majoritatii modificarilor dramatice ce au loc in apoptoza. Modificarile sunt studiate mai bine cu ajutorul microscopiei electronice de transmisie (figura 5), dar au fost deja vizualizate in celule vii in urma utilizarii colorantilor fluorescenti cum sunt acridin oranjul sau Hoechst 33342. Modelul modificarilor difera de la un tip celular la altul dar, in general, nucleul se contracta si cromatina devine foarte densa, se fragmenteaza si, in final se leaga strans de anvelopa nucleara.
Aceasta modificare este adesea acompaniata de fragmentarea ADN in subunitati regulate ce formeaza o "scara" ca rezultat al ruperii dublu catenare, aparent randomice la nivelul regiunilor linker dintre miezurile nucleozomale. In fiecare celula exista peste un milion de astfel de rupturi ceea ce releva o situatie imposibil de reparat si ca urmare are loc sistarea transcriptiei (32).
In ultimii ani a existat o controversa cu privire la dimensiunile fragmentelor de ADN, produse pe parcursul apoptozei, responsabile de angajamentul ireversibil pe calea mortii celulare.
|
|
Figura 5. Modificarile structurale ale celulei pe parcursul apoptozei. Imaginea superioara reprezinta o celula normala. Imaginea inferioara reprezinta o celula in cursul procesului de apoptoza; sagetile indica fragmente de cromatina condensata.
Exista o serie de rapoarte ce precizeaza ca atunci cand celula intra in apoptoza ADN-ul genomic este degradat in fragmente mici nucleozomale (repetari de cate 200 pb). Totusi au existat rapoarte ce sustineau ca celulele pot intra in apoptoza pe criterii morfologice fara producerea "scarii" de ADN nucleozomal (33-36, 37).
O serie de investigatii au sugerat ca proteinele responsabile de fragmentarea letala a ADN in apoptoza sunt endonucleaze de tip DNaza I care, pentru activare, depind de calciu (Ca2+) (11, 38). De asemenea, intr-o serie de tipuri celulare, in care a fost indusa apoptoza sub diferite forme, s-a demonstrat elevarea sustinuta a nivelului de ioni liberi de calciu intracelular (Cai) (39-43) care s-a sugerat ca ar fi necesari pentru activarea endonucleazelor de aproximativ 23 kD (44, 45). Celulele raspund la o crestere a Cai prin pomparea calciului in interiorul unei organite intracelulare sau in afara celulei prin membrana citoplasmatica. Astfel de transport de Ca2+ este catalizat de schimbul membranar de Na2+ - Ca2+ si de proteinele ATP-aze Ca2+. Deoarece ATP-aze Ca2+cere un proton pentru transportul vectorial al Ca2+ in afara celulei un astfel de transport ar putea acidifia celula daca nu ar fi imediat tamponat sau transportat in afara celulei (46).
In modelul propus de Filipski in 1990 (figura 6) este privit ca fiind ordonat in bucle de cromatina bine stabilizate de cate 50 Kb, aceste bucle sunt infasurate in structuri hexamerice numite rozete si continand aproximativ 300 Kb de ADN. Rozetele formeaza subunitatea de baza a cromatidei rasucite.
Au fost studiate activitatile endonucleolitice asociate cu fragmentarea ADN cu masa moleculara mare cu ajutorul tehnicii PFGE (pulsed field gradient gel electrophoresis). S-a observat, in toate tipurile de celule studiate, o activitate dependenta de Mg2+ capabila de producerea fragmentelor de la 50 Kb la 300 Kb, iar ionii de Ca au fost necesari pentru fragmentarea ulterioara la oligonucleozomi (47-49). Aceaste experimente au sugerat ca ar putea fi necesare doua enzime separate pentru fragmentarea completa a ADN pe parcursul apoptozei. Totusi, utilizand chelatori ai Ca2+ intracelular (50) s-a observat ca pentru degradarea ADN de masa moleculara mare sunt de asemenea necesare cantitati nanomolare de calciu, complicand astfel explicatia fenomenului de clivare. De asemenea s-a observat ca fragmentarea internucleozomala de ADN poate fi blocata de catre zinc, cunoscut inhibitor al endonucleazelor Ca2+ si Mg2+ dependente (51, 52).
In continuare s-a demonstrat faptul ca fragmentarea internucleozomala a ADN in apoptoza nu este randomica (53). Fragmentarea apare preferential in elementele repetate ale ADN care au un rol in organizarea structurala a cromatinei.
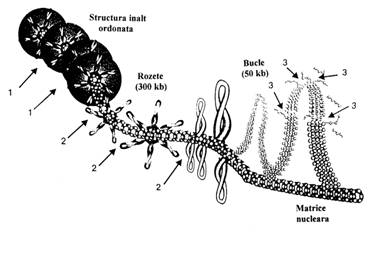
Figura 6. Modelul Filipski et al. (1990) ce prezinta structura cromatinei. Sagetile corespund situsurilor de clivare ale cromatinei.
De asemenea, se pare ca nucleozomii sunt eliberati de preferinta din regiunea domeniilor "rozeta" si/sau "bucla" ce contin elemente repetitive ale ADN pe parcursul fazei secundare de degradare. S-a aratat ca sensibilitatea generala a cromatinei la nucleaze nu este alterata pe parcursul apoptozei (54). Aceasta indica faptul ca in conditiile unui nivel ridicat de Ca2+ fragmentarea de ADN are loc in interiorul "buclelor" de ADN la un numar strict de loci si nu e dependent de gradul de pliere al fibrei de 30-nm care determina accesibilitatea generala a regiunilor linker (55). Luand in considerare toate aceste date se poate spune ca fragmentarea endogena a ADN pe parcursul apoptozei se produce in 3 etape (fig. 6). Prima etapa incepe cu activarea unei endonucleaze legata constitutiv de o clasa de SAR (regiuni de atasare a matricei si citoscheletului) bogate in legaturi A-T, care ataseaza domenii mari ale cromozomului la matricea nucleara. Concentratia nucleara endogena de Mg2+ este suficienta pentru activitatea ei. Nu este nici o cerinta de Ca2+ atat timp cat ADN este monocatenar. S-au evidentiat astfel o serie de fragmente monocatenare de ADN pe parcursul procesului de apoptoza. A doua etapa implica propagarea acestei degradari la alte clase de SAR. Aceasta propagare are o dependenta de Ca2+ sugerand ca situsurile si-au imbogatit compozitia in C-G si toata cromatina este redusa la fragmente de ~ 300 kb. In etapa a treia se cliveaza ADN internucleozomal la regiunile linker din interiorul "buclelor" si genereaza "scara" ADN. Aceasta clivare este relativ independenta de secventa (in termeni legati de situsurile ce leaga nucleaza) dar necesita Ca2+ pentru cinetica. De asemenea, aceasta etapa necesita proteoliza (56). Factorii aditionali implicati in aceasta etapa ar putea realiza extensia finala a fragmentarii ADN ce difera mult de la un tip celular la altul. Toate aceste etape de degradare sunt catalizate de o enzima sau doua pool-uri de enzime cu proprietati DNaza-I like.
ADN-ul mitocondrial nu sufera fragmentare (57). Se presupune ca aceasta clivare a ADN-ului nuclear, intr-o etapa timpurie a procesului, poate avea un rol protector prin evitarea transferului de material genetic potential activ celulelor vecine dupa fagocitarea corpilor apoptotici (58). Exista si tipuri celulare in care apoptoza tipica, care include modificarile nucleare, este observata microscopic ca fiind lipsita de clivajul nucleozomilor ADN. Totusi, in putinele sisteme in care a fost studiata, au fost observate anumite forme de deteriorare a ADN (ruptura monocatenara extinsa, rare fragmentari dublu-catenare), necesare modificarilor morfologice profunde. Nu exista un consens privind rolul pe care il joaca fragmentarea ADN ce are loc inaintea mortii celulare. Desi transcriptia este oprita, ea insasi nu este atat de rapid letala precum este apoptoza, ceea ce inseamna ca sunt implicate si alte procese. S-a constatat faptul ca acidul aurin tricarboxilic, care inhiba nucleaza, este un ihibitor al tuturor aspectelor legate de apoptoza; dar este incorect sa concluzionam ca, prin urmare, distrugera ADN este pasul critic in procesul apoptozei, atata vreme cat aurinul inhiba multe alte reactii metabolice celulare.
Modificarile membranei plasmatice
Fagocitarea rapida a corpilor apoptotici de catre celulele adiacente, cat timp membranele lor celulare sunt intacte (pentru prevenirea inflamatiei si lezarii tesuturilor in care se formeaza, in special cand procesul apare in conditii fiziologice) implica operarea unui mecanism de recunoastere foarte specific si exista dovezi care sustin existenta mai multor astfel de mecanisme (59).
In mod normal, fosfolipidele membranei plasmatice sunt distribuite asimetric. Lipidele ce contin colina, cum ar fi fosfatidilcolina (FC) si sfingomielina sunt concentrate pe fata externa a membranei plasmatice in timp ce aminofosfolipidele cum sunt fosfatidiletanolamina (FEA) si fosfatidilserina (FS) abunda pe fata interna a membranei plasmatice. Dintre toate fosfatidilserina (FS) este restrictata in majoritatea celulelor exclusiv la fata interna a membranei (60). Pierderea asimetriei fosfolipidice si expunerea FS a fost prima oara demonstrata pentru limfocite (61) dar aceasta descoperire a fost confirmata intr-o serie de tipuri celulare (62).
Externalizarea FS este rapida sugerand mai degraba un transport facilitat decat o difuzie pasiva a lipidelor prin bistrat. Aceasta activitate se presupune ca este mediata de o proteina enzimatica activata de calciu, ATP independenta si nespecifica din punct de vedere al fosfolipidelor transportate (63).
Din punct de vedere biologic, expunerea FS la suprafata e considerata a fi un ligand pentru inlaturarea rapida a celulelor ce-l exprima. O alta consecinta biologica este legata de faptul ca FS serveste drept cofactor pentru cascada de coagulare (64) domeniu in care datele incep sa se contureze sugerand ca FS poate avea o serie de efecte anti-inflamatoare sau imunosupresive.
6. Recunoasterea si inlaturarea celulelor apoptotice
Evenimentul final, comun pentru majoritatea celulelor apoptotice este reprezentat de recunoasterea si indepartarea lor de catre fagocite. Celulele apoptotice sunt indepartate inaintea lizei lor, acest eveniment sugerand ca ele exprima modificari specifice pe suprafata ce semnalizeaza fagocitelor legarea si inglobarea lor. Aceste fagocite pot fi profesioniste (macrofagele) sau amatoare (fibroblaste, celule epiteliale si celule musculare netede din peretii vaselor de sange). Pana acum au fost descrisi mai multi receptori pe macrofage si alte celule ce leaga celulele apoptotice si mediaza inglobarea lor. Acestia sunt reprezentati de receptori lectin-like (65), receptorul pentru vitronectine αvβ3 (66), CD36, receptorul de recunoastere al fosfatidilserinei (67), inca necaracterizat, CD14 (68) si receptori scavanger (69). De curand, s-a demonstrat ca transportorul ABC1, de asemenea implicat in inglobarea celulelor mamaliene apoptotice, mediaza transportul anionic fiind omolog genei ced-7 asociata cu fagocitoza corpilor apoptotici in C. elegans. Mecanismul prin care acesti receptori mediaza fagocitoza celulelor apoptotice nu este cunoscut, iar liganzii acestor receptori nu sunt inca bine caracterizati. Cu toate acestea comun multor celule ramane expunerea fosfatidilserinei pe fata externa a membranei plasmatice, acest fosfolipid parand a fi recunoscut intr-o maniera stereospecifica de catre subseturi de macrofage, de catre celule melanoma, de celule musculare netede din peretii vaselor de sange si de celule Sertoli. In mod normal, fosfolipidele de membrana sunt distribuite asimetric.
Macrofagele sunt "fagocite profesioniste" ce indeparteaza celulele si corpii apoptotici, dar la acest proces pot participa si alte tipuri celulare, ca de exemplu celule epiteliale si tumorale ce pot ingloba celule apoptotice vecine. In timpul inglobarii celulelor apoptotice, macrofagele nu elibereaza agenti de tipul eicosanoizilor si citokinelor (70). Lipsa acestui raspuns pare a fi determinata de mecanismul prin care celulele apoptotice sunt ingerate, dat fiind ca celulele apoptotice, opsonizate pentru a putea fi preluate de receptorii Fc ai macrofagelor, induc, de exemplu, eliberarea de tromboxan. Totusi, daca celulele apoptotice nu sunt preluate de catre macrofage, ele se umfla si se dezintegreaza eliberandu-si continutul. Daca ar avea loc un astfel de eveniment pe parcursul clearance-ului neutrofilelor din situsurile inflamate, eliberarea continutului granulelor citoplasmatice ar avea consecinte nefaste. Mai mult decat atat, evadarea nedorita a materialului nuclear din leucocitele moarte, poate fi de asemenea periculoasa, nucleozomii eliberati din limfocitele apoptotice neingerate pot stimula sinteza de ADN si imunoglobuline in limfocitele viabile (71). Prin urmare, este posibil ca dezintegrarea limfocitelor apoptotice (presupus neingerate) sa constituie o sursa de ADN nucleozomal circulant, observat de altfel la anumiti pacientii cu lupus sistemic eritematos, contribuind la stimularea policlonala a celulelor B tipica pentru aceasta afectiune autoimuna si tintind autoanticorpi catre paturile vasculare, cum ar fi glomerulii renali, in care componentele nucleozomale circulante s-ar putea lega (72).
Exista mai multe mecanisme posibile de recunoastere a celulelor apoptotice de catre fagocite si de asemenea, mai multe statusuri tinta etalate de celulele apoptotice.
Lectinele fagocitelor
Un mecanism obisnuit de interactie intercelulara il reprezinta legarea carbohidratilor de la suprafata celulara a unei celule de lectinele altei celule, mecanism ce poate fi inhibat specific de catre zaharuri simple recunoscute de lectine.
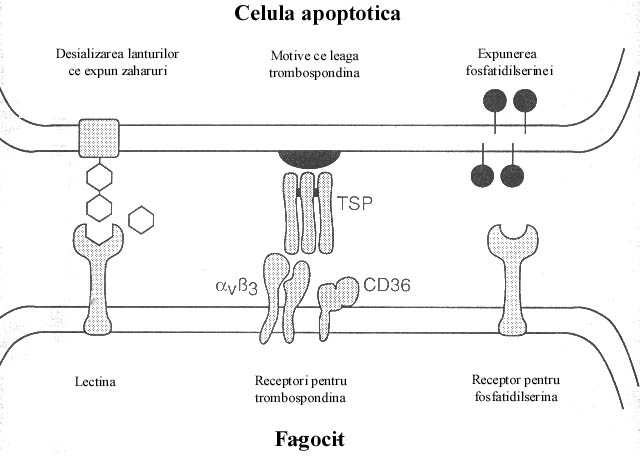
Unele din consecintele apoptozei sunt reprezentate de modificarile specifice ale carbohidratilor de pe suprafata membranei celulare. Se presupune ca pierderea, printr-un mecanism inca necunoscut, a unui reziduu terminal de acid sialic din lanturile laterale glicoproteice ar putea sa expuna N-acetilglucozamina, N-acetilgalactozamina si galactoza, mascate in conditii normale, restituind aceste reziduuri accesibilitatii interactiunii cu presupusele lectine macrofagice (73) (figura 7).
|
|
Figura 7. Trei mecanisme prin intermediul carora fagocitele ar putea recunoaste celulele ce intra in apoptoza.
Receptori trombospondinici ai fagocitelor
Macrofagele umane derivate din monocite (HMDM) pot recunoaste neutrofile si limfocite umane apoptotice prin intermediul receptorilor pentru vitronectina (VnR) αvβ3 si receptorii scavenger din clasa B (CD36) (74). Acesti receptori se leaga de trombospondina ce serveste drept punte intre macrofage si celulele apoptotice. Se pare ca aceasta recunoastere este independenta de expunerea fosfatidilserinei le suprafata membranei celulei apoptotice si pare a fi legata de fenotipul macrofagului si nu de tipul celulei apoptotice.
Receptorii pentru fosfatidilserina
Este clar ca macrofagele pot recunoaste fosfatidilserina intr-o maniera dependenta de doza si de stereospecificitate, fapt ce sugereaza existenta receptorului pentru FS. Au fost descrisi o serie de receptori cu rol in medierea recunoasterii FS si anume CD68, CD14, anexinele, receptorii scavenger, beta2 glicoproteina I si gas-6. Exista si date care sugereaza recunosterea FS de pe celulele apoptotice de catre fagocite "amatoare". Nu se stie totusi daca acesti receptori sunt specifici pentru FS. Cel mai probabil este ca mai multi receptori pot lega FS, dar ramane inca sub semnul intrebarii daca ei pot recunoaste FS pe suprafata celulara.
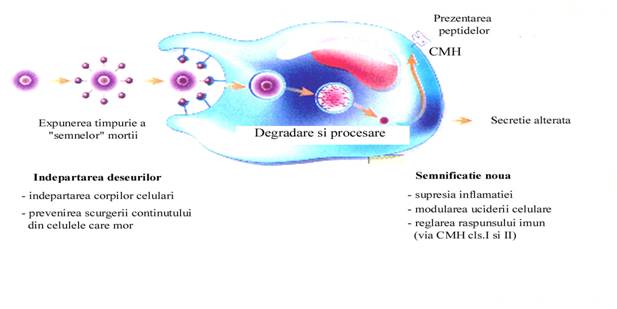
Foarte multi ani semnificatia fagocitarii celulelor intacte "nedorite" a fost subestimata. Pana nu demult, inglobarea celulelor apototice a fost considerata ca o inlaturare protectiva a celulelor nedorite (75). Recent clearance-ului celulelor apoptotice i-a fost atribuit o noua semnificatie. In functie de context, inlaturarea celulelor apoptotice de catre fagocite poate supresa inflamatia, poate modula deletia directionata a celulelor gazda sau a parazitilor invadanti de catre macrofage si poate regla raspunsul imun (figura 8).
|
|
Figura 8. Clearance-ul fagocitic al celulelor apoptotice.
7. Genetica apoptozei
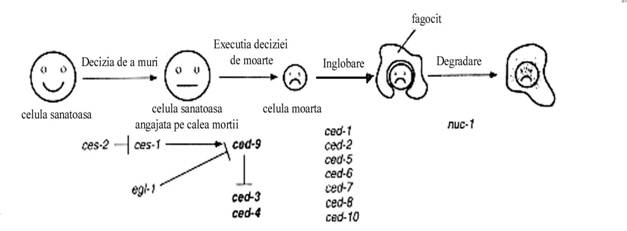
In pofida numeroaselor progrese ce s-au realizat in cercetarea stiintifica este foarte dificila identificarea moleculelor responsabile de apoptoza cu ajutorul demersurilor biochimice si moleculare in sistemele mamaliene. Din fericire, nematodul Caenorhabditis elegans reprezinta un model particular de studiu al reglarii genetice a apoptozei extrem de util (76). Pe parcursul dezvoltarii embrionare si larvare a nematodului sunt eliminate 131 din 1090 celule in cadrul unui program foarte bine caracterizat, invariant din punct de vedere spatio-temporal. Astfel, s-a identificat un numar mare de mutatii ce afecteaza stadii specifice ale procesului apoptotic si genele corespunzatoare care au fost ordonate intr-o schema genetica (figura 9). Aceste gene sunt implicate in decizia de a intra pe calea mortii, in executia acestei cai, in inglobarea celulelor muribunde si in degradarea resturilor celulare din cadrul inglobarii. Doua dintre aceste gene, ced-3 si ced-4 sunt necesare pentru toate formele de apoptoza din cadrul dezvoltarii si se considera a codifica efectorii finali ai cai apoptotice. O alta gena reglatoare cheie, ced-9, este necesara pentru supresia apoptozei in celulele programate sa supravietuiasca (77). Aceasta gene codifica o proteina omologa cu familia Bcl-2 din sistemul uman. Mai mult decat atat, expresia lui Bcl-2 poate inhiba apoptoza in nematode si poate chiar substitui partial pierderea functiei lui Ced-9, ceea ce indica faptul ca cel putin cateva componente ale caii apoptotice sunt conservate in evolutie. Mutatiile survenite in 6 gene afecteaza inglobarea corpilor apoptotici de catre celulele vecine non-profesionale. Proteinele intracelulare Ced-2, Ced-5 si Ced-10 semnalizeaza intr-o maniera comparabila cu omologii lor mamalieni Crkll, DOCK 180 si Rac mediind reorganizarea si extensia citoscheletului celulei inglobatoare. Ced-7, omoloaga cu ABC-1 activeaza atat in celula muribunda cat si in cea inglobatoare, posibil in transportul transmembranar de lipide. Ced-1 este analog receptorilor scavenger din sistemul mamalian; Ced-7 si Ced-1 promoveaza, probabil, inglobarea interactionand cu proteina adaptoare de semnalizare Ced-6 (78).
|
|
Figura 9. Schema genetica a apoptozei in C. elegans. Au fost izolate mutatiile din 14 gene diferite ce afecteaza apoptoza in diferitele ei etape. Mutatiile ce influenteaza decizia de a murii afecteaza doar un numar mic de gene. Genele implicate in etapele ulterioare sunt comune tuturor celulelor somatice din organism angajate pe calea mortii. Activitatea lui ced-3 si ced-4 promoveaza moartea celulara, iar ced-9 previne acest proces.
8. Semnificatia apoptozei in cancer si in terapia cancerului
Implicatiile apoptozei in patologie
Dereglarea procesului apoptotic, ce are ca rezultat o moarte celulara excesiva, insuficienta sau prematura, constituie fundamentul initierii si progresiei multor maladii umane. Se presupune ca o exacerbare a apoptozei celulelor neuronale ar putea contribui la progresia si severitatea mai multor dereglari neurodegenerative ce includ maladia Alzheimer, scleroza laterala amiotrofica, atrofia musculara spinala, maladia Parkinson, maladiile neuromotorii si chiar atacul cerebral. Apoptoza excesiva la nivelul celulelor T circulante este corelata cu sindromul imunodeficientei severe si SIDA, in vreme ce manifestarea insuficienta a acestui proces constituie mecanismul de declansare al anumitor boli autoimune si limfoproliferative. Inhibarea procesului apoptotic prin pierderea mutatiilor functionale in genele activatoare ale mortii sau castigarea unor mutatii functionale in genele supresoare de moarte este incriminata in transformarea neoplazica. Virusurile si-au dezvoltat mecanisme care manipuleaza calea apoptotica pentru a-si asigura perpetuarea propriei supravietuiri, inhiband apoptoza celulelor infectate pentru a permite replicarea virala si activand apoptoza mecanismelor celulare de aparare ale gazdei. Tinand cont de aceste realitati, manipularea cailor apoptotice prin interventie farmacologica sau genetica promite noi oportunitati terapeutice pentru o serie de maladii.
Circumstantele aparitiei apoptozei se impart in doua mari categori. Apoptoza apare in tesuturile normale, unde raspunde de deletia celulelor si este de asemenea observata in contexte patologice specifice. Cel putin intr-o parte din situatiile din categoria a doua, poate fi sustinut teoretic faptul ca vine in sprijinul unei semnificatii biologice. Supravietuirea celulelor in curs de distrugere ar putea fi nociva gazdei. In contrast, necroza este totdeauna patologica fiind consecinta lezarii majore a celulei si nu ii poate fi atribuita nici o functie homeostatica (9).
Celulele raspund la leziune, daca pot, prin apoptoza. Daca un medicament induce apoptoza intr-un limfocit, de obicei ne furnizeaza mai multe date despre celula decat despre medicament, deci astfel de experimente trebuie interpretate cu precautie. Implicatiile acestui proces in terapie sunt evidente: un medicament care inhiba apoptoza poate fi folosit in prevenirea pierderii celulei acordand timp altor forme de terapie sa inlature infectia. In cancer, dimpotriva, va avea valoare terapeutica o cale de stimulare a apoptozei in celulele maligne. Modul de obtinere al acestui efect cu specificitate adecvata reprezinta o provocare la fel ca in cazul agentilor chemoterapeutici uzuali. Desigur, celulele T citotoxice, una din cele mai stralucite inventii ale naturii, stiu cum sa ucida specific.
O alta potentiala terapie e reprezentata de anticorpii declansatori ai apoptozei, dar foarte importante sunt si imunotoxinele ce ascund liganzi ce induc apoptoza.
Concomitent cu explorarea potentialului terapeutic al apoptozei este necesara descoperirea mecanismelor si moleculelor implicate.
Evolutiei i-au trebuit milioane de ani pentru dezvoltarea unui sistem desavarsit, capabil sa elimine celulele nedorite; noua ne revine dificila sarcina de a descoperi cum sa inducem organismului comutarea procesului pe "on" sau "off", la comanda.
Legaturile intercelulare caracteristice formelor superioare de viata nu ar fi posibile fara un mecanism de indepartare individuala a celulelor care nu mai sunt necesare sau care nu mai functioneaza normal. Reglarea defectiva a mortii celulare programate ar putea juca un rol in etiologia cancerului, SIDA, bolilor autoimune si bolilor degenerative ale sistemului nervos central. Manipularea farmacologica a apoptozei ofera noi posibilitati de profilaxie si tratament acestor maladii.
Transformarea maligna
Deoarece o celula trebuie sa sufere o serie de modificari moleculare pentru a atinge fenotipul malign si datorita faptului ca aceste schimbari sunt deseori induse de agenti sau tratamente care, in timp, altereaza celula, orice activeaza supravietuirea celulelor deteriorate sau initiate promoveaza carcinogeneza.
In majoritatea cazurilor, celulele canceroase sunt diferite de celulele normale din punct de vedere morfologic. Variatiile legate de marimea si forma celulelor si a nucleilor lor corespund pleomorfismului celulelor tumorale. Nucleul este deseori marit, cu densitati inegale (hiper- sau hipocromatism), o membrana nucleara neregulata, angulara, nucleoli proeminenti, singulari sau multipli. Exista o crestere a raportului nucleo-citoplasmatic. Se observa si celule "bizare", cu nuclei polilobati sau multipli si celule gigantice. Aceste modificari reprezinta semnele citologice ale malignitatii. Exista si exceptii, in anumite varietati de cancer, celulele tumorale au un aspect morfologic foarte apropiat de celulele normale; ca urmare diagnosticul de malignitate este dificil de hotarat si in astfel de situati se apeleaza la alte criterii, in particular arhitecturale.
Majoritatea cancerelor se caracterizeaza printr-un numar mare de celule in diviziune. Aceste mitoze sunt uneori anormale, mitoze tri- sau multipolare. Indicele mitotic, definit prin numarul de mitoze pe unitatea de camp microscopic, are o valoare data contribuind la evaluarea prognostica a tumorilor. In realitate, cancerele nu poseda un indice mitotic ridicat, ca cel care se poate observa in patologia nontumorala. Totusi, in anumite tipuri de cancer, diagnosticul de malignitate se bazeaza pe indicele mitotic (79).
Apoptoza si cancerul
Oncologii au fost traditional preocupati in principal de proliferarea celulara, cu toate acestea in ultimul timp atentia lor se indreapta, cu un interes din ce in ce mai mare, spre studiul apoptozei (2, 11, 80).
Observatia legata de aparitia apoptozei in tumori nu este recenta. Cu peste 20 de ani in urma s-a sugerat ca apoptoza este responsabila de o mare parte din pierderile celulare ce apar in tumori, observatii obtinute in studiile cinetice, si nu mai este o noutate extinderea ei si activarea in tumori ca urmare a aplicarii bine cunoscutelor metode terapeutice: iradierea, chemoterapia citotoxica, ablatie hormonala (81,82). Totusi, in ultimii ani, extinderea cunostintelor despre controlul apoptozei la nivel molecular a dus la largirea semnificatiei ei potential oncologice depasind simpla alimentare a unei explicatii mecaniciste pentru deletia celulelor tumorale. In particular, descoperirea faptului ca apoptoza poate fi reglata de produsii unor anumite proto-oncogene si de gena supresor tumoral p53, a deschis noi drumuri viitoarelor cercetari.
Atunci cand modificarile de la nivelul ADN cauzeaza acumularea anormala de celule se produce transformarea maligna. Ratele comparative, ale mortii celulare si ale diviziunii celulare, determina viteza de crestere a cancerului. Anumite celule canceroase se divid mult mai incet decat celulele normale, dar, cancerul continua sa se extinda datorita prelungirii timpului de viata al celulei.
Multi carcinogeni provoaca rupturi ADN sau interfera cu enzimele necesare pentru replicarea corecta a ADN. Celula poate raspunde la acest tip de alterare in mai multe feluri: poate intarzia diviziunea celulara pana la rerpararea leziunii, poate suferii apoptoza sau poate progresa fara intrerupere in ciclul de crestere celulara.
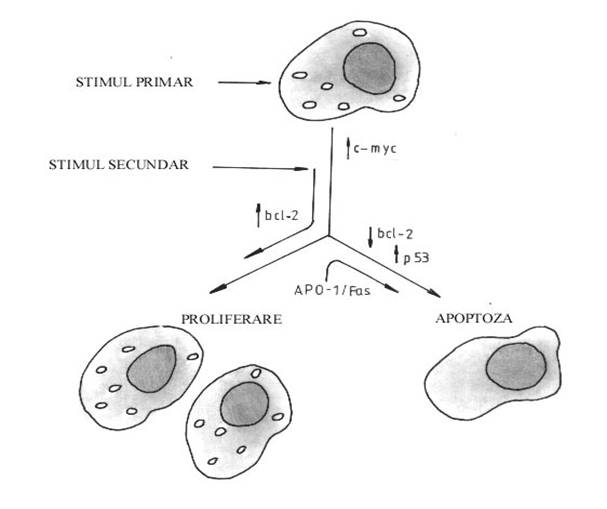
Apoptoza este o metoda eficienta de prevenire a transformarii maligne deoarece ea indeparteaza celulele care poseda alterari genetice. Apoptoza anormala poate promova dezvoltarea cancerului, atat prin permiterea acumularii de celule in diviziune, cat si prin blocarea indepartarii variantelor genetice cu potential malign ridicat. Inca nu se cunosc factorii care determina celula sa urmeze una din cele trei cai: intrarea in apoptoza dupa leziune, repararea deteriorarii sau continuarea ciclului celular. Paradoxal, anumite gene care stimuleaza diviziunea celulara, cum este c-myc, participa la deciderea caii de urmat (81). Concentratiile de ARN si proteina pentru c-myc cresc timpuriu in apoptoza si supraexprimarea acestor oncogene induce apoptoza in fibroblaste (82).
Oncogena bcl-2 ar putea fi "supresorul general al mortii celulare" pentru genele care regleaza direct apoptoza (83). Toate celulele hematopoetice si limfoide, multe celule epiteliale si neuronii contin gena bcl-2, intalnita in special in membrana mitocondriala, nucleu si reticul endoplasmic. Limfoamele foliculare de celule B poseda o concentratie crescuta de proteina Bcl-2, datorita translocatiei [t(14:18)] care plaseaza gena bcl-2 sub controlul unui promotor puternic, cel al genei ce codifica pentru lantul greu al imunoglobulinei. Proteinele virusului Epstein-Barr cresc nivelul expresiei genei bcl-2 in celulele limfomului Burkitt (84).
Comparativ cu limfocitele B normale, acelea care exprima bcl-2 supravietuiesc mai mult in cultura dupa privarea de factori de crestere si sunt rezistente atat la radiatii ionizante cat si la glucocorticoizi. De asemenea, concentratiile crescute de Bcl-2 protejeaza celulele de apoptoza indusa de catre c-myc (85). Soarecii transgenici, care au fost inginerizati pentru a supraproduce proteina Bcl-2, in limfocitele B, deseori dezvolta limfoame imunoblastice cu celule mari si difuze. La jumatate din aceste tumori cu grad avansat de dezvoltare se remarca translocatia genei c-myc (86).
Produsul proteic al genei supresoare tumorale p53 poate intarzia progresia ciclului celular inaintea initierii sintezei replicative de ADN. Multe cancere umane poseda mutatii sau deletii la nivelul genei p53 (87). Proteinele codificate de virusurile oncogene pot de asemenea lega si inactiva proteina p53. Proasta functionare a p53 poate promova dezvoltarea cancerului prin permiterea duplicarii DNA in celulele cu mutatii secundare, inainte de o reparare completa. Totusi, p53 este doar un inhibitor al diviziunii celulare, in alte situatii se comporta ca o "apoptogena" directa (o gena ce cauzeaza apoptoza). Superproducerea proteinei p53 normale, in linia celulara leucemica mieloida, induce rapid moartea celulara prin apoptoza (88) (figura 10).
|
|
Figura 10. Relatia dintre proliferarea celulara si apoptoza.
In multe tipuri celulare, proliferarea necesita cel putin doi stimuli externi, uneori numiti semnale de competenta si progresie. Semnalele de competenta declanseaza evenimentele metabolice comune atat replicarii cat si apoptozei; semnalul de progresie abate celula spre replicare, altminteri survine apoptoza.
Apoptoza poate fi considerata o cale alternativa care distruge celulele incapabile sa strabata "punctul de vama" inainte de replicarea ADN si se petrece in celulele competente activate, cand un semnal de progresie este absent sau anormal sau cand o celula nu-si repara o leziune intr-o perioada critica.
Majoritatea medicamentelor anticancerigene: inhibitori ai topoizomerazei, agenti alchilanti, antimetaboliti si hormoni antagonisti, produc apoptoza in celulele sensibile (89). In urma acestor observatii este subanteles faptul ca eficienta lor nu depinde totdeauna doar de interactia cu o tinta biochimic specifica; un efect asupra evenimentelor metabolice conducand la apoptoza poate, de asemenea, influenta raspunsul la chemoterapie. S-a descoperit faptul ca, in diferite cancere umane, concentratia endonucleazelor calciu dependente, care degradeaza ADN pe parcursul apoptozei, variaza enorm. Tendinta unei celule cancerigene de a suferi apoptoza poate fi importanta in special pentru terapia tumorilor maligne cu o rata scazuta de crestere, care sunt de obicei rezistente la agenti citostatici.
Aparitia spontana a apoptozei in tumori
Apoptoza poate fi gasita in toate tumorile virtuale, netratate. Desi s-au efectuat putine studii cantitative precise (90), evaluarile histologice indica faptul ca extinderea apoptozei in anumite tumori umane se apropie de ceea ce s-a observat in tesuturile cu involutie rapida evidentiind semnificatia sa cinetica, uneori considerabila.
Factorii responsabili pentru aparitia spontana a apoptozei in tumori sunt, indubitabil, diversi. Apoptoza, deseori este proeminenta mai ales la locusul de confluenta cu necroza, unde se presupune ca ischemia moderata este implicata in initierea ei, aceasta este o cauza cunoscuta a activarii apoptozei in tesuturile non-neoplazice (91, 92).
S-a aratat ca, TNFα (factorul de necroza tumoral) induce apoptoza in liniile de celule tumorale in vitro, astfel, o serie de fenomene apoptotice observate in vivo in tumori ar putea fi atribuite eliberarii acestei citokine de catre macrofagele infiltrante. In alte cazuri, apoptoza poate fi rezultatul atacului tumorii de catre limfocitele T citotoxice. Totusi, un nivel ridicat al apoptozei este observat si in locusurile preneoplazice si in nodulii ce se dezvolta in ficat dupa administrarea de carcinogeni chimici (93), este improbabil ca factorii mentionati ar putea fi operativi in aceste circumstante. Este posibil ca prezumtivele mecanisme reglatoare ale populatiilor celulare, descrise mai sus, actioneaza intr-o etapa timpurie a procesului de carcinogeneza, cu o apoptoza crescuta ce echilibreaza temporar cresterea proliferarii celulare. In sfarsit, nivelurile crescute de apoptoza in tumori pot fi rezultatul unui proces intrinsec al acestor celule. Ratele de apoptoza gasite in tumori similare difera fiind rezultatul expresiei diferitelor oncogene.
Bibliografie
T.S. Griffith, T. Brunner, S.M. Fletcher, D.R. Green, and T.A. Ferguson, Science 270, 1189-1192 (1995).
J.F.R. Keer, A. H. Wyllie, and A. R. Currie, Br. J. Cancer 26, 239-257 (1972).
A. H. Wyllie, Cell death in Biology and Pathology, 9-34 (1981)
C. Dive and J.A. Hickman, Br. J. Cancer 64, 192-196 (1991)
C. Dive, C.D. Gregory, D.J. Phipps, D.L. Evans, A.E. Milner and A. H. Wyllie, Bioch. Biophy. Acta 1133, 275-282 (1992)
H.M. Ellis, and H.R.Horvitz, Cell 44, 817-829 (1986)
R.S. Malyapa, and S. Sawada, Radiat. Res.,125 , 134-140 (1991)
J.Y. Yuan, and H.R. Horvitz, Dev. Biol. 138, 33-41 (1990)
A. H. Wyllie, J.F.R. Keer, and A. R. Currie, Int. Rev. Cytol. 68, 251-305 (1980).
F. Oberhammer, J. W. Wilson, C. Dive, I. D. Morris, J. A. Hickman, A. E. Wakeling, P. R. Walker, and M. Sikorska, EMBO J. 12, 3679-36-84 (1993).
A. H. Wyllie, Nature 284, 555-556 (1980).
M. D. Jacobson, J. F. Burne, and M. C. Raff, EMBO J. 13, 1899-1910 (1994).
K. Schulze-Osthoff, H. Walczak, W. Droge, and P. H. Kramer, J. Cell Biol. 127, 14-20 (1994).
S. H. Kaufmann, Cancer Res.49, 5870-5878 (1989).
D. S. Ucker, J. Mayer, and P. S. Obermiller, J. Immunol.149, 1583-1592 (1992).
Y. A. Lazebnik, S. Cole, C. A. Cooke, W. G. Nelson, and W. C. Earnshaw, J. Cell Biol. 123, 7-22 (1993).
S. Raipert, B.M. Raipert, J.A. Hickman and T.D. Allen, Cell Death Differ., 3, 131-139 (1996)
G. Kroemer, P. Petit, Z. Naofal, J.-L. Vayssiere and B. Mignotte, FASEB J., 9, 1277-1287 (1995)
L. Fesus, V. Thomazy and A. Falus, FASEB J., 224, 104-108 (1987)
J. Savill, Biochem. Soc. Trans. 224, 1065-1069
W. Burch, S. Pafe, B. Putz, G. Barthel, and R. Schulte-Hermann, Carcinogenesis 11, 847-853 (1990)
R. Berges, and J.T. Jsaacs, Clin. Chem. 39, 2-8 (1993)
J.T. Jsaacs, P.I. Lundmo, R. Berges, P. Martikainen, N. Kyprianos, and H.F. English, J. Androl., 13, 457-464 (1992)
D.K. Armstrong, J.T. Jsaacs, Y.L. Ottaviano, and N.E. Davidson, Cancer Res., 52, 3418-3424 (1992)
R.J. Smeyne, M. Vendrell, M.Hayward, S.J. Baker, G.G. Miao, K. Schilling, L.M. Robertson, T. Curran, and J.I. Morgan, Nature, 363, 166-169 (1993)
G.E. Deng, and E.R. Podack, Proc. Natl. Acad. Sci U S A, 90, 2189-2193 (1993)
S. Orrenius, D.J. McConkey, G. Bellomo, and P. Nicotera, Trends Pharmacol. Sci., 10, 281-285 (1989)
M.J. Arends, R.G. Morris, and A.H. Wyllie, Am .J Pathol., 136, 593-608 (1990)
C.R. Knight, R.C. Recs, and M. Griffin, Biochim. Biophis. Acta, 1096, 312-18 (1991)
S.M. Pittman, M. Geyp, S.J. Tynan, C.M. Gramacho, D.H. Strickland, and M.J. Fraser, Tubulin in apoptotic cells, Harwood Academic Publishers, 315-323 (1993)
T.G. Cotter, S.V. Lennon, J.M. Glynn, and D.R. Green, Cancer Res., 52, 997-1005 (1992)
F. Oberhammer, J.W. Wilson, C. Dive, I.D. Morris, J.A. Hickman, and A.E. Wakeling, EMBO J, 12, 3679-3684 (1993)
F. Obsehammer, W. Burch, W. Parzefall, P. Brett, E. Erben, M. Stadler, and R. Schulte-Hermann, Cancer Res., 51, 2478-2485 (1991)
D.S. Ucker, P.S. Obermiller, W. Eckhart, J.R. Apgar, N.A. Berge and J. Meyers, Mol. Cell. Biol., 12, 3060-3069 (1992)
D. Barbieri, L. Troiano, E. Grassilli, C. Agnesi, E.A. Cristofalo, D. Monti, M. Capri, A. Cossariza and C. Franceschi, Biochem. Biophy. Res. Commun., 187, 1256-1261 (1992)
L.D. Tomei, J.P. Shapiro and F.O. Cope, Proc. Natl. Acad. Sci U S A
D.G. Brown, X-M. Sun and G.M. Cohen, J. Biol. Chem., 268, 3037-3039 (1993)
J.J. Cohen and R.C. Duke, J. Immunol., 132, 38-42 (1984)
P. Nicotera, P.
Hartzell, G. Davis and
M. Poenie, R.Y. Tsien and A-M Schmitt-Verhulsm, EMBO J., 6, 2233-2238 (1987)
N.L. Allbritton, C.R. Verret, R.C. Wooley and H.N. Eisen, J. Exp. Med., 167, 514-519 (1988)
D.J. McConkey, P. Hartzell, Nicotera and S. Orrenius, FEBS Lett., 3, 1843-1949 (1989)
M.Perotti, F. Toddei,
F. Mirabelli, M. Vairetti, G. Bellomo, D.J. McConkey and
R.A. Schwartzman and J.A. Cidlowski, Endocrinology, 133, 591-599 (1993)
M.C. Peitsch, B. Polzar, H. Stephan, T. Crompton, H.R. MacDonald, H.G. Mannerz and J. Tschopp, EMBO J., 12, 371-377 (1993)
J.T. Issacs, Curr. Opin. Biol., 6, 82-89 (1994)
J. Filipski, J. Leblanc, T. Youdale, M. Sikorska and P.R. Walker, EMBO J., 9, 1319-1327 (1990)
P.R. Walker, V.M. Weaver, B. Lach, J. Leblanc and M. Sikorska, Biochem.Cell.Biol., 213, 100-106 (1994)
X.M. Sun and G.M. Cohen, J.Biol.Chem., 269, 14857-14860 (1994)
B. Zhivotovsky, B. Cedervall, S. Jiang, P. Nicotera and S. Orrenius, Biochem.Biophys.Res.Commun., 202, 120-127 (1994)
C. Giannakis, I.J. Forbes and P.D. Zalewski, Biochem.Biophys.Res.Commun., 181, 915-920 (1991)
P.D. Zalewski, I.J. Forbes and W.H. Betts, Biochem. J., 296, 403-408 (1993)
M. Loukkamaki, K. Servomaa and T. Rytomaa, Int. J. Radiat. Biol., 63, 207-213 (1993)
M.J. Arends, R.G. Morris and A.H. Wyllie, Am. J. Pathol., 136, 593-608 (1990)
P.R. Walker and M. Sikorska, Biochemistry, 25, 3839-3845 (1986)
W.M. Weaver, B. Lach, P.R. Walker and M. Sikorska, Biochem. Cell Biol., 71, 488-500 (1994)
M. Murgia, P. Pizzo, D. Sandona, P. Zanovello, R. Rizzuto and F. Di Virgilio, J. Biol. Chem., 267, 10939-41 (1992)
M.J. Arends,R.G. Morris and A.H. Wyllie, Am J Pathol., 136, 593-608 (1990)
J. Savill, V. Fadok, P. Henson and C. Haslett, Immunol Today, 14, 131-136 (1993)
V.A. Fadok, D.L. Bratton, S.C. Frasch, M.L. Warner and P.M. Henson, Cell Death Differ., 5, 551-562 (1998)
V.A. Fadok, D.R. VoelkerP.A. Campbell, J.J. Cohen, D.L. Bratton and P.M. Henson, J. Immunol., 148, 2207-2216 (1992)
A. Shiratsuchi, M. Umeda, Y. Ohba and Y. Nakanishi, J. Biol. Chem., 272, 2354-2358 (1997)
B. Verhoven, R.A. Schlegel and P. Williamson, J. Exp. Med., 182, 1597-1601 (1995)
R.F.A. Zwaal and A.J. Schroit, Blood, 89, 1121-1132 (1997)
L. Falasca, A. Bergamini, A. Serafino, C. Balabaud and L. Dini, Exp. Cell Res., 224, 152-162 (1997)
J. Hughes, Y. Liu, J. VanDamme and J. Savill, J. Immunol., 158, 4389-4397 (1997)
D. Pradhan, S. Krahling, P. Williamson and R.A. Schlegel, Mol. Cell Biol., 8, 767-778 (1997)
A. Devitt, C. Raykundalia, O.D. Moffatt, J.D. Capra, D.L. Simmons and C.D. Gregory, Nature, (1998)
K. Murao, V. Terpstra, S.R. Green, N. Kondratenko, D. Steinberg and O. Quehenberger, J. Biol. Chem., 272, 17551-17557 (1997)
S.J. Weiss, New Engl. J. Med., 320, 365-375 (1989)
D.A. Bell and B. Morrison, Clin. Immunol. Immunopth., 60, 13-26 (1991)
S.R. Batsford, APMIS, 99, 1-9 (1991)
R.G. Moris, A.D. Hargreaves, E. Duvall and A.H. Wyllie, Am. J. Path. , 115, 426-436 (1984)
J.S. Savill, N. Hogg, Y. Ren and C. Haslett, J. Clin. Invest., 90, 1513-1522 (1992)
R.E. Ellis, J. Yuan and R.H. Horvitz, Annu. Rev. Cell Biol., 7, 663 (1991)
H. Steller, Science, 267, 1445-1449 (1995)
J. Savill and V. Fadok, Nature, 407, 784-788 (2000)
N. Platt, R.P. da Silva and S. Gordon, Trends Cell Biol., 8, 365-372 (1998)
J.Audouin, M.A. de Maublanc and T. Maolina, Cancerologie Aujourd'hui, 4 (2), 51-69 (1995)
P. Goldstein, D.M. Ojcius and J.D. Young, Immunol Rev., 121, 29-65 (1991)
M. Oren M, Cancer Metastasis Rev., 11, 141-148 (1990)
G.I. Evan, A.H. Wyllie and C.S. Gilbert, Cell, 69, 119-128 (1992)
S.J. Korsmeyer, Surveys, 15, 105-118 (1992)
J. Finke, R. Firtzen and P. Temess, Blood, 80, 459-469 (1992)
R.P. Bissonette, F.
Echeverri, A. Mahboubi and
T.J. McDonnel and S.J. Korsmeyer, Nature, 349, 254-256 (1991)
A.J. Levine, J. Momand
and
E. Yionish-Rouach, D. Resnitsky, J. Lotem, L. Sacha, A. Kimchi and M. Oren, Nature, 353, 345-347 (1991)
J.A. Hickman, Cancer Metastasis Rev., 11, 121-139 (1992)
C.E. Sarraf and I.D. Bowen, Cell Tissue Kinet., 21, 45-49 (1988)
J.F.R. Kerr, J Pathol., 105, 13-20 (1971)
G.C. Gobe, R.A. Axelsen and J.W. Searle, Lab Invest., 63, 770-779 (1990)
A. Columbano, G.M. Ledda-Columbano, P.M. Rao, S. Rajalakshmi and D. Sarma, Am. J. Pathol., 116, 441-446 (1984)
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Analize pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||