| Aeronautica | Comunicatii | Drept | Informatica | Nutritie | Sociologie |
| Tehnica mecanica |
Tehnica mecanica
|
|
Qdidactic » stiinta & tehnica » tehnica mecanica Aplicatii ale principiilor termodinamicii la gaze |
Aplicatii ale principiilor termodinamicii la gaze
Aplicatii ale principiilor termodinamicii la gaze
Principiile termodinamice sunt valabile pentru orice sisteme termodinamice (corpuri macroscopice), insa noi ne vom ocupa numai de aplicatiile acestor principii la cele mai simple sisteme, adica gaze. Vom discuta despre gazele ideale si despre gazele reale de tip Van der Waals.
1 Ecuatiile de stare ale gazelor ideale si reale
Deosebirile dintre gazul ideal si cel real, adica mai exact, intre comportarea aceluiasi gaz ca un gaz real sau un gaz ideal, pot fi concretizate astfel:
Putem spune ca un gaz se comporta ca un gaz ideal in cazul in care este foarte rarefiat, situatie in care se poate neglija volumul propriu al moleculelor in raport cu volumul ocupat de gaz si datorita distantelor mari dintre molecule, fortele de interactiune moleculara sunt pracic nule.
Un gaz se comporta ca un gaz real, la presiuni mari si temperaturi scazute unde nu se poate neglija volumul propriu al moleculelor si nici fortele de interactiune moleculara.
Ecuatiile de stare pentru cele doua situatii prezentate, obtinute experimental, sunt
pV = nRT , (85)
pentru gazul ideal, si
![]() , (86)
, (86)
pentru gazul real (Van de Waals), unde a si b sunt doua constante. Relatia (86) pentru un kmol de substanta se poate scrie
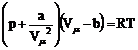 . (87)
. (87)
In aceasta relatie
![]() (88)
(88)
se numeste presiune interna si este data de fortele de atractie dintre molecule.
O alta deosebire dintre gazul real si gazul ideal consta in aceea ca energia interna a gazului ideal depinde doar de temperatura, iar energia interna a gazului real depinde si de volum, deci
U = U(T) - pentru gazul ideal (89)
U = U(T, V) - pentru gazul real (90)
Explicatia acestor dependente consta in aceea ca la gazele ideale moleculele nu interactioneaza intre ele si energia interna este formata numai din energia cinetica a moleculelor, care depinde de temperatura gazului. La gazele reale, energia interna este formata din energia cinetica si energia potentiala a moleculelor, datorita faptului ca ele interactioneaza intre ele, iar energia potentiala depinde de distanta dintre ele, deci de volumul gazului.
2 Coeficientii calorici la gaze
In cazul general, in care U=U(V,T), diferentiala totala a energiei interne este
![]() . (91)
. (91)
Inlocuind pe dU in ecuatia primului principiu al termodinamicii, in care am facut substitutia
dL = p dV , (92)
obtinem
![]() . (93)
. (93)
La gaze, coeficientii calorici au valori diferite, functie de natura procesului. Astfel, daca procesul are loc la volum constant, atunci din (93) rezulta
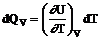 , (94)
, (94)
si deci
![]() . (95)
. (95)
Daca procesul are loc la presiune constanta, atunci relatia (94) devine:
![]() , (96)
, (96)
sau
![]() , (97)
, (97)
de unde
![]() . (98)
. (98)
Acesta relatie este generala, in sensul ca se aplica oricarui tip de gaz, ideal sau real.
Facem urmatoarea observatie: Cmp va fi intotdeauna mai mare decat Cmv deoarece caldura primita de un gaz atunci cand volumul acestuia este constant foloseste doar la cresterea energie sale interne, pe cand intr-un proces izobar, este necesara mai multa caldura, pentru ca pe langa cresterea energiei sale interne, gazul efectueaza si un lucru mecanic.
3 Energia interna a gazelor
Sa aflam concret dependenta U(T,V) pentru gazul real si U(T) pentru gazul real.
Din definitia caldurii molare la volum constant putem obtine expresia energiei interne a gazului ideal, definita pana la o constanta arbitrara. Astfel, integrand ecuatia
dU = n CmVdT , (99)
se obtine
U = nCmVT + U0 = U(T) . (100)
Joule, intr-o experienta celebra, in care are loc destinderea unui gaz in vid, a aratat ca in cazul unui gaz ideal, energia interna nu depinde de volum. Repetand experienta lui Joule cu un gaz real se constata o variatie a energiei interne a gazului determinata de variatia volumului acesteia. Aceasta variatie a energiei interne se masoara prin lucrul mecanic dL efectuat de gaz in timpul dilatarii, impotriva fortelor de coeziune care actioneaza intre molecule, forte care se opun variatiei distantei dintre ele
dL = dLint = pidV , (101)
unde pi reprezinta presiunea interna. inlucuind in (101) expresia presiunii interne data de (88), se obtine
![]() . (102)
. (102)
Prin integrare, se obtine
![]() . (103)
. (103)
|
Constanta de integrare A din (103) se afla din conditia la limita, cand volumul V ocupat de gaz este foarte mare (adica gazul este rarefiat si fortele de coeziune dintre molecule tind la zero) energia interna a gazului sa tinda la valoarea energiei interne a gazului ideal.
Prin urmare, pentru V , avem
U = A = nC V T +U0 . (104)
In acest caz relatia (103) devine:
![]() . (105)
. (105)
4 Expresiile principiului I al termodinamicii pentru gaze
Pentru gazul ideal, principiul I are forma
dQ = nCmvdT + pdV , (106)
unde pdV reprezinta lucrul mecanic de gaz efectuat impotriva fortelor exterioare
In cazul gazelor reale, principiul I se scrie sub forma
![]() , (107)
, (107)
expresie ce
se poate obtine din (106) prin inlocuirea lui p cu p+pi=p+![]()
5 Relatia Robert-Mayer
Pentru gazul ideal, folosind relatia (100), se obtine
![]() (108)
(108)
si relatia (98) devine
![]() . (109)
. (109)
Din ecuatia de stare (85) pdV = nRdT. Tinand cont de aceasta, relatia (109) devine
![]() , (110)
, (110)
numita relatia lui Robert-Mayer pentru gazul ideal
Pentru gazul real, din (105) se calculeaza
![]() , (111)
, (111)
iar ![]() se calculeaza
dupa cum urmeaza.
se calculeaza
dupa cum urmeaza.
Din matematica se stie ca
![]() (112)
(112)
Pe baza acestei relatii putem scrie
![]() (113)
(113)
de unde
 (114)
(114)
Din ecuatia de stare Van de Waals (86) rezulta
![]() (115)
(115)
![]() (116)
(116)
Inlocuid (115) si (116) in (114), avem
 (117)
(117)
Dupa inlocuirea lui (111) si (117) in (98) si tinand seama de ecuatia de stare (86), se obtine
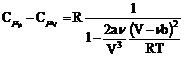 (118)
(118)
relatie care poate fi aproximata sub forma
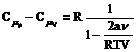 (119)
(119)
sau, tinand seama ca
![]() , relatia (119) devine:
, relatia (119) devine:
![]() (120)
(120)
Aceasta relatie se numeste relatia lui Rober Mayer pentru gazul real.
Experimental s-a constatat ca intr-un proces izocor (L=0) este necesara aceeasi cantitate de caldura pentru cresterea temperaturii cu DT atat pentru un kmol de gaz real, cat si pentru un kmol de gaz ideal
QV = (DU)V gaz ideal=(DU)V gaz real=nCmvDT (121)
De aici rezulta ca Cmv este acelasi pentru un gaz, fie el in stare de gaz ideal, fie in stare de gaz real
Tinand seama de relatiile (111), (120) si (121) rezulta ca
Cmp gaz real > Cmp gaz ideal (122)
6 Procese politrope
Prin proces politrop se imtelege procesul in care capacitatea calorica a corpului ce sufera transformarea este mentinuta constanta.
Cazul gazului ideal
Primul principiu al termodinamicii (22) poate fi scris sub forma
nCmdT = nCmvdT + pdV (123)
Grupand termenii sub forma
n(Cm-Cmv)dT = pdV (124)
si tinand cont de ecuatia de stare a gazului ideal (pV=nRT), se obtine:
![]() (125)
(125)
sau, prin integrare
![]() (126)
(126)
Trecand de la variabilele T si V la p si V cu ajutorul ecuatiei de stare, se obtine
![]() (127)
(127)
Notand cu
![]() (128)
(128)
indicele politrop, ecuatia unei transformari politrope devine:
![]() (129)
(129)
Cazul gazului real.
In mod analog poate fi dedusa si ecuatia proceselor politrope suferite de gazele reale.
Primul principiu pentru un gaz real are forma
![]() (130)
(130)
Pe baza relatiei (86) se scrie
![]() (131)
(131)
si relatia (130) devine
![]() (132)
(132)
Prin aranjarea termenilor si integrare se obtine:
![]() (133)
(133)
Cazuri particulare ale proceselor politrope.
Vom analiza cateva cazuri particulare numai pentru gazul ideal. Prin analogie, se poate trata si cazul gazelor reale.
1. Transformarea izocora
Deoarece V=constant , dV=0 si
![]() (134)
(134)
In cazul acestei transformari indicele politrop are valoarea
![]() (135)
(135)
Ecuatia (129) se va scrie sub forma
p1/cV = p0V = V = const. (136)
Lucrul mecanic dL=0 deoarece dV=0 si dU=dQ=nCmvdT.
In procesul izocor variatia entropiei sistemului se calculeaza astfel
![]() (137)
(137)
Daca procesul este de incalzire se observa ca DS>0, adica entropia sistemului creste, iar daca procesul este de racire, entropia sistemului scade (DS<0).
2. Transformarea izobara.
Deoarece transformarea are loc la presiune constanta
dp=0 (138)
si caldura molara este
![]() (139)
(139)
In acest caz indicele politrop are valoarea
![]() (140)
(140)
iar ecuatia (129) devine
p = constant (141)
Lucrul mecanic este dL=pdV, iar caldura
dQ = dU+pdV = d(U+pV) = dH (142)
unde H reprezinta entalpia.
Variatia entropiei este
![]() (143)
(143)
3. Transformarea izoterma.
Deoarece T=constant
dT=0 , (144)
iar caldura molara este
![]() . (145)
. (145)
Ultima relatie arata ca pentru un termostat (sistem care isi pastreaza temperatura constanta), pentru a-si pastra temperatura constanta ii trebuie o caldura infinita.
In acest caz indicele politrop este
![]() , (146)
, (146)
iar ecuatia (129) devine
p V = constant . (147)
Variatia energiei interne este data de expresia
dU = nCmVdT = 0
iar caldura schimbata
dQ = dL . (148)
Prin integrare se obtine
![]() . (149)
. (149)
Variatia entropiei este
![]() . (150)
. (150)
4. Transformarea adiabatica.
In aceasta transformare sistemul nu schimba caldura cu exteriorul, adica
dQ = 0 , (151)
iar caldura molara este
![]() . (152)
. (152)
Indicele politrop este dat de expresia
![]() , (153)
, (153)
iar ecuatia (129) capata forma
p Vg = const. . (154)
In aceasta transformare
dU = -dL . (155)
Lucrul mecanic se calculeaza astfel
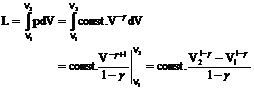 . (156)
. (156)
Variatia de entropie
![]() (157)
(157)
este nula in acest proces.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Proiecte pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||