| Aeronautica | Comunicatii | Drept | Informatica | Nutritie | Sociologie |
| Tehnica mecanica |
Tehnica mecanica
|
|
Qdidactic » stiinta & tehnica » tehnica mecanica Elemente de termodinamica - generalitati |
Elemente de termodinamica - generalitati
Elemente de termodinamica - Generalitati
Mecanica studiaza miscarea corpurilor tinand seama
rareori de structura lor interna. Pentru studiul miscarii
corpurilor si a interactiunilor mecanice
dintre corpuri sunt necesare si suficiente trei marimi fizice
fundamentale: lungimea (![]() ), masa (m)
si timpul (t). Toate celelalte marimi fizice
importante in mecanica pot fi exprimate prin aceste trei marimi
fundamentale.
), masa (m)
si timpul (t). Toate celelalte marimi fizice
importante in mecanica pot fi exprimate prin aceste trei marimi
fundamentale.
Insa, pe langa miscarea corpurilor ca un tot, exista si miscarea interna a acestora. Miscarea permanenta si dezordonata a particulelor (atomi, molecule, ioni) din interiorul corpurilor este denumita miscare termica sau agitatie termica. Mentionam ca agitatia termica nu este produsa de vreo cauza exterioara, ci este o proprietate caracteristica moleculelor. Existenta acestei miscari se manifesta in majoritatea fenomenelor fizice. Deci, chiar simpla deplasare a unui corp intr-un mediu dat nu este un fenomen pur mecanic, ea fiind insotita si de fenomene termice. Prin fenomen termic se intelege, in general, orice fenomen fizic legat de miscarea complet dezordonata care se manifesta la nivelul moleculelor.
Exemple de fenomene termice:
variatia proprietatilor fizice ale substantei la incalzirea sau la racirea ei;
schimbul de caldura intre corpurile incalzite diferit;
transformarea caldurii (obtinuta prin arderea combustibililor) in lucru mecanic si invers, a lucrului mecanic in caldura;
trecerea unui corp dintr-o stare de agregare in alta.
Fenomenele termice implica aspecte care sunt total nemecanice si care cer pentru descrierea lor o alta marime fundamentala numita temperatura.
Cu studiul miscarii termice a materiei si a legaturii dintre miscarea termica si celelalte forme de miscare se ocupa termodinamica.
Miscarea termica, care difera de celelalte forme de miscare (mecanica, electromagnetica, a particulelor elementare), nu poate fi redusa la o simpla miscare mecanica a particulelor care formeaza corpul. Miscarea termica apare intr-un corp numai in conditiile in care corpul este format dintr-un numar foarte mare de particule, dar finit. Nu putem vorbi despre miscare termica in cazul miscarii unui singur electron, sau in cazul unui "gaz" format dintr-un numar redus de particule. Deci, miscarea termica este o miscare colectiva.
Studiul miscarii termice si a relatiilor ei cu alte forme de miscare ale materiei se poate face prin doua metode: metoda fenomenologica si metoda statistica.
Metoda fenomenologica, studiaza fenomenele termice facand abstractie de structura intima atomo-moleculara a corpurilor. Aceasta metoda nu opereaza cu nici un model privind structura interna a sistemelor, ci, pornind de la fapte experimentale foarte generale, formuleaza o serie de principii, de valabilitate generala, pe baza carora se poate descrie compotarea unui sistem macroscopic.
Metoda fenomenologica, cunoscuta sub denumirea de termodinamica, foloseste numai marimi direct masurabile la scara macroscopica ca: temperatura, volumul, presiunea, caldura sau marimi ce pot fi calculate cu ajutorul altor marimi, ce pot fi stabilite pe cale experimentala.
Astfel, concluziile termodinamicii sunt independente de reprezentarile pe care noi le avem cu privire la structura corpurilor.
Metoda statistica studiaza procesele termice tinand seama de structura intima a corpurilor, adica de structura moleculara si mecanismul proceselor la scara microscopica. Pornind de la ipoteza ca particulele constituiente ale corpului respectiv se supun legilor mecanicii clasice si folosind aparatul matematic al teoriei probabilitatilor, metoda statistica conduce la proprietatile macroscopice ale corpurilor. Marimile macroscopice, adica parametrii de stare ai unui sistem, se obtin prin medierea marimilor microscopice corespunzatoare. Deci, metoda statistica stabileste legile termodinamicii pentru corpuri macroscopice, luand in considerare legile care descriu comportarea constituientilor microscopici.
Ambele metode au atat avantaje cat si dezavantaje: metoda fenomenologica are un caracter mai general si este mai simpla deoarece foloseste un numar mic de parametri pentru determinarea starii sistemului precum si a evolutiei sale in timp, insa lasa nedescoperite mecanismele intime ale fenomenului. In ceea ce priveste metoda statistica, ea are rezultate bune doar in masura in care sunt valabile presupunerile facute referitor la comportarea particulelor ce compun sistemul si are avantajul ca poate stabili ecuatia de stare a unui sistem, teoria caldurilor specifice, etc.. Teoria obtinuta prin metoda statistica privind miscarea termica a primit denumirea de teoria cinetico-moleculara.
In concluzie, se poate spune ca termodinamica si teoria cinetico-moleculara au acelasi obiect de studiu, dar cu metode diferite, si se completeaza reciproc.
1.1 Energia interna
Un corp, care in termodinamica este numit sistem termodinamic, este format dintr-un numar foarte mare de particule (dar finit) aflate intr-o miscare continua, dezordonata si care interactioneaza intre ele. De aici rezulta ca particulele poseda o energie cinetica corespunzatoare miscarii termice dezordonate, precum si o energie potentiala datorata atat fortelor de interactiune dintre ele (forte intermoleculare), cat si interactiunii lor cu campuri de forte exterioare (de exemplu campul gravitational). Aceste energii formeaza energia interna a sistemului. Deci, energia interna a unui sistem se compune din energiile cinetice corespunzatoare formelor de miscare pe care le pot executa la nivel macroscopic particulele sistemului, precum si din energia potentiala de interactiune a acestor particule.
De exemplu, energia interna a unui gaz inchis intr-o incinta va fi compusa din: 1) energia cinetica a moleculelor corespunzatoare miscariide translatie si rotatie a moleculelor gazului; 2) energia potentiala a moleculelor conditionata de actiunea fortelor de interactiune moleculara; 3) energia cinetica si potentiala corespunzatoare miscarii de oscilatie a atomilor din molecule; 4)energia electronilor din atomi; 5) energia de miscare si interactiune a particulelor ce compun nucleele atomilor, etc..
Observatie: La sistemele la care ne vom referi, energia corespunzatoare particulelor subatomice (electroni, protoni, neutroni, etc.) nu sufera modificari in cursul transformarilor considerate. De aceea, prin energie interna a unui corp vom intelege numai energiile cinetice si poatentiale legate de miscarile termice ale atomilor si moleculelor din sistem si interactiunea lor reciproca.
Ce fel de marime este energia interna ?
Energia interna este o marime de stare, adica depinde doar de starea sistemului pe care o caracterizeaza. La aceasta concluzie s-a ajuns, observand ca la trecerea sistemului dintr-o stare cu energia U1 intr-o alta cu energia interna U2, indiferent de caracterul reversibil sau ireversibil al transformarii, variatia DU=U2-U1 a energiei interne nu depinde de starile intermediare prin care a trecut sistemul, ci doar de starile initiala si finala. Prin urmare, energia interna este o functie de stare care, ca si temperatura, volumul sau presiunea, face parte din categoria parametrilor macroscopici.
Energia interna este o marime aditiva, adica energia interna a unui sistem este egala cu suma energiilor partilor componente ale sistemului, in care am presupus ca l-am inpartit pe acesta din urma.
Daca sistemul termodinamic are si o miscare mecanica de ansamblu, caracterizata prin energia cinetica Ec si energia potetiala Ep, atunci energia totala este
|
Et = U + Ec + Ep , (1)
unde U este energia interna.
De exemplu: la ridicarea in camp gravitational a unui recipient cu gaz la inaltimea h se obtine
DEt = DEp . (2)
Daca sistemul este in stare de repaus mecanic, fara sa interactioneze cu campul exterior, atunci:
Et = U . (3)
In general, corpurile se afla in permanenta interactiune cu mediul exterior, acesta interactiune manifestandu-se printr-un schimb de energie. Daca sistemul interactioneaza mecanic cu mediul inconjurator, starea de echilibru termodinamic a sistemului nu se modifica, fortele exterioare realizand doar o deplasare mecanica a intregului sistem; acelasi lucru se intampla si in cazul interactiunii electromagnetice; alta este situatia daca sistemul interactioneaza termic cu mediul exterior: in acest caz sistemul paraseste starea de echilibru termodinamic, incepand sa efectueze o transformare in care anumiti parametri de stare ce caracterizeaza dimensiunile sistemului (cum ar fi volumul gazului sau lungimea resortului elastic) variaza in timp. Acesta este cazul in care are loc o variatie a energiei interne a sistemului.
Exista trei moduri posibile de variatie a energiei interne a unui corp:
a) prin efectuare de lucru mecanic;
b) prin schimb de caldura;
c) prin scimb de substanta intre corp si mediu.
Vom studia astfel de sisteme, marginandu-ne numai la sistemele a caror masa si compozitie chimica raman neschimbate in procesele termodinamice.
Sa analizam primele doua cazuri:
a) Energia interna a unui sistem variaza deci prin efectuarea asupra sa a unui lucru mecanic, care face ca parametrii de stare, care depind de dimensiunile sistemului sa varieze. Acesti parametri se mai numesc parametri de pozitie. De exemplu, la comprimarea unui gaz inchis intr-un cilindru cu piston, prin deplasarea pistonului (care face parte din mediul exterior), asupra gazului se efectueaza un lucru mecanic, parametrul de pozitie care variaza in acest proces fiind volumul gazului. Lucrul mecanic efectuat este L=Fdx=pdV. In urma ciocnirilor cu suprafata pistonului energia cinetica a moleculelor gazului creste, deci energia interna a gazului creste.
b) Enegia interna variaza prin schimbul de caldura. Din practica se stie ca atunci cand doua corpuri cu intensitati diferite ale miscarilor termice ale moleculelor sunt puse in contact, corpul mai cald se raceste, iar cel mai rece se incalzeste. Inseamna ca, in urma contactului termic, la corpul care s-a incalzit a avut loc o intensificare a agitatiei termice a moleculelor (deci o crestere a energiei sale interne), iar la corpul care s-a racit, o micsorare a energiei interne.
Acest proces de transmitere a energiei de la corpul mai cald la corpul mai rece a fost numit schimb de caldura. El se realizeaza la scara microscopica intr-un mod asemanator cu transmiterea energiei cinetice la ciocnirea elastica a doua bile; aici rolul bilelor il joaca particulele din care sunt constituite cele doua corpuri puse in contact.
Este important de semnalat faptul ca in timp ce energia este o marime care se refera la starea unui corp, atat lucrul mecanic cat si caldura sunt marimi care se refera la transformarea sistemului. Din acest motiv, lucrul mecanic si caldura nu sunt de fapt "forme de energie", ci sunt forme ale schimbului de energie dintre corp si mediul inconjurator. Este deci incorect sa vorbim despre "caldura aflata intr-un corp", ca si despre "lucrul mecanic aflat intr-un corp".
Avand in vedere faptul ca un sistem nu poate primi sau ceda simultan lucru mecanic si caldura, prin conventie s-a stabilit ca lucrul mecanic efectuat de sistem sa fie pozitiv si caldura primita pozitiva, iar caldura cedata de sistem negativa si lucrul mecanic primit de sistem negativ.
1.2 Temperatura
Fie doua corpuri A si B care formeaza un sistem izolat fata de exterior. Punand in contact cele doua corpuri, parametrii lor de stare se pot modifica sau nu. In situatia cand acestia nu se modifica inseamna ca cele doua corpuri se afla in echilibru termic. Pentru a defini starea de echilibru a doua corpuri s-a introdus notiunea de temperatura. Cand doua sau mai multe sisteme sunt in echilibru termic se spune ca ele au aceeasi temperatura.
Din viata de toate zilele se stie ca, atunci cand atingem un obiect, noi utilizam simtul tactil pentru a descrie proprietatea obiectului, numita temperatura, care arata daca el pare fierbinte sau rece la atingere. Deci, temperatura reprezinta un parametru care caracterizeaza starea de incalzire a unui corp, care este data, de fapt, de energia moleculelor sale.
Prin metoda statistica, temperatura unui corp se obtine folosind energia unui numar mare de molecule ale corpului respectiv. Deocamdata insa, ne vom referi numai la semnificatia fenomenologica a notiunii de temperatura.
Astfel, pe langa masa, lungime, timp am introdus notiunea de temperatura care trebuie masurata. Toate metodele de masurare a temperaturii se bazeaza pe principiul echilibrului termic si pe faptul, stabilit experimental, ca unele marimi fizice ce caracterizeaza corpurile variaza atunci cand temperatura se modifica. De exemplu, volumul unui lichid, lungimea unei bare, rezistenta electrica a unui fir metalic, presiunea unui gaz la volum constant, energia luminoasa emisa de filamentul unui bec incandescent. Aceste marimi care variaza cu temperatura se numesc marimi termometrice. Se aleg intotdeauna acele marimi care variaza liniar cu temperatura, astfel incat
![]() , (4)
, (4)
unde x(T1) si x(T2) sunt valorile marimilor termometrice la temperaturile T1 si T2.
Exista in termodinamica un principiu numit principiul zero al termodinamicii sau principiul tranzitivitatii echilibrului termic, care se enunta sub forma:
Doua sisteme aflate fiecare in echilibru termic cu un al treilea sistem, se afla in echilibru termic intre ele (adica au aceeasi temperatura).
Daca doua corpuri A si B sunt in echilibru termic, fiecare separat cu un corp C, atunci A si B sunt in echilibru termic, adica au aceeasi temperatura. Corpul C care stabileste ca A si B au aceeasi temperatura, se numeste temometru. Caracteristicile importante ale unui temometru sunt:
sensibilitate, adica raportul dintre schimbarea coordonatelor unei stari produsa de o variatie a temperaturii;
reproductibilitate;
rapiditate in a ajunge in echilibru termic cu alte sisteme;
dimensiuni mici in raport cu corpul a carui temperatura trebuie masurata, pentru ca modificarea proprietatilor corpului, produsa de termometru sa fie nesemnificativa.
Pentru fiecare termometru trebuie stabilita o scara de masura a temperaturii astfel incat masurarea ei sa se faca printr-o simpla citire. Stabilirea scarii de temperatura a unui termometru sau etalonarea termometrului se poate face prin punerea termometrului in contact termic cu un corp, aflat intr-o stare perfect reproductibila ( de ex. apa in echilibru cu vaporii sai si cu gheata, aur sau argint ce incep a se topi, apa care fierbe, etc.). Acestor stari perfect reproductibile li se asociaza in mod conventional valori bine determinate ale temperaturii.
Dam ca exemplu termometrul cu gaz. in cazul unui gaz ideal, mentinut la volum constant, dependenta presiunii de temperatura absoluta este data de realatia
p = ct. T . (5)
Prin urmare, o relatie de forma
T = a p (6)
permite determinarea temperaturii la care se afla gazul, daca se masoara presiunea acestuia in acel moment. Folosind ca punct fix etalon punctul triplu al apei, vom putea calcula temperatura gazului dupa formula (4)
![]() , (7)
, (7)
unde p(273,15K) s-a masurat dupa ce s-a stabilit echilibrul termic intre gaz si apa adusa la punctul triplu.
Exista mai multe scari de temperatura care difera intre ele fie prin originea scarii, fie prin marimea unitatii de temperatura (adica a gradului). Vom prezenta mai jos doar scarile: Celsius, Kelvin si Fahrenheit (Figura 1).
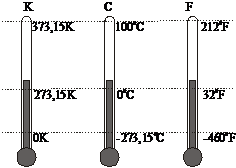
Figura 1
In scara Celsius 00C corespunde unui amestec de apa cu gheata in echilibru, iar la 1000C la apa care fierbe. Un grad Celsius este egal cu un grad Kelvin, doar originile celor doua scari difera. Legatura dintre temperaturile celor doua scari este data de relatia
tC = TK - 273,15 . (8)
Din figura 1 se observa ca scara Fahrenheit difera de scara Kelvin, cat si de scara Celsius prin originea scarii si prin marimea unitatii de masura. Legatura intre scara Fahrenheit si scara Celsius este data de relatia:
tF = tC 9/5 + 320F . (9)
1.3 Ecuatia de stare
Presupunem un sistem termodinamic caracterizat complet prin n parametri de pozitie si prin temperatura sa. Energia interna este functie doar de parametrii de pozitie ai sistemului si de temperatura sa
U=U(a1, a2, . . . , an, T) , (10)
unde ai cu i=1,2, . . ,n este multimea parametrilor de pozitie.
Se poate arata ca celor n parametri de pozitie a1, a2, . . , an le corespund intotdeauna n parametri de stare pe care ii vom nota cu A1, A2, . An numiti parametri de forta. Fiecare din parametrii de forta se pot exprima functie de cei n parametri de pozitie independenti si de temperatura
Ai = Ai(a1, a2, . . ,an, T) . (11)
Ecuatia (10) se numeste ecuatie de stare calorica, deoarece determinarea ei experimentala necesita masuratori de energie, iar ecuatiile (11) se numesc ecuatii de stare termice, intrucat pentru stabilirea lor experimentala sunt necesare masuratori de temperatura.
Particularizam aceste considerente pentru un gaz, care este cel mai simplu exemplu de sistem termodinamic. Exista un singur parametru de pozitie, adica un singur parametru extern, care este volumul. Ca urmare este un singur parametru de forta, care este presiunea.
Astfel, ecuatiile de stare ale unui gaz sunt:
U = U(V,T) (12)
p = p(V,T) . (13)
Sa dam cateva exemple de ecuatii de stare:
Daca pentru o substanta pura in stare gazoasa poate fi aplicata ecuatia
pV nRT , (14)
gazul se numeste ideal sau perfect. Ecuatia calorica de stare pentru gazul perfect este
U = U(T) . (15)
Daca exista diferente intre valorile masurate si cele calculate pe baza ecuatiei (14), gazul se numeste real si se aplica ecuatia Van der Waals
![]() . (16)
. (16)
Ecuatia (16) s-a obtinut tinand seama de existenta fortelor de interactiune dintre molecule, precum si de volumul propriu al moleculelor, care nu mai este neglijabil fata de volumul total ocupat de gaz.
Mentionam ca unul si acelasi gaz, care in majoritatea cazurilor are o comportare de gaz real, in anumite domenii ale "spatiului de stare" are o comportare de gaz perfect. Mai exact, un gaz se comporta ca un gaz real (verificandu-se relatia (16)) la temperaturi scazute si presiuni mari si ca un gaz ideal, la temperaturi mari si presiuni mici, cand distanta medie dintre molecule este mare, concentratia moleculelor fiind mica. (rgaz este mica).
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Lucrari pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||