| Aeronautica | Comunicatii | Drept | Informatica | Nutritie | Sociologie |
| Tehnica mecanica |
Tehnica mecanica
|
|
Qdidactic » stiinta & tehnica » tehnica mecanica Principiul III al termodinamicii. Consecinte. |
Principiul III al termodinamicii. Consecinte.
Principiul III al termodinamicii. Consecinte.
Principiul al II-lea al termodinamicii nu face nici o referire la comportarea sistemelor fizice in apropierea temperaturii de 0 K si nici la posibilitatea atingerii acestei temperaturi. De asemenea, pe baza principiului II, nu se poate calcula valoarea absoluta a entropiei, ci numai variatia acesteia, la trecerea sistemului de la o stare de echilibru in alta stare de echilibru.
Aceste neajunsuri ale principiului al II-lea al termodinamicii sunt completate de principiul al III-lea al termodinamicii care, spre deosebire de celelalte principii, nu introduce o noua functie de stare.
In urma unor experiente efectuate cu privire la proprietatile corpurilor la temperaturi scazute, fizicianul W. H. Nernst a enuntat o teorema, care ulterior a fost ridicata la rangul de principiu, numit principiul III al termodinamicii:
In apropiere de zero absolut, toate variatiile de stare se realizeaza fara variatie de entropie,
![]() . (72)
. (72)
Cu alte cuvinte, la zero absolut, entropia inceteaza sa mai fie o functie de stare, tinzand catre o valoare constanta, independenta de parametrii de stare ai sistemului, dar specifica fiecarui sistem in parte ( S01, S02, . . . ).
Teorema lui Nernst mai poate fi enuntata si sub forma:
Cand temperatura tinde spre zero absolut, entropia tuturor corpurilor pure reale tinde la o valoare limita finita.
Teorema lui Nernst va fi completata de afirmatia lui Max Planck:
Cand temperatura tinde la zero absolut, valoarea limita a entropiei tuturor corpurilor este prin definitie egala cu zero ( S01=S02=. . . =0 ).
Deci principiul III al termodinamicii este format din teorema lui Nernst completata de afirmatia lui Planck.
Sub forma matematica principiul III se scrie sub forma
![]() . (73)
. (73)
Din principiul III al termodinamicii rezulta o serie de consecinte importante privind comportarea substantelor la temperaturi foarte scazute, consecinte care se verifica experimental.
Una din consecinte consta in posibilitatea calcularii valorilor absolute ale entropiilor sistemelor. Dupa cum se stie variatia entropiei unui corp, cand temperatura acestuia variaza de la TA la TB este
![]() . (74)
. (74)
unde m = masa corpului, iar c = caldura specifica a corpului, care poate sa depinda de temperatura. Daca TA = 0 K si TB = T atunci SA = 0 si
![]() , (75)
, (75)
relatie care da valoarea absoluta a entropiei unui corp la temperatura T.
|
Relatia (75) este valabila numai daca in intervalul de temperatura 0 T corpul nu sufera o transformare de faza.
O alta consecinta este ca la zero absolut caldura specifica este egala cu zero. Intr-adevar, daca pentru T 0, caldura specifica tinde la o valoare diferita de zero, raportul c/T din relatia (75) ar tinde la infinit si deci DS nu ar avea o valoare finita, fapt ce contrazice principiul III. Deci este necesar ca pentru toate corpurile, caldura specifica sa tinda la zero cand T
Se poate arata, de asemenea, ca coeficientul de dilatare termica in volum, definit prin relatia
![]() (76)
(76)
si coeficientul de variatie a presiunii la volum constant
![]() (77)
(77)
pentru toate corpurile pure tind la zero cand T 0 si se anuleaza la T=0K.
4) O alta consecinta deosebita a principiului al III-lea este faptul ca pe baza lui se poate arata ca temperatura de zero absolut nu poate fi atinsa in natura prin nici un mijloc.
Mentionam ca unii autori considera aceasta concluzie ca insusi enuntul principiului al III-lea. Exista mai multe metode de a demonstra aceasta consecinta. Aici prezentam una dintre ele. Astfel, pentru a sugera imposibilitatea atingerii temperaturii de 0 K, sa consideram urmatorul proces tipic, folosit pentru coborarea treptata a temperaturii unui sistem.
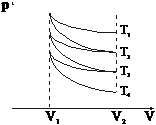
Figura 9
Fie o cantitate de gaz perfect, care initial se afla intr-o stare cu volumul V2 si temperatura T1 (Figura 9). Comprimam gazul intai izoterm pana la volumul V1 si apoi il destindem adiabatic pana la volumul initial V2. Gazul a capatat temperatura T2 < T1. Aplicand ecuatia lui Poisson
![]() , (78)
, (78)
rezulta
![]() , (79)
, (79)
unde
![]() . (80)
. (80)
Intre T1 si T2 se poate scrie relatia
T1-T2 = T1-T1A = T1(1-A) . (81)
Repetand succesiv procesele de comprimare izoterma si de destindere adiabatica se poate scrie
T1-T2=T1(1-A)
T2-T3=T2(1-A) (82)
. . . . . . . . . . .
unde
T3 < T2 < T1 . (83)
Rezulta imediat ca
T1-T2 > T2-T3 >. . . . . > Tn-Tn+1 . (84)
Apare clar ca fiecare pas facut spre atingerea temperaturii de 0K este din ce in ce mai mic, incat este imposibil ca printr-un numar finit de procase sa fie atinsa aceasta temperatura.
Deci, o alta formulare a principiului III poate fi: Este imposibil ca printr-un anumit procedeu, oricat de idealizat ar fi, sa se reduca tenperatura unui sistem la zero absolut printr-un numar finit de operatii
Exista o serie de substante (aliaje, unii compusi organici, corpurile amorfe) a caror entropii, pentru T 0, nu tinde la zero ci la o valoare pozitiva finita. Se considera ca aceste substante nu sunt in echilibru la T=0K si deci nu este contrazis postulatul Nernst-Planck (principiul III).
Datorita aplicabilitatii la un numar restrans de sisteme, se considera uneori ca acest principiu nu face parte dintre principiile termodinamicii, dandu-i-se denumirea de teorema lui Nernst, sau postulatul lui Planck.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Esee pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||