Hidrologie
Apa potabila si apa industriala
APA
POTABILA SI APA INDUSTRIALA
Sursele de apa potabila
sau industriala sunt apele curgatoare, lacurile si apele
freatice. Aceste ape contin atat substante solubile (anorganice
si organice) cat si suspensii. Continutul de suspensii admis
pentru apele reziduale, care pot fi evacuate in rauri, este de 30 mg/L.
1. Determinarea
continutului de suspensii
Mod de lucru
se filtreaza un volum V (100 250 mL)
de apa printr-un creuzet filtrant.
dupa filtrare, creuzetul este uscat in
etuva la 105 0C, pana ce masa acestuia devine constanta.
Calcul
Continutul
de suspensii (Dm) este dat de diferenta intre masa creuzetului dupa uscare in
etuva (m) la pondere constanta si masa creuzetului inainte de
filtrare (m0).
Dm = m m0
Pentru un litru de apa:
Continutul de suspensii = 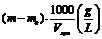
Rezultatele se prezinta sub forma de tabel:
|
Nr. proba
apa
|
Vapa
(mL)
|
m (g)
|
m0
(g)
|
Continut
suspensii (g/L)
|
|
I
|
|
|
|
|
|
II
|
|
|
|
|
2. Determinarea CO2 din apa
Bioxidul
de carbon se
gaseste in apa sub forma de carbonati (complet legat),
bicarbonati (semilegat) si mai rar sub forma de CO2
liber care, in cantitate mare poate produce coroziunea conductelor.
2. 1. Determinarea CO2
liber din apa
Principiul metodei de determinare a CO2 liber din
apa consta in transformarea acestuia in bicarbonat, utilizand o
solutie de NaOH, excesul de NaOH titrandu-se apoi cu solutie de HCl,
in prezenta fenolftaleinei:
CO2 + NaOH NaHCO3
Modul de lucru
Analiza preliminara
se masoara 5 mL apa de analizat si se
introduc intr-o capsula de portelan;
se adauga 2 picaturi de solutie de
fenolftaleina:
daca apare o coloratie roz, in apa nu este
prezent CO2 liber;
daca nu apare coloratia roz atunci se
procedeaza astfel:
se masoara 100 mL apa de analizat intr-un
flacon Erlemayer cu dop rodat peste care se adauga cateva picaturi de
solutie de fenolftaleina;
se titreaza
cu solutie de NaOH 0,05 N pana la aparitia culorii roz,
persistente cateva minute;
Analiza
propriu-zisa
intr-un flacon Erlemayer cu dop rodat se introduce cantitatea
de NaOH utilizata la analiza preliminara si un exces de 1-2 mL;
se adauga o cantitate egala de solutie de
tartrat de sodiu si potasiu 50%;
se completeaza pana la 10 mL cu apa distilata
fiarta si racita;
se introduc, in acelasi flacon Erlenmayer, 100 mL
apa de analizat si se astupa flaconul;
se agita si se adauga 2 picaturi de
solutie de fenolftaleina;
se titreaza cu solutie de HCl 0,05N pana
la decolorarea solutiei.
Calcul
mg CO2 liber/Lapa analizata = 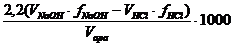
Obs. 2,2 reprezinta echivalentul in CO2
corespunzator unui mL NaOH 0.05 N.
2. 2. Determinarea CO2
legat din apa
Principiul metodei de determinare a CO2 legat din
apa consta in neutralizarea carbonatilor prezenti in
apa prin titrare cu solutie de HCl, in prezenta fenolftaleinei.
Modul de lucru
intr-un flacon Erlemayer se introduc 100 mL apa de
analizat si 2 picaturi de solutie de fenolftaleina;
se titreaza cu solutie de HCl 0,05 N pana
la virarea indicatorului la coloratie roz.
Calcul
mg CO2 legat/Lapa analizata = 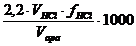
2. 3. Determinarea CO2
semilegat din apa
Principiul metodei de determinare a CO2 legat din
apa consta in neutralizarea bicarbonatilor prezenti in
apa prin titrare cu solutie de HCl, in prezenta metiloranjului.
Modul de lucru
intr-un flacon Erlemayer se introduc 100 mL apa de
analizat si 2 picaturi de solutie de metiloranj;
se titreaza cu solutie de HCl 0,1 N pana
la virarea indicatorului la coloratie galben-portocaliu.
Calcul
mg CO2 semilegat/Lapa analizata = 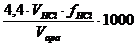
Obs. 4,4 reprezinta echivalentul in CO2
corespunzator unui mL de HCl 0,1 N.
3. Determinarea duritatii apei prin metoda
complexonometrica
Duritatea totala a apei este determinata de
totalitatea compusilor de calciu, de magneziu si de fier divalent
dizolvati in apa.
Principiul metodei de determinare a duritatii totale
a apei prin metoda complexonometrica se bazeaza pe proprietatea
complexonului III, simbolizat Na2H2Y, de a forma cu ionii
de calciu (magneziu, fier II) din apa compusi coordinativi stabili,
numiti chelati.
Complexonul III este sarea bisodica a acidului etilendiaminotetraacetic (EDTA), care formeaza cu
ionii de calciu compusi stabili de forma:
 CH2COOH CH2COOH

H2C N
 
2Na+ + 2H+
|
Ca2+
CH2COONa

 CH2COONa
CH2COONa
H2C N

CH2COOH
Modul de lucru
se masoara intr-un flacon Erlenmeyer 25 mL
apa de analizat;
se adauga 1-2 mL solutie tampon (NH4Cl
+ NH4OH), masurata cu pipeta; solutia tampon are
rolul de a consuma H+, care
rezulta in reactia de titrare;
se adauga o cantitate mica (un varf de
spatula) de indicator (eriocrom negru T), solutia colorandu-se in violet;
se titreaza cu solutie de complexon III 0,05 M
cu titru cunoscut pana la culoarea
albastru net;
se citeste volumul solutiei de complexon III
utilizat pentru titrare,  .
.
Calcule
Din
ecuatia reactiei se constata ca unui mol de complexon III
ii corespunde un mol de ioni Ca2+ (Mg2+ sau Fe2+)
sau un mol de CaO/CaCO3
Se
calculeaza apoi continutul de CaO si continutul de CaCO3
din 100 mL de apa dura
Se
exprima acest continut in mg, respectiv in grade de duritate:
DT (grade germane de duritate) = 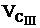
4. Dedurizarea apei prin procedeul var-soda
Procedeul chimic de dedurizare var-soda foloseste ca
reactivi Ca(OH)2 (laptele de var), NaOH (soda caustica) si
Na2CO3 (soda de rufe).
Ca(OH)2 si NaOH precipita bicarbonatii, deci
inlatura duritatea temporara si neutralizeaza CO2.
Na2CO3 precipita sarurile care dau duritatea
permanenta.
Ca(HCO3)2 + Ca(OH)2 = 2 CaCO3
+ 2H2O
Mg(HCO3)2 + 4NaOH = Mg(OH)2 + 2Na2CO3
+ 2H2O
Ca2+ + Na2CO3 = CaCO3 +
2Na+
Mg2+ + Na2CO3 + Ca(OH)2 =
Mg(OH)2 + CaCO3 + 2Na+
Mod de lucru
100 mL
apa de analizat se introduc intr-un pahar Berzelius;
se
incalzeste putin pentru indepartarea CO2 si
apoi se adauga cu biureta (pipeta) 20 mL amestec alcalin (solutie
NaOH 0,1N si Na2CO3 0,1N in raport 1:1);
se
fierbe amestecul 10 minute, apoi se raceste si se filtreaza
pe un filtru cutat intr-un balon cotat de 200/250 mL;
se
spala cantitativ paharul si filtrul cu apa distilata si se
aduce la semn;
10 mL
din aceasta solutie se introduc intr-un flacon Erlenmayer, se
adauga 2-3 picaturi metiloranj si se titreaza cu
solutie de HCl 0,1N de titru cunoscut pana la virajul indicatorului de la
galben la portocaliu.
Calcul
Daca
la titrarea excesului de amestec alcalin a 100 mL solutie de analizat s-au folosit V mL HCl, atunci
diferenta (20 V) reprezinta echivalentul in mL de HCl
corespunzator cantitatii de amestec alcalin care s-a folosit
pentru precipitarea tuturor sarurilor de calciu si magneziu.
Daca HCl nu este de normalitate exacta (0,1N),
se introduce factorul de normalitate al solutiei de HCl utilizata:
D = 20 f 2,5 V fHCl
Duritatea totala (DT) se exprima in grade
de duritate germane (0G) si pentru 1mL solutie de HCl 0,1N
corespund 2,80 G:
DT = 2,8(20 2,5 V fHCl)
Se compara rezultatele obtinute, pentru
aceeasi proba de apa, inainte de dedurizare si dupa
dedurizarea prin procedeul var-soda.
5. Dedurizarea apei cu ajutorul schimbatorilor
de ioni
Schimbatorii de
ioni sunt substante macromoleculare naturale (zeoliti),
artificiale (permutiti) sau sintetice (rasini) care au
proprietatea de schimba proprii ioni cu ionii continuti in
solutiile cu care vin in contact dar in care nu se dizolva.
Schimbatorii de ioni organici sintetici sunt rasini
fenol-formaldehidice sau polistirenice-sulfonate care poarta denumirea de cationiti sau anioniti.
Cationitii se pot reprezenta prin formula
generala RH, schimbul ionic realizandu-se prin substituirea ionului H+,
deci rezulta acizi liberi care aciduleaza apa:
2 RH + Ca2+ = CaR2 + 2 H+
2 RH + Mg2+ = MgR2 + 2 H+
Regenerarea cationitului
se poate face cu o solutie de H2SO4 sau cu o
solutie de NaCl. De regula, apa acidulata rezultata este
apoi neutralizata cu ajutorul anionitilor, care se obtin prin
policondensarea aminelor cu formaldehida.
In industrie, pentru
dedurizarea si demineralizarea apei, apa este trecuta prin doua
coloane cu schimbatori de ioni, una de cationit si una de anionit, care
functioneaza in paralel cu alte doua coloane in care se face
regenerarea schimbatorilor de ioni uzati.
Mod de lucru
se
trec 10 mL apa de analizat printr-o coloana cu cationit;
5 mL
din efluentul cules se pipeteaza intr-un flacon Erlenmayer;
se
determina duritatea totala a probei de apa dedurizata
utilizand metoda complexonometrica.
Se
compara rezultatele obtinute, pentru aceeasi proba de
apa, inainte de dedurizare si dupa dedurizarea cu ajutorul
schimbatorilor de ioni.
Rezultatele
se trec intr-un tabel.
COMBUSTIBILI
SOLIZI
Carbunii contin substante organice (constitue
asa-numitul carbune pur), substante minerale de origine
singenetica (provenite din insusi tesutul plantelor) sau
epigenetica (aduse de vanturi si apa, in timpul formarii
sau dupa formarea carbunilor) care prin ardere trec in cenusa
si apa.
Compozitia chimica a
unui carbune se determina prin:
analiza imediata care consta in
determinarea substantelor organice (cocs si substante volatile),
cenusei si umiditatii.
analiza elementara care consta in
determinarea continutului procentual din fiecare element chimic prezent in
carbune.
1. Determinarea
continutului de apa din carbune
Dupa cantitatea de apa
continuta, umiditatea unui carbune este de doua tipuri:
umiditatea
obisnuita sau higroscopica care este rezultatul
echilibrului dintre umiditatea carbunelui si umiditatea atmosferei.
umiditatea
neobisnuita sau libera datorata apei ploilor,
zapezilor sau apei ce ramane dupa eventuala spalare a
carbunilor.
Determinarea umiditatii higroscopice se poate
realiza in doua moduri:
prin
uscare in etuva
prin
distilare cu xilen.
1.1. Determinarea
umiditatii prin uscarea carbunelui in etuva
Mod de lucru
se
cantaresc 2g (m) carbune fin
pulverizat intr-o fiola de cantarire in prealabil uscata in
etuva (105-110 0C) si racita in exicator (20
min);
se
introduce fiola cu carbunele de analizat in etuva si se
lasa timp de 1 h la 105-110 0C, dupa care se pune capacul
fiolei si se aduce in exicator; dupa aprox 20 minute, fiola cu
carbunele de analizat se cantareste (fiola ramanand
acoperita).
se
introduce din nou fiola cu carbunele de analizat in etuva, se scoate
capacul si se lasa la uscare inca o jumatate de ora, dupa care
se cantareste din nou. Se repeta aceasta operatie pana
la masa constanta (m1).
Calcule
% umiditate = 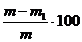
m1 masa carbunelui dupa uscare, in grame
m - masa carbunelui luat in lucru, in grame.
2. Determinarea cenusei
din carbune
Cenusa ramane dupa arderea carbunelui in aer
si provine din substantele minerale care nu se volatilizeaza in
timpul arderii.
Mod de lucru
se
calcineaza 2g de carbune astfel: la inceput se incalzeste
cu o flacara mica avand grija ca, din timp in timp, sa se
amestece continutul creuzetului cu un fir gros de platina; pe
masura ce calcinarea inainteaza, se mareste flacara pana
la rosu deschis (800 0C).
daca in reziduul calcinat se observa
puncte negre sau granule mici, inseamna ca arderea nu este
completa si pentru a o desavarsi, dupa racire, se
adauga putina apa si alcool; in felul acesta granulele
plutesc deasupra lichidului; culoarea cenusei da indicatii
asupra compozitiei acesteia: o culoare brun-roscata indica
prezenta sulfului, iar daca este alba inseamna ca sunt prezente
saruri alcaline;
dupa racire in exicator, se
cantareste creuzetul cu cenusa.
Calcul
Continutul
procentual de cenusa si de substante combustibile din
carbunele de analizat se calculeaza cu ajutorul relatiilor:
%
cenusa = 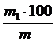
m masa carbunelui luat in lucru, in grame
m1 masa cenusei obtinute, in grame
Diferenta: 100 (apa + cenusa) da procentul de
substante combustibile:
%
subst. combustibile = 100
(umiditate[%] + cenusa[%] )
3. Determinarea cocsului si a substantelor
volatile
Mod de lucru
intr-un creuzet cu capac gaurit se
cantaresc 2g carbune; creuzetul cu capac se aseaza pe triunghiul
cu samota de pe un trepied inalt, astfel incat intre creuzet si
flacara becului sa ramana o distanta de 3 cm;
se incalzeste 20 min pana nu se
mai degaja gaze combustibile intre capac si creuzet;
pentru a nu se arde si cocsul, se
lucreaza in atmosfera reducatoare de metan; se stinge flacara,
iar creuzetul acoperit se lasa sa se raceasca intr-un
exicator, dupa care se cantareste.
Reziduul din creuzet este format din carbune fix si cenusa
acida (cocs). Pierderea din greutatea initiala a creuzetului,
reprezinta substantele volatile; diferenta intre acestea si
apa determinata anterior, reprezintand carbunele volatil propriu-zis.
Calcul
Continutul
procentual de cocs si de substante volatile din carbunele analizat se
determina cu ajutorul relatiilor:
% cocs = 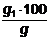
g1
grame de cocs obtinut
g grame de
carbune luat in lucru
% substante volatile = 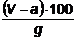
a cantitatea de
apa din g grame de carbune
V grame pierderi
la incalzirea a g grame carbune
% substante volatile totale = 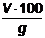
COMBUSTIBILI
LICHIZI
1. Determinarea viscozitatii
conventionale Engler
Viscozitatea reprezinta proprietatea fluidelor de a
opune rezistenta la deplasarea a doua straturi adiacente de
fluid. Viscozitatea produselor (combustibili lichizi, uleiuri etc.) este
determinata de natura hidrocarburilor componente si de masa
moleculara a acestora. In aceeasi serie omoloaga de hidrocarburi,
viscozitatea creste cu cresterea maselor moleculare ale acestora. In
cazul hidrocarburilor cu aceeasi masa moleculara, viscozitatea
creste in ordinea: hidrocarburi aromatice < cicloalcani < n-alcani
< izoalcani. Viscozitatea produselor se micsoreaza cu
cresterea temperaturii. Viscozitatea conventionala se
exprima, in tehnica, in grade Engler.
Gradele Engler de viscozitate se calculeaza
raportand timpul de scurgere a 200 mL de produs, la o anumita
temperatura, la timpul de scurgere a 200 mL de apa distilata la
20 0C.
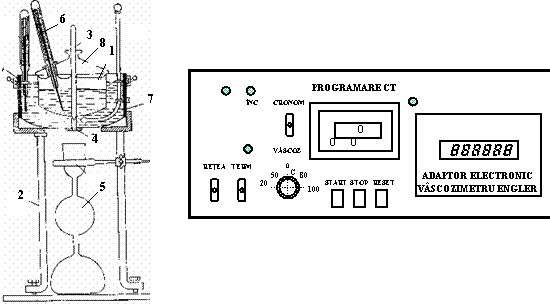
Pentru determinarea
viscozitatii conventionale se utilizeaza viscozimetrul
Engler. Aparatul este compus dintr-un rezervor (1), acoperit cu un capac (8), o
tija (3) care inchide orificiul de scurgere (4) al rezervorului si un
termometru (6). Rezervorul se introduce intr-o baie de apa (7)
asezata pe trepiedul (2). Pentru masurarea volumelor se
utilizeaza balonul Engler (5). Vascozimetrul se poate lega la un bloc de
comanda a incalzirii, bloc prevazut si cu un cronometru.
Mod de lucru
se
curata si se usuca rezervorul viscozimetrului;
se
inchide cu tija (3) orificiul (4) al rezervorului;
se
introduce fluidul in rezervor, putin deasupra reperelor de nivel;
se
face legatura viscozimetrului cu blocul de comanda si a blocului
de comanda la reteaua de tensiune 220 V in curent alternativ si
la 50 Hz;
se
aseaza balonul Engler (5) sub orificiul de scurgere (4);
Nota: Timpul de scurgere a fluidului se poate
masura:
a) cu cronometrul electronic, pornit si oprit cu butoanele START
si STOP si cu pozitia comutatorului rotativ pe CRONOMETRU;
b) cu cronometrul electronic care porneste in momentul
ridicarii tijei obturatoare si se opreste in momentul atingerii
cotei de 200 ml in balonul Engler, prin apasarea butonului STOP si cu
pozitia comutatorului rotativ pe CRONOMETRU;
Cand comutatorul rotativ se aseaza pe pozitia
VISCOZIMETRU, se programeaza CT (constanta de apa a aparatului), iar pe
blocul de comanda se va afisa direct vascozitatea in grade Engler.
Constanta de apa a aparatului reprezinta timpul de
scurgere, in secunde, a 200 mL apa distilata la temperatura de 20 0C.
Se ridica tija obturatoare (3) lasandu-se
fluidul sa se scurga in balonul Engler si se masoara
timpul de scurgere a fluidului, in secunde, sau se masoara direct
viscozitatea.
Atentie: pentru a evita spumarea fluidului in timpul
scurgerii, firul de fluid trebuie sa se prelinga pe peretii
balonului Engler!
Interpretarea rezultatelor
Pentru
a calcula viscozitatea in grade Engler se va raporta timpul de scurgere, in
secunde, a 200 mL produs de analizat la timpul de scurgere a 200 mL apa
distilata, la 20 0C. Acest timp de scurgere este denumit constanta de apa a viscozimetrului si
este inscris pe rezervorul aparatului (ta).
Se
calculeaza valoarea exacta a viscozitatii
conventionale Engler notand aprecieri asupra exactitatii
determinarilor experimentale.
Rezultatele se vor prezenta sub forma de tabel:
|
Temperatura
C
|
ta
(s)
|
tp
(s)
|
Viscozitatea
(grade Engler)
|
|
|
|
|
|
|
|
|
2. Determinarea punctului de
inflamabilitate
Punctul de inflamabilitate reprezinta temperatura minima la care
vaporii unui produs petrolier se aprind in contact cu o flacara.
Cunoasterea punctului de inflamabilitate serveste la alegerea
conditiilor de securitate a combustibilului (comportarea in timpul
transportului, in timpul utilizarii, in timpul depozitarii etc.).
Pentru determinarea punctului de inflamabilitate se utilizeaza diverse aparate:
aparatul Abel-Pensky, aparatul Pensky-Martens si aparatul Marcusson.
Mod de lucru:
se introduce proba de analizat in rezervorul aparatului
pana la cota din interior;
se
acopera cu capacul;
se
fixeaza termometrul in locasul sau;
se
incalzeste rezervorul cu ajutorul unei rezistente electrice
astfel incat temperatura sa nu creasca cu mai mult de 5-8 0C
pe minut. In timpul incalzirii se agita produsul din cand in cind;
din
timp in timp se aprinde flacara dispozitivului de aprindere si se
regleaza la o lungime de 3-4 mm;
se
incearca aprinderea amestecului de vapori ai produsului aer prin
coborarea dispozitivului de aprindere in spatiul de vapori; in acest timp
se intrerupe agitarea.
Temperatura la care deasupra suprafetei produsului se
observa o flacara albastra este considerata punctul de
inflamabilitate (t p).
Calcul
Punctul
de inflamabilitate se exprima la presiune normala (760 mmHg) cu
relatia:
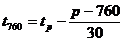
in care tp
este punctul de inflamabilitate determinat la presiunea p si este exprimat
in grade Celsius.
Rezultatele se vor
prezenta sub forma de tabel:
|
P (mmHg)
|
tp (0
C)
|
t760 (0
C)
|
|
|
|
|
|
|
3. Determinarea cifrei cetanice si calcularea indicelui
Diesel la motorina
Determinarea calitatilor de autoaprindere ale unui
combustibil prin determinarea cifrei cetanice este laborioasa. De aceea
s-a cautat sa se gaseasca o metoda rapida de
laborator prin care sa se aprecieze cifra cetanica in functie de acele
proprietati fizice ale carburantilor care se pot masura repede
si precis.
Cifra cetanica (C.C.)
reprezinta continutul in procente volumice de n-cetan, dintr-un
amestec etalon de n-cetan si α-metilnaftalina care se
comporta la autoaprindere ca si motorina testata in
conditii identice de incercare. Cu cat cifra cetanica a unei motorine
este mai mare, continutul in hidrocarburi aromatice este mai mic si
densitatea motorinei este mai mica.
Experimental, cifra cetanica se determina cu ajutorul
punctului de anilina. Punctul de anilina reprezinta
temperatura minima la care anilina (C6H5NH2)
se dizolva complet intr-o anumita cantitate de combustibil
(motorina). Cu cat continutul de hidrocarburi aromatice este mai mic, cu
atat temperatura de dizolvare a anilinei este mai mare. Punctul de anilina
caracterizeaza deci continutul de hidrocarburi aromatice din
carburant.
Astfel, punctul de anilina
al cetanului (care are cifra cetanica egala cu 100 si formula C16H34)
este de +94,40C, iar al a-metil naftalinei (care are cifra cetanica
0) este 17,80C. Pe de alta parte, cresterea
continutului de alcani si scaderea continutului de
hidrocarburi aromatice micsoreaza densitatea relativa a
carburantilor.
Densitatea relativa constitue un al doilea indice de
comparatie. Cu ajutorul acestor doi indici de comparatie s-a stabilit
ca si criteriu de apreciere pentru sensibilitatea la autoaprindere a
combustibilului, indicele Diesel. Cu cat acesta are valoare mai mare,
comportarea la autoaprindere a motorinei este mai buna. Pentru motorinele
romanesti, indicele Diesel este cuprins intre 51 si 76.
Mod de lucru
se
determina densitatea motorinei cu ajutorul unui densimetru adecvat;
se
introduc intr-o eprubeta 5mL motorina si 5mL anilina, se
acopera eprubeta cu un dop prin care trece un termometru, apoi se
agita amestecul obtinandu-se o emulsie;
se
aseaza eprubeta intr-un vas cu apa si se
incalzeste pana cand emulsia devine clara, moment in care
se citeste temperatura (punctul de anilina);
cu
ajutorul monogramei se determina, in functie de valoarea punctului de
anilina si a densitatii motorinei,determinata la
temperatura de 20 0C, indicele Diesel (linia din mijloc).
cu
ajutorul curbei se determina, pentru un anumit indice Diesel, cifra
cetanica corespunzatoare. Cifra cetanica variaza intre 35 si 55.
Indicele Diesel se calculeaza din relatia:
I.D. = 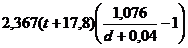
unde: d = densitatea motorinei
d ,
,
t = punctul de
anilina (0C).
PRODUSE SODICE SI
CLOROSODICE
Soda calcinata (Na2CO3) sau carbonatul de sodiu
anhidru este un praf alb amorf si opac cu greutatea specifica
0,5kg/dm3, solubil in apa. Din solutiile apoase,
cristalizeaza Na2CO3·10H2O ( soda
cristalizata). Solutiile apoase de soda prezinta caracter
puternic alcalin:
Na2CO3
+ H2O = 2(Na+ + OH)
+ H2O + CO2
Principalele impuritati din soda tehnica aflata in
comert sunt: NaCl, NH4HCO3, Na2SO4,
saruri de fier, CaCO3, MgCO3 si apa.
1. Determinarea alcalinitatii totale
Alcalinitatea totala se determina prin
titrarea probei de soda cu o solutie acida.
Mod de lucru
se
introduc aproximativ 0,1g soda calcinata intr-un flacon Erlenmayer de
200 mL si se dizolva in 25 mL apa distilata;
se adauga 3 picaturi de fenolftaleina
si se titreaza cu o solutie de HCl 1N pana la coloratie
roz.
Calcul
Alcalinitatea totala se raporteaza la Na2CO3
si se exprima in procente conform expresiei:
% Na2CO3 = 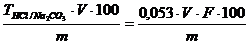
unde: V volumul solutiei de HCl 1N folosit la titrare
F factorul solutiei
de HCl 1N
m cantitatea de soda calcinata.
2. Determinarea clorurii de sodiu
Mod de lucru
se
cantaresc aproximativ 0,1 g soda si se dizolva in 25 mL apa distilata intr-un flacon
Erlenmayer de 200 mL;
se adauga in solutia de analizat un volum V1
( 1-2 mL) de AgNO3 0,1N si 2 mL solutie saturata de
alaun de fier si amoniu;
se
titreaza cu solutie de tiocianat de amoniu 0,1N pana la
coloratie cafenie deschisa.
Calcul
Continutul de clorura de sodiu (in procente) se
calculeaza cu ajutorul formulei:
% NaCl = 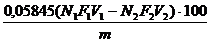
unde: 0,05845 echivalentul chimic al NaCl, in mg
V1 volumul
adaugat din solutia de AgNO3, in mL
N1
normalitatea solutiei de AgNO3
F1 factorul
de corectie al solutiei de AgNO3
V2 volumul
cosumat din solutia de tiocianat de amoniu, in mL
N2
normalitatea solutiei de tiocianat de amoniu
F2 factorul
de corectie al solutiei de tiocianat de amoniu
m masa probei de
soda luata in lucru, in g.
INGRASAMINTE
CHIMICE CU AZOT
Ingrasamintele
chimice sunt substante organice sau anorganice care contin
elementele nutritive (N, P K) necesare dezvoltarii plantelor.
Ingrasamintele
cu azot contin azot
sub forma amoniacala, (NH4)2SO4,
nitrica (NaNO3), amoniacal-nitrica, NH4NO3,
sau sub forma amidica (ureea, NH2-CO- NH2).
Analiza ingrasamintelor chimice cu azot presupune
urmatoarele determinari:
determinarea
rezidului de calcinare
determinarea
substantelor insolubile in apa
determinarea
continutului de azot amoniacal.
Determinarea rezidului de calcinare
intr-un
creuzet cu masa constanta se cantareste 1g
ingrasamant chimic;
se
volatilizeaza substanta prin incalzire la flacara becului de
gaz;
se
calcineaza puternic;
se
raceste in exsicator si apoi se cantareste.
Calcul
Reziduu de calcinare % = 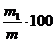
m1 reziduu
cantarit, in grame
m
ingrasamantul luat pentru analiza, in grame.
2. Determinarea substantelor insolubile
se
dizolva in apa 2g ingrasamant chimic;
se
filtreaza solutia printr-un filtru cantitativ uscat la 1050C;
dupa
filtrare si spalare cu apa, filtrul cu substanta de
analizat se usuca in etuva la 1050C;
dupa
uscare si racire, filtrul cu substanta se cantareste.
Calcul
Substante insolubile in apa % = 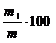
m1 masa substantelor insolubile obtinute, in
grame
m masa ingrasamantului chimic luat in analiza, in
grame.
3. Determinarea azotului amoniacal
Azotul amoniacal se determina prin metode titrimetrice care sunt
rapide si comode. Cele mai utilizate dintre acestea au la baza
urmatoarele principii:
punerea in libertate a amoniacului din sarea de amoniu cu
ajutorul unei baze tari, urmata de distilarea si titrarea amoniacului cu
acid mineral tare.
masurarea
aciditatii care apare de pe urma reactiei dintre ionii de amoniu si
aldehida formica, folosind in acest scop o solutie titrata de
baza tare. Acest principiu se
aplica in laborator pentru determinarea continutului de azot
amoniacal din ingrasamintele chimice, de exemplu NH4NO3.
In acest scop, se trateaza o solutie neutra de
ingrasamant chimic cu o solutie de formaldehida. Din
reactie se formeazaa hexametilen tetramina, eliminandu-se o cantitate
echivalenta de acid azotic, care se titreaza cu o solutie de
NaOH 0,1n:
4NH4NO3
+ 6HCHO C6H12N4 + 6H2O + 4HNO3
Mod de lucru
1g de
ingrasamant se dizolva in apa si se aduce la semn
intr-un balon cotat de 100-250 mL;
se iau
25mL solutie din balonul cotat si se neutralizeaza intr-un
flacon Erlenmayer cu cateva picaturi de NaOH 0,1N, in prezenta unei
solutii de fenolftaleina;
se
adauga 5 mL solutie de formol, se agita 3 minute, timp in care
se formeaza hexametilentetramina;
se
titreaza la cald cu solutie de NaOH 0,1N in prezenta
fenolftaleinei.
Calcul
Se calculeaza continutul
procentual de azot amoniacal, utilizand legea ecivalentilor chimici, pe
ecuatia de reactie.
 |

|
Hidrologie
|
|
|
Proiecte pe aceeasi tema
|
|
| Ramai informat |
Informatia de care ai nevoie
Acces nelimitat la mii de documente. Online e mai simplu. |
Contribuie si tu!
Adauga online documentul tau.
|
|
|
| |

![]()
![]()
![]()
![]()
![]()
 CH2COOH
CH2COOH![]()
![]()
![]()