
| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Hemoglobina - structura chimica si sinteza hemoglobinei, rolurile hemoglobinei |
Hemoglobina - structura chimica si sinteza hemoglobinei, rolurile hemoglobinei
hemoglobina
Hemoglobina (Hb) este pigmentul transportor de oxigen in eritrocitele vertebratelor, fiind elementul esential pentru principala functie fiziologica a acestora, functia respiratorie. Reprezinta 95% din proteinele solubile ale eritrocitului si 35% din greutatea acestuia, astfel incat se poate spune ca eritrocitul este format doar dintr-o membrana, care protejeaza o solutie concentrata de Hb. Localizarea in eritrocite prezinta doua avantaje:
- un transport eficient al O2 fara cresterea presiunii osmotice a plasmei asa cum s-ar intampla daca Hb ar fi o simpla proteina plasmatica;
- in eritrocite exista un mecanism de reducere a Fe3+ din methemoglobina la Fe2+, acest mecanism fiind reprezentat de NADH-methemoglobin reductaza.
Valori normale: ♂ 13 - 17g/dl; ♀ 13 - 16g/dl. Un barbat de 70 Kg are aprox. 900g de Hb. Aceste valori corespund la o :
- valoare medie pe hematie - HEM = 29 g;
- valoare medie/100 ml masa eritrocitara - CHEM=34%
Structura chimica si sinteza HEMOGLOBINEI
Hb este o hemoproteina, cu GM=64000 daltoni. Molecula de Hb are forma globulara si este formata dintr-o componenta proteica-globina (96% din molecula) si o metaloporfirina-hemul, care contine Fe2+ (feros) de culoare rosie. Componentele necesare sintezei de Hb sunt: globina, protoporfirina IX, fierul si 2,3 difosfogliceratul (2,3-DPG).
Hemul. Din punct de vedere chimic este format dintr-un atom de Fe2+ fixat in centrul unui nucleu tetrapirolic, acelasi ca pentru clorofila si vit. B12.Patrulaterul, in centrul caruia se afla Fe2+ are in unghiuri cei 4 atomi de N ai nucleilor pirolici (figura 5.1.). Generarea hemului necesita, ca pas esential, formarea protoporfirinei IX, ultimul compus al unui lung sir de reactii enzimatice, care se desfasoara alternativ in mitocondriile eritroblastilor
nucleati si in citoplasma celulara. Sinteza incepe in stadiul de eritroblast bazofil, este maxima in eritroblastii policromatofili si oxifili, foarte redusa in reticulocite si absenta in eritrocitul matur, care nu mai are mitocondrii si isi pierde o parte din echipamentul enzimatic
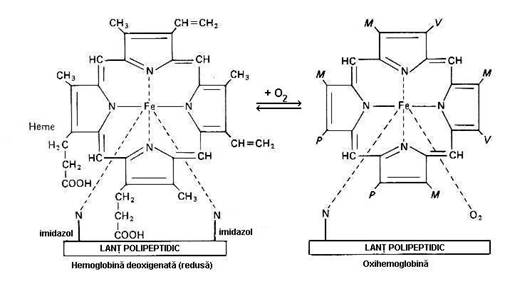
Figura 5.1. Formele spatiale ale hemoglobinei. Abrevierile M, V si P reprezinta radicalii moleculei din stanga (dupa Ganong, F. W, 1993).
Hemul format este expulzat din mitocondrii in citopasma, unde 4 grupari hem se leaga de 4 lanturi de globina pentru a forma molecula de Hb.
Structura hemului este constanta in diversele tipuri de Hb, necunoscandu-se variante structurale conditionate genetic ca la globina.
Datorita proprietatii sale de a forma legaturi reversibile cu O2, hemul reprezinta componenta fiziologic activa din molecula de Hb.
Hemul se mai gaseste si in structura: mioglobinei-pigmentul purtator de O2 din muschii rosii si in enzimele lantului respirator-citocromul c.
Sinteza hemului este autocontrolata prin feed-back negativ (cresterea concentratiei hemului determina depresia enzimei ALA-sintetaza si productia de hem inceteaza.
Sinteza defectuasa a hemului se exprima sub forma de porfirii.
Porfiriile sunt maladii datorate deficientei ereditare, congenitale sau dobandite a enzimelor care intervin in sinteza hemului si se caracterizeaza prin acumularea de precursori porfirinici sau unul sau mai multi porfirinogeni in maduva hematogena (porfiria eritropoietica) sau in ficat (porfiria hepatica), consecinta fiind scaderea productiei de Hb. Simptomul dominant este reprezentat de leziunile cutanate fotosensibile, la care se pot adauga semne de anemie sau suferinta hepatica
Globina este o proteina cu caracter bazic din subclasa histonelor. Se sintetizeaza la nivel ribozomal, sinteza fiind controlata de acizii nucleici pe caile obisnuite ale sintezei proteinelor.
Globina este diferita ca structura de la un tip de Hb la alta, fiind componenta care imprima specificitatea diverselor Hb cunoscute. Diferenta de structura nu consta in numarul lanturilor, toate globinele sunt tetrameri (au 4 lanturi polipeptidice, identice doua cate doua), ci in numarul si succesiunea aminoacizilor, adica in structura primara a moleculei de globina. Lanturile polipeptidice sunt desemnate prin literele grecesti α, β, γ, δ, ε, si ζ, principalele deosebiri dintre aceste lanturi fiind redate in tabelul 5.1.
|
Denumirea greceasca |
Numele grecesc |
Numarul de aminoacizi |
Comentarii |
|
||||
|
α |
Alfa |
141 |
|
|
||||
|
β |
Beta |
146 |
|
|
||||
|
γ |
Gamma |
146 |
Difera de lanturile β prin 39 de aminoacizi |
|
||||
|
δ |
Delta |
146 |
Difera de lanturile β prin 10 aminoacizi |
|
||||
|
ε |
Epsilon |
146 |
Numai in viata embrionara (primele 3 luni) |
|
||||
|
ζ |
Zeta |
146 |
Numai in viata embrionara (primele 3 luni) |
|
||||
|
|
|
|
|
||||
Tabelul nr. 5.1. Lanturile polipeptidice prezente in diferitele tipuri de Hb.
Fiecare molecula de Hb are 2 perechi de polipeptide neidentice (lanturi):
- 2 lanturi a caror sinteza este dublu codificata de 2 gene identice aflate pe cromozomul 16, fiecare lant avand 141 de aminoacizi;
- 2 lanturi non- care pot fi β, γ, δ, ε, si ζ a caror sinteza este codificata de gene aflate pe cromozomul 11; fiecare din aceste lanturi poseda 146 de aminoacizi, dar in succesiune diferita.
Dupa sinteza la nivel ribozomal, lanturile libere sunt incorporate in molecula completa de Hb rapid si spontan, nefiind necesara prezenta altor factori. Fiecare subunitate polipeptidica este legata de un hem, deci o molecula de Hb contine 4 grupari hem, fiecare grupare hem avand in centru un atom de Fe2+ (in total 4 atomi de Fe2+).
Structura primara a Hb-reprezinta secventa aminoacizilor in structura fiecarui lant polipeptidic si legarea Fe2+ de histidina acestui lant.
Structura secundara (spiralele lui Pauling si Corey) este reprezentata de configuratia spatiala, helicoidala a fiecarui lant globinic. Pe o lungime de aproximativ 75%, lanturile de aminoacizi au o structura spatiala de tip helicoidal, care alterneaza la anumite intervale cu segmente nehelicoidale, la nivelul carora se produce indoirea si incolacirea catenei.
Structura tertiara este reprezentata de pliurile (buzunarele hemului) care adapostesc gruparile hem ale fiecarui lant globinic.
Structura cuaternara rezulta din aranjarea celor 4 monomeri aflati in molecula de Hb, astfel incat formeaza o structura globulara compacta. Aceasta prezinta in apropierea suprafetei extreme 4 cavitati numite pliurile sau pungile hemului, care adapostesc cate un hem. In lungul axei moleculei de Hb, separand lanturile unul de celalalt se gaseste o cavitate centrala in care se fixeaza 2,3 DPG. Structura tridimensionala a Hb a fost determinata prin analiza cristalografica cu raze X (figura 5.2).
|
Deci, hemul este localizat intr-un pliu (buzunar) hidrofob al fiecarui lant polipeptidic. Ancorarea lui la aceste lanturi se face prin legaturi chimice coordinative cu: histidina (in pozitia 58 si 87) de pe lanturile si cu histidina (in pozitia 63 si 92 de pe lantul ). Inelul imidazolic al histidinei se leaga direct de Fe2+ al hemului, printr-o legatura coordinativa.
Fe din molecula de Hb se leaga hexacoordinativ de:
- cei 4 atomi de N ai nucleului tetrapirolic prin 4 legaturi: 2 covalente (puternice) si 2 coordinative (notate 1-4)
- atomii de N ai unui rest histidinic din lantul polipeptidic, prin 2 legaturi coordinative (legaturile 5-6). Legatura 5 este stabila; se realizeaza direct cu un N histidinic. Legatura 6 este labila si va lega O2 in sangele arterial formand oxiHb, iar in sangele venos va ramane libera .
Hb are 2 configuratii spatiale:
oxihemoglobina - forma oxigenata sau forma relaxata. Fixarea oxigenului se face de catre fierul din hem, in procesul de oxigenare si de reducere, fierul ramanand bivalent. Legarea oxigenului se face la nivelul legaturii care asigura contactul dintre fier si histidina din pozitia 63 a lantului (respectiv 58 pentru lantul ). In timpul oxigenarii, pozitia spatiala a dimerilor si b se schimba: lanturile se departeaza, iar lanturile se apropie micsorand spatiul central al tetramerului, consecinta fiind expulzarea 2,3-DPG (produs intermediar al metabolismului glucidic eritrocitar, rezultat din suntul Rappaport-Luebering). Aceasta forma a Hb manifesta o mare afinitate pentru legarea O2.
deoxihemoglobina - forma redusa, disociata (fara O2) sau tensionata, in a carei cavitate centrala se gaseste 2,3-DPG. Trecerea de la forma redusa la cea oxigenata nu influenteaza valenta fierului, care ramane permanent in stare feroasa - Fe2+. In Hb redusa, legarea fierului de nucleul imidazolic al histidinei se face printr-o legatura de hidrogen, prin intermediul unei molecule de apa. In OxiHb, molecula de apa este indepartata si O2 se fixeaza direct de fier.
Desi locul de legare al 2,3-DPG pe molecula de Hb este diferit de cel al O2, intre cele 2 componente exista o relatie reciproca de excludere. Acumularea de 2,3-DPG in cavitatea centrala scade afinitatea Hb pentru O2, in schimb este favorizata eliberarea O2. Expulzarea 2,3-DPG din molecula de Hb determina cresterea afinitatii acesteia pentru O2, fiind favorizata fixarea lui .
Rolurile hemoglobinei
Hb are trei functii, fiecare dintre ele esentiala pentru viata: transportor de O2 de la plamani la tesuturi, transportor (in mai mica masura) de CO2 de la tesuturi la plamani si functia de tamponare a sangelui pentru a preveni modificarile de pH.
Transportul oxigenului.
Cel mai important rol al Hb, transportul de O2 deriva din proprietatea Hb de a fixa reversibil oxigenul la nivelul capilarelor pulmonare, de a-l vehicula prin sange sub protectia membranei eritrocitare si de a-l ceda cu usurinta tesuturilor, unde pO2 in capilarele tisulare este mica.
La o oxigenare normala, fiecare molecula de Hb transporta 4 molecule de O2, astfel incat oxiHb poate fi reprezentata mai corect prin simbolul Hb(O2)4 decat prin HbO2. 1g de Hb transporta 1,34-1,35 ml O2, iar la o concentratie de Hb de 15g/dl, 100 ml de sange vor transporta 20,9 ml de O2, din care, in stare de repaus numai 4,5 ml vor fi cedati tesuturilor. Prezenta Hb mareste de aprox. 70 de ori capacitatea sangelui de a transporta O2.
A devenit o obisnuinta sa reprezentam afinitatea Hb pentru oxigen, dar si disocierea (eliberarea) acestuia din oxiHb sub forma unui grafic numit curba de disociere a oxiHb (figura 5.3) in care axa Y reprezina procentul de Hb saturata cu O2 pentru o solutie de Hb, la un pH de 7,4, iar axa X reprezinta presiunea partiala a oxigenului. Fixarea si disocierea O2 urmeaza o curba de aspect sigmoid, care poate fi parcursa in ambele sensuri. Forma de S a curbei, mult mai eficienta functional decat aspectul hiperbolic se datoreaza capacitatii diferite (in fapt vitezei diferite) a celor 4 grupari hem de a fixa O2 pe masura ce creste presiunea acestuia. In procesul de acceptare a O2, gruparile hem coopereaza (interactiune hem-hem): fixarea O2 pe o grupare hem determina modificari in conformatia moleculei de Hb care faciliteaza oxigenarea celui de-al doilea hem, iar acesta la randul sau creste afinitatea celui de-al treilea hem; asa se explica de ce legarea O2 pe hemurile 3 si 4 se face mult mai rapid decat pe primul hem.
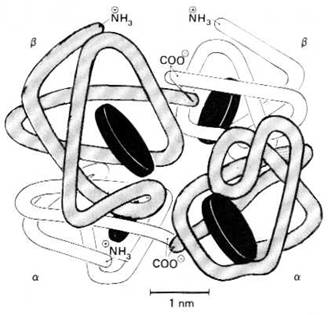
Figura 5.2. Reprezentarea unei molecule de hemoglobina A, care are 4 subunitati. Exista 2 lanturi polipeptidice α si 2 β fiecare continand un hem reprezentat printr-un disc (dupa W.F. Ganong - 1996).
Legarea O2, dar si eliberarea lui (disocierea) depind de presiunea partiala a gazului. La nivel pulmonar, unde pO2 este de 100 mmHg, Hb este aproape complet saturata si transformata in oxiHb. La nivel tisular, unde pO2 este de 40mmHg o buna parte din oxiHb se disociaza, eliberand O2 (procentul de saturare este de 70%), deci scaderea pO2 la nivelul tesuturilor favorizeaza disocierea.
Cand pO2 este sub 20 mmHg, Hb are o foarte slaba afinitate pentru oxigen, iar partea initiala a curbei (presiuni mici) este usor inclinata.
Pentru acceptarea primelor cantitati de O2 este necesara o pO2 peste 20 mmHg, valoare de la care afinitatea Hb pentru oxigen creste substantial. Intre 20-30 mmHg, curba devine aproape verticala (la variatii mici ale pO2 exista variatii mari ale saturatiei Hb cu O2), indicand ca Hb poate ceda rapid O2 fixat. La pO2 peste 70 mmHg, acceptarea se va face mai greu, curba devine mai lina, in platou. La o pO2 de 100 mmHg (capilarele alveolare), saturarea cu oxigen a Hb este de 97,5%.
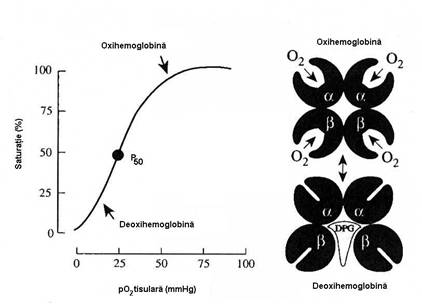
Figura nr. 5.3 Curba de fixare-disociere a Hb (stanga) si modificarile spatiale ale moleculei de Hb in timpul fixarii si cedarii O2
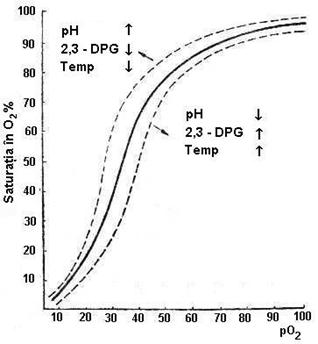
In afara interactiunii hem-hem si a dependentei de pO2, capacitatea Hb de a fixa si ceda O2 mai este influentata si de alti factori intra sau extraeritrocitari (tabel 5.2 si figura 5.4):
- cresterea concentratiei de CO2. La nivelul capilarelor tisulare CO2 trece din plasma in eritrocit, unde legand o molecula de apa (in prezenta anhidrazei carbonice) se transforma in acid carbonic (H2CO3), care disociaza rapid in H+ si HCO3-. Acumularea de protoni scade pH-ul intracelular, care scade afinitatea Hb pentru O2 si faciliteaza disocierea acestuia (deplaseaza la dreapta curba de disociere).
- 2,3 - DPG modifica curba de fixare-disociere: prin expulzarea sa din cavitatea centrala a deoxiHb favorizeaza legarea O2, iar prin legarea de Hb favorizeaza cedarea O2 catre tesuturi (deci cresterea cantitatii de 2,3-DPG deplaseaza curba la dreapta). Actioneaza prin modificarea pH-ului intracelular (scade pH-ul eritrocitului fata de cel plasmatic).
- valoarea pH-ului sanguin (efectul Bohr): acumularea de metaboliti acizi la nivel tisular scade pH-ul, favorizand disocierea oxiHb (curba la drepta). La nivelul capilarelor pulmonare, unde pH-ul este mai crescut creste afinitatea pentru O2, favorizandu-se fixarea.
- temperatura
sangelui: solubilitatea unui gaz intr-un lichid este invers
proportionala cu temperatura lichidului la presiune constanta.
Cand temperatura sangelui creste, sensul reactiei: Hb +O2 ![]() HbO2 se
deplaseaza spre stanga, deoarece scade concentratia oxigenului.
Aceasta echivaleaza cu cresterea disocierii (si scaderea
afinitatii), adica cu deplasarea la dreapta a curbei.
HbO2 se
deplaseaza spre stanga, deoarece scade concentratia oxigenului.
Aceasta echivaleaza cu cresterea disocierii (si scaderea
afinitatii), adica cu deplasarea la dreapta a curbei.
|
Parametri |
Deplasarea curbei este determinata de: |
|
|
Cresterea |
Scaderea |
|
|
Temperatura sangelui |
D |
S |
|
pH |
S |
D |
|
2,3 - DPG eritrocitar |
D |
S |
|
CO2 |
D |
S |
Tabelul nr.5.2. Factorii care determina deplasarea curbei la dreapta (D), asociati cu scaderea afinitatii pentru fixarea O2 (disociere) si la stanga (S), asociati cu cresterea afinitatii pentru fixarea O2.
Figura
5.4. Deplasarea curbei de disociere a Hb sub actiunea unor factori
intra si extraeritrocitari
Transportul bioxidului de carbon
In afara de transportul O2, Hb participa si la transportul CO2 de la tesuturi la plamani, de unde este eliminat prin expiratie. Aproximativ 70% din CO2 produs la nivel tisular este transportat prin plasma, in cea mai mare parte sub forma de bicarbonat, iar 30% este vehiculat de eritrocit: 25% sub forma de bicarbonat, 2% sub forma neionizata (ambele forme dizolvate in apa eritrocitara) si restul de 3% sub forma de carbaminHb. Interventia eritrocitului in transportul CO2 are drept consecinta nu numai eliminarea gazului, ci si implicarea in mentinerea balantei acido-bazice, prin rolul de sistem tampon jucat atat de oxiHb, cit si de deoxiHb.
Rolul Hb in balanta acido-bazica
Eritrocitul poseda trei sisteme tampon, dintre care doua sunt realizate prin intermediul hemoglobinei: HHb/KHb (Hb redusa/hemoglobinat de K) si HbO2/ KHbO2 (oxi Hb/oxihemoglobinat de K). Hb, ca orice proteina este o substanta amfotera, care poate actiona ca acid (doneaza protoni) prin gruparile carboxil, sau ca baza (accepta protoni) prin gruparile amino. Hemoglobina neoxigenata (Hb-) este o baza mai puternica decat oxiHb, ea putand sa accepte si sa neutralizeze mai usor protonii rezultati ca urmare a cresterii nivelului sanguin al CO2.
Tipuri de hemoglobine normale (fizIologice)
Hb A1 (Reprezinta componenta majora din eritrocitele adultului normal. Are in structura sa doua lanturi si doua care difera prin structura lor primara. Principale caracteristici sunt: mobilitate mare electroforetica, punct izoelectric (pH 6,87) si afinitate crescuta pentru O2. Cele mai multe proprietati fizice si chimice referitoare la Hb au fost obtinute prin studiul Hb A1.
HbF ( reprezinta componenta majora a Hb in perioada dezvoltarii fetale. In sangele din cordonul ombilical si la nou nascut este in proportie de 70-80% din totalul Hb. Principala caracteristica o reprezinta rezistenta crescuta la denaturarea alcalina, pe aceasta proprietate bazandu-se si determinarea ei cantitativa. O alta caracteristica a HbF este afinitatea crescuta pentru O2 in raport cu Hb A1, acest fapt datorandu-se faptului ca HbF leaga 2,3 DPG mai greu decat Hb A1. Datorita acestei caracteristici O2 de pe Hb A1 din eritrocitele materne poate trece pe Hb F din eritrocitele fetale (la nivelul capilarelor vilozitatilor coriale ale placentei). Valori mari de HbF se intalnesc fiziologic in sarcina si patologic in anemii severe: talasemia hetero si homozigota, anemia Biermer grava sau in leucemii.
In afara acestor Hb fiziologice, care au structuri proprii, determinate genetic se mai cunosc si Hb minore, nedeterminate genetic, care sunt de fapt Hb normale modificate in vivo sau in vitro. Dintre acestea, cea mai importanta este Hb A1c care are atasat de lantul sau un rest glucidic. Acest tip de Hb creste in eritrocitele senescente si in diabetul zaharat, direct proportional cu nivelul mediu al glicemiei.
|
Tipul de hemoglobina |
Structura moleculara |
Varsta la care apare |
Proportia (%) |
|
|
Nou nascuti |
Adulti |
|||
|
Portland |
|
Numai in viata embrionara |
0 |
0 |
|
Grower I |
|
0 |
0 |
|
|
Grower II |
|
0 |
0 |
|
|
Fetala (F) |
|
Si la nou nascut si la adult |
80 |
< 1 |
|
A1 |
|
20 |
97 |
|
|
A2 |
|
< 0,5 |
~ 2,5 |
|
Tabelul 5.3. Tipuri de hemoglobine fiziologice.
Derivatii de Hb In afara O2, Hb se poate combina si cu alte substante pentru care manifesta o afinitate crescuta, formand compusi instabili sau stabili, lipsiti de capacitatea de a fixa si transporta O2.
- Oxihemoglobina (vezi mai sus)
▪ Carbaminhemoglobina sau carbohemoglobina este compusul fiziologic in care Hb leaga CO2. Legarea acestuia nu se face la nivelul fierului, ca in cazul O2, ci la gruparile aminice libere ale globinei, rezultand un compus carboaminic, forma sub care se transporta o parte din CO2 de la tesuturi la plamani, pentru a fi eliminat. Restul de CO2 este eliminat fie sub forma dizolvata in plasma (sub 5%), fie legat de bicarbonatul plasmatic sau de proteine. Cu cat Hb este mai desaturata (a eliberat O2), cu atat legarea CO2 este mai facila si invers, eliberarea CO2 este favorizata de reoxigenarea Hb. In carbaminhemoglobina, fierul hemului nu-si modifica valenta (ramane bivalent).
Derivatii patologici de Hb
▪ Carboxihemoglobina (COHb). Este derivatul de Hb format prin legarea monoxidului de carbon. Este un compus reversibil, in care CO se leaga direct de Fe2+, in locul O2. (valenta fierului nu se modifica). Hb are o afinitate de 200 de ori mai mare pentru CO decat pentru O2, ceea ce explica rapiditatea instalarii si gravitatea intoxicatiei cu CO, chiar la concentratii mici ale CO in aerul inspirat. In plus, viteza de disociere a COHb este lenta, cantitatea scazand la jumatate in 4 ore.
In mod normal in sange se gaseste o cantitate sub 2% de COHb, care poate creste pana la 4% la fumatori si persoanele care traiesc in zone intens poluate.
Sursele de intoxicatie sunt reprezentate de arderile incomplete ale hidrocarburilor: gazele de esapament, sobe cu reglaj sau tiraj deficitar, furnale etc. Intoxicatia este posibila deoarece CO este un gaz fara miros sau culoare.
Primele semne de intoxicatie apar chiar la concentratii de 10-20% si constau in cefalee, ameteli, iritabilitate, greata, dispnee, culoare rosie aprinsa a tegumentelor si mucoaselor, semnul cel mai caracteristic al intoxicatiei cu monoxid de carbon. La concentratii de 50%, intoxicatia este grava, pacientul prezentand voma, convulsii, coma si se poate instala moartea. Tratamentul consta in scoaterea pacientului din mediul toxic si administrarea de O2 hiperbar (2-3 atm.), care creste viteza de disociere a COHb, timpul de injumatatire scazand de la 4 h, la 1h. Oxigenoterapia hiperbara creste pO2 si implicit cantitatea de O2 solvit in plasma, care va suplini partial absenta Hb, facand posibila salvarea pacientului; adesea, din pacate, in intoxicatiile severe raman sechele ale SNC sau cordului.
▪ Methemoglobina rezulta in urma oxidarii Fe2+ (feros) al Hb si trecerea lui in Fe3+ (feric). Poate lega O2, dar printr-o legatura stabila - nu-l mai poate ceda, ceea ce face ca MetHb sa nu poata indeplini rolul de transportor de O2. Cantitati mici, sub 5% de MetHb apar in sange si in conditii fiziologice, ca rezultat al oxidarii Hb sub actiunea O2 transportat, dar sunt rapid reduse de catre sistemele reducatoare ale eritrocitului, intre care NADH-methemoglobin reductaza are rolul cel mai important. Cresterea concentratiei la 10-25% determina aparitia cianozei, dar nu necesita tratament. La o concentratie de 35% apar: cefalee, dispnee, oboseala marcata, iar la 70% se poate produce moartea. Sangele care contine cantitati mari de metHb are o culoare bruna, iar examinarea spectroscopica indica o banda de absorbtie caracteristica: in rosu, la 620-630 nm, cate o banda ingusta in galben si in verde si o banda lata in albastru.
MetHb poate aparea in urmatoarele circumstante:
- expunerea eritrocitelor la agenti oxidanti-nitriti, coloranti anilinici (folositi si in industria alimentara), naftalen etc. Intoxicatia cu nitritii proveniti din apa poate fi mortala la sugari, daca de la primele semne de cianoza nu se intervine terapeutic prin administrare de substante reducatoare: albastru de metilen (este un foarte bun donor de electroni), administrat oral sau intravenos in intoxicatiile grave, la care se adauga vitamina C, de regula i.v. La toate intoxicatiile cu MetHb, indiferent de cauza acestora, antidotul este albastrul de metilen.
- prezenta hemoglobinei anormale M, la care substitutia unor aminoacizi in lantul globinic determina oxidarea Fe2;
- in caz de deficienta congenitala de NADH-methemoglobin reductaza, care, in mod normal reduce micile cantitati de metHb care apar fiziologic in eritrocite. Indivizii cu o astfel de patologie sunt tratati cronic cu albastru de metilen, care va colora pielea si urina; in lumea medicala sunt cunoscuti ca "oamenii albastri" sau "familii albastre", deoarece deficienta de NADH-methemoglobin reductaza este congenitala (Trost, C, 1982).
▪ Sulfhemoglobina (sulfHb) este un derivat hemoglobinic, care spre deosebire de COHb si MetHb nu poate fi convertita in Hb. Odata formata nu poate fi indepartata din organism decat prin flebotomie. Apare in urma utilizarii cronice a unor droguri (medicamente) ca acetanilida sau fenacetina, la unele persoane cu constipatie cronica si producere in exces de hidrogen sulfurat (cianoza enterogena) si foarte rar este o maladie ereditara. Sangele care contine SulfHb are o culoare bruna-mov.
Anomalii ale sintezei globinei. Hemoglobinopatiile
Hemoglobinopatiile sunt boli ereditare in care este afectata rata de sinteza sau structura globinei, exprimate clinic si biologic, cel mai frecvent sub forma de anemie hemolitica, rareori sub forma de cianoza sau poliglobulie. Exista si anomalii dobandite ale Hb, de obicei sub actiunea unor substante toxice, care nu sunt insa acceptate de multi autori, ca facand parte din aceste entitati nosologice.
Se disting doua mari grupe de hemoglobinopatii : cantitative caracterizate prin blocarea partiala sau totala a ratei de sinteza a unuia sau mai multor lanturi polipeptidice ale globinei si calitative in care anomalia sau mutatia genetica duce la sinteza unor Hb anormale din punct de vedere chimic. Gravitatea hemoglobinopatiilor este variabila, de la anomalii de laborator, asimptomatice pana la afectiuni cu sfarsit letal in uter sau in prima copilarie.
Hemoglobinopatii cantitative - Sindroamele talasemice (anemia mediteraneana)
▪ Talasemia In acest tip de hemoglobinopatie, anomalia genetica produce blocarea partiala sau totala a sintezei lanturilor Are o forma majora caracterizata prin absenta completa a lanturilor (deficit homozigot)numita si anemia Cooley. Deoarece Hb A1 nu se poate sintetiza, ea este inlocuita cu HbA2 si HbF. Din punct de vedere clinic se exprima prin anemie hemolitica severa, dependenta de transfuzii, hepato-splenomegalie, modificari osoase, deces in prima sau a doua decada a vietii. Frotiul arata o anemie, hipocroma, anizopoikilocitoza, cu hematii in tinta, in picatura, ovalocitoza, schizocite (Kobbi S,1998).
Talasemiile ocupa primul loc in cadrul hemoglobinopatiilor in intreaga lume, atat prin incidenta crescuta, cat si prin gravitate. In Europa, incidenta maxima este in tarile din bazinul Mediteranean (Cipru, Italia, Grecia).
▪ Talasemia se caracterizeaza prin absenta sau scaderea sintezei lanturilor si cresterea sintezei de non Lanturilesunt inlocuite cu (4) in Hb H (raspandita in Africa, Asia de S-E, bazinul mediteranean) sau cu (4in Hb Barth.
Hemoglobinopatii calitative
Sunt datorate unor mutatii genetice, care se exprima prin: inlocuirea (substitutia) unor aminoacizi; prin pierderea (deletia) unuia sau mai multor aminoacizi sau prin crossing-over.
▪ Prin substitutie:
- siclemia sau hemoglobinopatia S (drepanocitoza, anemia falciforma, anemia cu hematii in secera). Se datoreaza inlocuirii acidului glutamic din pozitia 6 de pe lantul cu valina, care modifica configuratia spatiala a lanturilor, scade solubilitatea Hb, determina formarea de cristale de Hb (tactoizi), care la randul lor induc modificarea de forma a eritrocitelor (drepanocit, secera). Se transmite autozomal (nelegat de sex). Boala se caracterizeaza prin anemie hemolitica cronica si fenomene de ocluzie vasculara determinate de transformarea drepanocitara a eritrocitelor. Incidenta acestei boli este maxima in zona ecuatoriala a Africii, in Peninsula Arabica, sudul Indiei, Madagascar si populatia de culoare din cele doua Americi. Forma heterozigota (AS) confera rezistenta la malarie (Kobbi, S, 1998).
- alte hemoglobinopatii in
care substitutia unui aminoacid intereseaza tot lantul sunt:
hemoglobinopatia C (Glu![]() Lys), in care prezenta acestui tip de Hb
determina rigidizarea eritrocitelor si sechestrarea lor
splenica; hemoglobinopatia D, cu cel putin 6 variante structurale,
toate prezente pe lantul hemoglobinopatia
E (Glu
Lys), in care prezenta acestui tip de Hb
determina rigidizarea eritrocitelor si sechestrarea lor
splenica; hemoglobinopatia D, cu cel putin 6 variante structurale,
toate prezente pe lantul hemoglobinopatia
E (Glu![]() Lys). In hemoglobinopatia O (HbX) substitutia
intereseaza atat lanturile cat si
Lys). In hemoglobinopatia O (HbX) substitutia
intereseaza atat lanturile cat si
▪ Prin deletie - hemoglobine instabile. Intereseaza unul sau ambele lanturi polipeptidice si se caracterizeaza prin anemie hemolitica si prezenta corpilor Heinz in eritrocite: Hb Zürich, Hb Bucuresti, Hb Tacoma etc..
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Documente online pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








