
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Biologie
|
|
Qdidactic » didactica & scoala » biologie Enzimele - activitatea catalitica a enzimelor, clasificarea enzimelor |
Enzimele - activitatea catalitica a enzimelor, clasificarea enzimelor
Enzimele
Generalitati
Enzimele sunt catalizatori biochimici propriu-zisi, asadar sunt compusi care maresc viteza reactiilor chimice ce se desfasoara in sistemele biologice, fara sa se consume in cursul lor.
S-au efectuat lucrari numeroase de-a lungul anilor dovedindu-se prin acestea ca enzimologia constituie studiul bazelor moleculare ale vietii.
Enzimele sunt probabil mai importante decat orice alt element activ ca ajutor al digestiei si sanatatii. Pana acum s-a aratat ca sute de enzime au un rol vital in construirea sanatatii, datorita contributiei lor la procesul de digestie. Studiile viitoare probabil vor arata ca enzimele au un rol mult mai important pentru sanatate decat se cunoaste in prezent.
Nu putem trai mult fara enzime. De fapt, conceptia in sine este dependenta de aceste elemente. Ele functioneaza ca un catalizator care face ca celulele corpului sa functioneze eficient. Din momentul nasterii, enzimele fac viata posibila prin actiunile lor, reparand si construind corpul si celulele creierului. Acesti lucratori actioneaza in corp si in creier in cel mai fantastic si puternic mod. Ele lucreaza pentru o sanatate deplina. Enzimele reprezinta insasi forta intangibila a vietii. Omul nu poate reusi sa creeze enzime vii asa cum natura poate crea. Daca ar fi putut, ar fi reusit sa creeze viata sau sa readuca la viata materia moarta.
Exista miliarde de enzime in corpul nostru, si sunt sute de tipuri diferite de enzime gasite in sange, care vor descompune 5 milioane de molecule de peroxid in apa si oxigen in 60 secunde. Enzimele intestinale pot descompune moleculele de zahar si grasimi care sunt de 1 milion de ori mai mari decat greutatea lor.
Corpul nostru produce enzime atunci cand sanatatea nostra este echilibrata. Ele efectueaza toata munca din corp. Ele sunt responsabile cu lupta impotriva infectiilor, cu digestia, cu refacerea corpului - functiile lor sunt infinite. Ele lucreaza non-stop si nu obosesc niciodata sau nu-si inceteaza lucrul daca sanatatea este echilibrata. Cand sanatatea nu este in echilibru, atunci este o deficienta enzimatica. Enzimele pot fi usor extrase din alimente nutritive usor de digerat, care sunt alimente crescute intr-un sol sanatos, nefertilizat, si care sunt preparate special prin mixare, germinare, fermentare si cantitati mici de suc, nu prin gatire. Aceste enzime extind energia vitala a corpului catre o stare totala de bine. Consumarea alimentelor sanatoase este cea mai eficienta cale de a suplimenta rezerva de enzime existenta in corp, pentru a imbunatati sistemul digestiv. Cele mai importante enzime care au fost izolate in hrana sanatoasa sunt: cytochrome oxidase, un anti-oxidant necesar pentru respiratia celulelor; lipase, enzima care descompune moleculele de grasime; protease, enzima care ajuta la diestia proteinelor; amylase, enzima care faciliteza digestia amidonului; catalase, enzima ce catalizeaza descompunerea apei oxigenate in apa si oxigen in tesuturi; peroxidase, enzima ce actioneaza in acelsi mod, dar la nivel celular; transhydrogenase, enzima care ajuta in pastrarea tonusului muscular al inimii si SOD (Super Oxide Dismutase), o enzima care previne imbatranirea. Enzima pepsine ajuta la digestia proteinelor si transformarea lor in aminoacizi. Acesti aminoacizi sunt apoi transportati prin sistemul circulator in tot corpul, pentru ca acesta sa primeasca energie si sa se auto-vindece.
Activitatea catalitica a enzimelor
Enzimele sunt, precum s-a mai spus, catalizatori organici produsi de celula vie actionand asupra anumitor substante numite substraturi. In marea lor majoritate, enzimele catalizeaza reactia unei substante organice cu un compus anorganic liber sau cedat de alt compus organic (apa, acid fosforic, hidrogen, oxigen, etc.). Legile catalizei se aplica fireste si la enzime. Enzimele, ca toti catalizatorii, nu catalizeaza decat reactii termodinamic posibile, decurgand in sensul stabilirii unui echilibru. Reactiile enzimatice prezinta insa unele deosebiri caracteristice fata de reactiile catalitice obisnuite, omogene sau eterogene.
Activitatea enzimelor. Cand o reactie poate fi catalizata atat de o enzima cat si de substante simple se constanta de obicei ca reactia enzimatica decurge cu viteza mult mai mare; cu alte cuvinte, reactia enzimatica are o energie de activare mult mai mica. Astfel s-a stabil ca este necesara o concentratie de ioni de hidrogen de 10 milioane de ori mai mare decat de invertaza pentru a hidroliza o anumita cantitate de zaharoza, intr-un timp dat, la 37˚.
Datorita acestei enorme activitati catalitice, sunt suficiente de obicei concentratii foarte mici de enzima pentru a obtine efecte considerabile.
Activitatea enzimelor nu dureaza indefinit ca acea a catalizatorilor simpli si este in general mai scurta decat aceea a catalizatorilor heterogeni. In cazul reactiilor enzimatice, cu cat trece timpul, cu atat cantitatea de substrat transformata in unitatea de timp se micsoreaza, iar dupa un timp mai lung reactia practic inceteaza. Inactivarea enzimelor se explica prin denaturarea lor sau prin alte transformari datorita caracterului lor de proteine globulare. Celulele vii sintetizeaza enzime fara incetare.
Temperatura optima a reactiilor enzimatice. Viteza reactiilor enzimatice creste ca a celor mai multe reactii intre molecule covalente, cu temperatura, potrivit cunoscutei reguli a lui van't Hoff, si anume o urcare a temperaturii cu 10˚ produce o crestere a vitezei de reactie cu un coeficient 1.5 - 3. Cresterea aceasta se observa insa numai la temperaturi joase. Odata depasita o anumita temperatura optima, la care viteza este maxima, aceasta scade, iar la temperaturi mai inalte, reactia inceteaza. Fenomenul se explica prin faptul, semnalat mai sus, ca la temperaturi mai inalte, enzimele sunt inactivate prin denaturarea componentei proteice. Cele mai multe enzime devin complet inactive intre 50-80˚. Temperatura optima nu poate fi insa exact definita, caci ea variaza in limite largi, cu concentratia enzimei, cu concentratia ionilor de hidrogen si cu prezenta diferitelor impuritati ale preparatului enzimatic sau ale substratului.
Coenzimele respiratiei. Este cunoscut rolul important al reactiilor de oxidare cu oxigen molecular, pentru producerea energiei necesare functiilor vitale ale organismelor. Nu exista nici o enzima capabila sa transfere direct unei molecule de oxigen hidrogenul eliminat de substraturile curente din organismele vii. Pentru a se combina cu oxigenul, este necesara interventia unui sistem complex de enzime si coenzime. Enzimlele fac parte din clasa oxido-reductazelor (dehidrogenaze si oxidaze). Hidrogenul cedat de substrat este intai acceptat ce DPN (codehidraza I), asociate dupa caz cu o enzima specific adaptata substratului. Soarta coenzimelor hidrogenate care se formeaza depinde de conditiile anaerobe sau aerobe in care are loc reactia. In conditii anaerobe, hidrocodehidraza cedeaza hidrogenul unui acceptor din mediul de reactie.
Proprietatea aceasta a dehidrogenazelor de a transfera hidrogen din substrat la diferiti acceptori a fost descoperita de Thunberg in 1917. Tehnica folosita de acest cercetator pentru a decela transferul anaerob de hidrogen s-au mai corect pentru a pune in evidenta prezenta unui sistem enzimatic capabil de a transfera hidrogen, consta in folosirea colorantului albastru-metilen ca acceptor. Aceasta se decoloreaza trecand in leucoderivatul sau.
Nici in conditii aerobe, hidrogenul din hidrocodehidraza nu este cedat direct unei molecule de oxigen, ci el este intai transferat altor sisteme enzimatice care abia ele pot reactiona cu oxigenul. Sunt mai multe cai posibile prin care hidrogenul substratului poate ajunge la oxigen. Un astfel de lant de reactii este redat in urmatoarea schema.
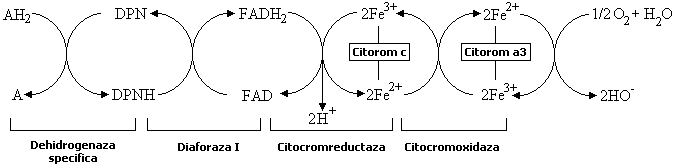 Hidrogenul cedat de substratul AH2, de exemplu
codehidrazei I, este transferat flavin-adenin-dinucleotidei. De aici inainte,
atomii de hidrogen se desfac in protoni si electroni: primii trec in
solutie (sub forma de ioni de hidroniu), iar electronii reduc fierul
din citocrom, de la starea trivalenta la starea bivalenta. Citocromul
c redus reduce citocromoxidaza
(citocrom a3) care este
singura capabila de a ceda electroni oxigenului. Citocromii sunt deci
transferaze de electroni (oxidaze aerobe). In schema de mai sus sunt
identificate (pe randul de jos) enzimele ce actioneaza in acest
proces complicat.
Hidrogenul cedat de substratul AH2, de exemplu
codehidrazei I, este transferat flavin-adenin-dinucleotidei. De aici inainte,
atomii de hidrogen se desfac in protoni si electroni: primii trec in
solutie (sub forma de ioni de hidroniu), iar electronii reduc fierul
din citocrom, de la starea trivalenta la starea bivalenta. Citocromul
c redus reduce citocromoxidaza
(citocrom a3) care este
singura capabila de a ceda electroni oxigenului. Citocromii sunt deci
transferaze de electroni (oxidaze aerobe). In schema de mai sus sunt
identificate (pe randul de jos) enzimele ce actioneaza in acest
proces complicat.
Clasificarea enzimelor
|
I. Hidrolaze |
|||||
|
1. Esteraze |
Reactii: hidrolize de esteri, amide, peptide |
||||
|
a. Carboxisteraze (ficat, alte organe) |
Butirat de etil, alti
esteri |
||||
|
b. Lipaze (pancreas, seminte, bacterii) |
Grasimi |
||||
|
c. Colinesteraza (sange, tesuturi animale) |
Acetilcolina |
||||
|
d. Tanaza (plante) |
Galotanin |
||||
|
e. Fosfataze (tesuturi vegetale si animale) |
Esteri ai ac. fosforic
|
||||
|
f. Sulfataze (tesuturi vegetale si animale) |
Esteri ai ac. Sulfuric |
||||
|
2. Glicozidaze |
Hidrolizeaza legaturi glicozidice |
||||
|
A. Oligozaharidaze |
Ex:a-Glocozidaze (maltaze) b-Glicozidaze (emulsina) a-Galactozidaze b-Galacctozidaze Invertaza (hidrol. zaharoza) etc. |
||||
|
B. Polizaharidaze |
a-Amilaze b-Amilaze Cicloamilaze (din Bacillus macerans) Celulaze Poligalacturonidaze Chitinaze Hialuronidaze |
||||
|
3. Amidaze |
Hidrolizeaza legatura C-N |
||||
|
a. Asparaginaza |
Asparagina |
||||
|
b. Glutaminaza |
Glutamina |
||||
|
c. Arginaza (ficat) |
Arginina |
||||
|
d. Ureeaza (bacterii, soia) |
Uree |
||||
|
4. Proteaze |
Hidrolizeaza legaturi peptidice |
||||
|
A. Endopeptidaze |
Proteine Pepsina (suc stomacal) Tripepsina si chimotripsina (suc intestinal) Catepsina (intracelulara) |
||||
|
B. Exopeptidaze |
Carboxipeptidaze Aminopeptidaze Glicil-glicin-peptidaza L-Alanil-glicin-peptidaza Prolidaza Prolinaza etc. |
||||
|
5. Purin-desaminaze |
Amino-purine |
||||
|
a. Adenaza |
Adenina |
||||
|
b. Guanaza |
Guanina |
||||
|
6. Nucleaze |
Hidrolizeaza acizi nucleici |
||||
|
A. Polinucleotidaze (ribonucleaza si desoxiribonucleaza) (suc pancreatic si suc intestinal) |
Polinucleotide |
||||
|
B. Nucleotidaze |
Nucleotide |
||||
|
C. Nucleozidaze |
Nucleozide |
||||
|
II. Transferaze |
|
|
Reactii: |
|
|
1. Transmetilaze |
|
|
a. Transmetilaza colina-homocisteina |
Colina + homocisteina
|
|
b. Transmetilaza betaina-homocisteina |
Betaina +
homocisteina |
|
c. Transmetilaza metionina-glicocol |
Metionina + glicocol |
|
d. Transmetilaza metionina-noradrenalina |
Metionina +
noradrenalina |
|
2. Transacliaze (in special transacetilaze) |
Transfer de grupe acetil de la acetil coenzima A la diferite substraturi |
|
a. Arilamino-transacetilaza (ficat) |
Acetil-CoA + arilamine |
|
b. Glucozamin-transacetilaza (ficat) |
Acetil-CoA + D-glucozamine |
|
c. Colin-acetilaza (tesut nervos) |
Acetil-CoA + colina |
|
d. Acetil-CoA-transacetilaza (tesuturi animale) |
2 Acetil-CoA |
|
e. Oxaloacetat-transacetilaza (raspandire univ.) |
Acetil-CoA + acid oxalilacetic |
|
3. Transglicozilaze |
Transfera la alte substraturi resturi de D-glucoza legata in pozitia 1a, de diferite grupe R |
|
a. Fosforilaza amidonului (sau enzima P) (univ.) |
Amiloza +
glucoza-1-fosfat |
|
b. Enzima Q (factorul de ramificare) (univ.) |
Transfera o portiune dintr-o catena de amiloza (poliglucoza cu legaturi 1,4-a) de la o pozitie 4 la o pozitie 6 |
|
c. Transglucozilaza zaharozei (bacterii) |
n Zaharoza |
|
4. Transfosfataze (fosfokinaze) |
Transfera resturi de fosfat de la acid adenosin trifosforic la cele mai variate substraturi, conservand energia in noua legatura de fosfat |
|
a. Hexokinaza (drojdie, tesuturi animale) (Mg2+) |
D-glucoza + ATP |
|
b. Fructokinaza (ficat,muschi,bacterii)(Mg2+,K+) |
D-fructoza + ATP |
|
c. Fosfohexokinaza (in toate tesuturile) (Mg2+) |
Fructoza-6-fosfat + ATP |
|
d. Triokinaza (ficat) (Mg2+) |
D-glicerinaldehida + ATP |
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








