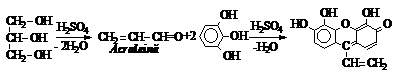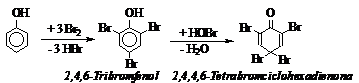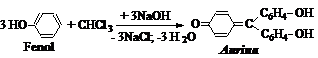| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Identificarea si dozarea compusilor hidroxilici, alifatici si aromatici si a derivatilor lor |
Identificarea si dozarea compusilor hidroxilici, alifatici si aromatici si a derivatilor lor
IDENTIFICAREA SI DOZAREA COMPUSILOR HIDROXILICI, ALIFATICI SI AROMATICI SI A DERIVATILOR LOR
Reactiile de identificare ale compusilor hidroxilici si derivatilor lor au la baza reactivitatea acestora.
1. Reactii de identificare pentru alcooli
1.1. Identificarea alcoolilor monohidroxilici
Reactiile caracteristice ale alcoolilor apartin functiunii hidroxil.
1. Evidentierea caracterului foarte slab acid al alcoolilor.
a. Reactia cu Na metalic; formarea alcoxizilor sau alcoolatilor.
Intr-o eprubeta uscata, 1-2 mL alcool etilic absolut se trateaza cu o bucatica Na metalic. Eprubeta se inchide dupa adaugarea sodiului. Are loc reactia sodiului cu alcoolul cu degajare de hidrogen conform ecuatiei:
|
|
Cand degajarea hidrogenului devine linistita, se aprinde gazul la gura eprubetei si se observa flacara albastra de ardere a hidrogenului. In eprubeta ramane etoxid de sodiu dizolvat in exces de etanol sau ca precipitat.
b. Hidroliza alcoolatului
Peste putin alcoolat preparat la punctul a, se toarna 2-3 mL apa distilata. Are loc hidroliza alcoolatului, cu formarea alcoolului si a NaOH care alcalinizeaza mediul. pH-ul alcalin al mediului de reactiei se verifica cu fenolftaleina sau alt indicator acido-bazic.
|
|
2. Oxidarea alcoolilor.
a. Oxidarea blanda a alcoolului etilic. Intr-o eprubeta se introduc si se amesteca cu atentie 2 mL solutie bicromat de potasiu 5%, 2 mL acid sulfuric diluat 1:5 si 1 mL alcool etilic. Se incalzeste amestecul cu precautie. Se formeaza aldehida acetica, care se recunoaste dupa mirosul ei caracteristic (de mere crude). Solutia se coloreaza in verde prin formarea sarii de crom trivalent (Cr3+).
|
|
b. Oxidarea energica a alcoolului etilic. Intr-un flacon Erlenmeyer, prevazut cu un tub de culegere, se introduc 3 mL solutie KMnO4 5% si 1 mL alcool etilic. Se adauga 5 mL acid sulfuric diluat 1:5 si o bucatica de piatra ponce. Capatul tubului de culegere se introduce intr-o eprubeta goala. Se incalzeste cu precautie, deoarece reactia este energica, la fierbere timp de 4-5 minute. Incalzirea se continua pana cand in eprubeta goala se colecteaza circa 1 mL distilat. Distilatul are reactie acida, miroase a acid acetic si dupa neutralizare cu alcalii da reactia cu clorura ferica, specifica acidului acetic. Pentru aceasta, distilatul se neutralizeaza cu o solutie NaOH 5% (se verifica cu hartie de pH) si apoi se adauga cateva picaturi de FeCl3 1%. Se obtine un precipitat floconos, rosu-brun, de acetat feric.
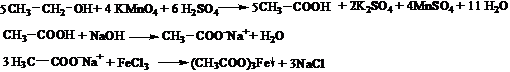
|
1.2. Identificarea polialcoolilor
1. Reactia cu pirogalolul
Intr-o eprubeta se ia 1 mL solutie de glicerina (sau glicol) si se adauga 1 mL solutie de 5% pirogalol (pirogalol dizolvat in H2SO4 conc.). Se incalzeste cateva minute pe baie de apa. Apare o coloratie rosie in cazul glicerinei sau galbena in cazul etilenglicolului. Coloratiile formate se datoreaza condensarii pirogalolului cu aldehidele rezultate prin deshidratarea polialcoolilor in prezenta H2SO4 conc.
|
|
2. Reactii de identificare pentru fenoli
1. Caracterul acid al fenolilor. Reactia cu alcalii.
Fenolii sunt acizi mai tari decat alcoolii. In reactie cu apa echilibrul este slab deplasat spre dreapta, iar cu NaOH rezulta fenoxizi hidrolizabili.
Mod de lucru: Intr-o eprubeta se introduc cateva cristale de fenol peste care se adauga solutie NaOH 10%. Se observa dizolvarea cristalelor in solutia alcalina. La tratare cu acid sulfuric diluat se separa fenolul din solutia de fenoxid.
![]()
2. Reactii de culoare
a) Reactia cu clorura ferica
Fenolii dizolvati in apa si tratati cu clorura ferica 1%, in solutii apoase diluate neutre sau acide dau coloratii caracteristice datorita formarii unor saruri bazice de fier. Daca in pozitia orto fata de grupa hidroxil exista grupe complexante (>C=O, -COOH, -COOR, -OH, -OR) se formeaza compusi chelati, colorati atat in solutie apoasa, cat si in solutie alcoolica.
Mod de lucru: Cateva cristale dintr-un fenol se trateaza cu 1-2 picaturi dintr-o solutie de clorura ferica. Apare coloratia caracteristica fenolului respectiv. La adaugare de alcool, acid clorhidric sau hidroxid de sodiu coloratia dispare, datorita micsorarii gradului de disociere a fenolilor.
Aceasta este dovada ca fenolii formeaza cu ionul feric (Fe3+) chelati a caror culoare depinde de vecinatatile grupelor -OH care complexeaza cu ionul central. Coloratii violete dau: fenolul, rezorcina, o- si p-hidroxibenzaldehida, naftolul, aldehida salicilica, acidul salicilic. Coloratii albastre dau: o-, m-, p-crezolul, 1,3-xilenolul, hidrochinona, floroglucina. Coloratii verzi dau pirocatehina si naftolii. Coloratie albastru-verzui da hidroxihidrochinona.
3. Reactii la nucleul aromatic
a. Reactii de substitutie electrofila prin halogenare
In mediu alcalin, fenolul se poate bromura la 2,4,6-tribromfenol, precipitat alb. Sub actiunea excesului de apa de brom, tribromfenolul este oxidat la 2,4,4,6-tetrabromciclohexadienona, produs de culoare galbuie, greu solubil in apa rece dar usor solubil in benzen. Reactia cu bromul serveste la dozarea fenolului.
|
|
Mod de lucru: Intr-o eprubeta cateva cristale de fenol se dizolva in NaOH 10%. Se adauga apa de brom si se observa aparitia precipitatului.
4. Reactia de oxidare.
Fenolii au un puternic caracter reducator care se pune in evidenta cu reactivii Tollens si Fehling.
a. Reducerea reactivului Tollens. Reactivul Tollens (hidroxid diaminoargentic) se obtine prin amestecarea in parti egale a unei solutii de AgNO3 si a unei solutii de NaOH 10%, peste care se adauga picatura cu picatura NH3 diluat pana la dizolvarea precipitatului cenusiu de oxid de argint format initial.
Mod de lucru: Intr-o eprubeta se iau 5-10 mL reactiv Tollens, proaspat preparat, peste care se introduc cateva cristale dintr-un fenol superior (fluoroglucina). La incalzire usoara, fenolii se oxideaza trecand in chinone, iar reactivul Tollens este redus cu formarea oglinzii de argint.
b. Reducerea reactivul Fehling. Reactivul Fehling este un complex al acidului tartric cu cupru, care se obtine prin amestecarea in proportii egale a solutiilor de Fehling I si Fehling II.
Mod de lucru: Intr-o eprubeta cu 5-10 mL reactiv Fehling, proaspat preparat, se introduc cateva cristale de fenol superior (fluoroglucina). Prin fierbere rezulta un precipitat roscat de Cu2O.
5. Reactii de condensare
a. Reactia aurinelor.
Intr-o eprubeta, cateva cristale de fenol se dizolva la usoara incalzire in NaOH 10%; la adaugare de cloroform rezulta coloratie rosie datorita formarii unor coloranti din clasa trifenilmetanului:
|
|
3. Reactii de identificare pentru eteri
1. Reactia cu hartia ferrox.
Hartia "ferrox" se obtine prin imbibarea unor fasii de hartie de filtru in amestecul de volume egale de solutii metanolice 5% de FeCl3 si KSCN. Hartia uscata se pastreaza la intuneric cateva luni de zile. Agitand eterul cu hartia ferrox apare culoarea rosu-sange care se transmite si solutiei.
2. Reactia cu HI
Cateva picaturi sau cristale de substanta se incalzesc cu HI, cel mai bine in putin fenol sau anhidrida acetica. Se formeaza iodura de alchil volatila care se capteaza in solutia alcoolica de azotat de argint cand se formeaza un precipitat alb. Reactia se aplica pentru R avand maxim trei atomi de carbon; dupa C4, iodurile nu mai sunt volatile.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Proiecte pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||