
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Biologie
|
|
Qdidactic » didactica & scoala » biologie Bazele moleculare ale apoptozei |
Bazele moleculare ale apoptozei
BAZELE MOLECULARE ALE APOPTOZEI
Celula reprezinta cea mai simpla forma de viata, care prin diviziune poate sa formeze in cea mai mare masura descendenti identici sau cu caracteristici asemanatoare .
Activitatea vitala a celulei are la baza o multitudine de procese fizice si chimice care au ca substrat, in cea mai mare parte, materie organica formata din compusi de carbon si procese ce se desfasoara in mediul intern al celulei (o solutie apoasa concentrata de substante chimice) .
Intreruperea sau perturbarea proceselor respective poate duce uneori la disparitia functiilor vitale, respectiv la moartea celulara.
Se cunoaste de mai mult timp faptul ca moartea celulara atat a celulei ca organism unicelular cat si ca element dintr-un organism pluricelular, poate surveni accidental prin actiunea distructiva asupra celulei a numerosi factori sau agenti externi (fizici, chimici, biologici) .
In absenta acestor factori, celula isi urmeaza propriul sau ciclu de viata care se termina de cele mai multe ori cu diviziunea sa, respectiv cu formarea de descendenti celulari identici.
Se pune problema daca celula isi poate pierde functiile vitale, deci poate muri in absenta acestor factori externi, care actioneaza direct asupra structurilor celulare sau moleculare ale celulei. Raspunsul, dificil de dat, este sugerat de o serie de fapte experimentale a caror interpretare a dus la cristalizarea unor concepte privind moartea celulara.
Astfel, este bine cunoscut faptul ca in culturi, celula prezinta un numar limitat de diviziuni, chiar daca in mediul respectiv se adauga citokine sau factori de crestere si exista spatiu suficient de multiplicare. De exemplu, fibroblastele de la fetus uman din culturi se divid de 80 de ori, in timp ce fibroblastele recoltate de la adultul de 40 de ani, in aceleasi conditii, se divid doar de 40 de ori.
Acest fenomen a fost denumit "senescenta" celulara considerandu-se ca exista o corespondenta intre numarul de diviziuni si varsta intregului organism. Acest fenomen discutabil, al carui mecanism nu se cunoaste si care atrage atentia asupra posibilitatilor distrugerii sau limitarii functiilor unei celule in absenta unor factori externi distructivi, poate fi datorat cumularii unor produsi intracelulari. Aici apare si ideea de proliferare limitata a unei celule in dezvoltarea unui tesut sau organism .
Oprirea ciclului de viata al unei celule, in absenta factorilor externi inainte de diviziunea celulara, o adevarata "sinucidere" celulara, este pusa in discutie odata cu stabilirea proprietatilor catalitice ale lizozomilor, respectiv de taiere a moleculelor de polizaharide. Polizaharidele uzate pot fi inglobate in peretele bacterian producand liza bacteriana dar si in membranele celulare. O actiune necoordonata a lizozomilor poate duce la autodistrugerea celulara (De Duve 1950). De asemenea, acumularea de metaboliti sau radicali liberi poate constitui un mecanism de autodistrugere celulara.
Conceptul de apoptoza se diferentiaza net de aceste optiuni (senescenta celulara, distrugere celulara prin lizozomi sau prin acumulare de metaboliti) dar pastreaza ideea de distrugere celulara inainte de terminarea ciclului celular prin diviziune celulara .
Astfel, Kerr si colaboratorii au introdus in anul 1972 termenul de apoptoza. Acest termen defineste incetarea functiilor vitale ale celulei, in cursul ciclului celular, printr-un mecanism intern independent de factorii din mediul extern (nociv sau favorabil) celular.
Termenul de apoptoza este format prin unirea a doua cuvinte din limba greaca veche apo insemnand din, de pe, si ptosis -cadere, in sensul caderii frunzelor unui pom sau al petalelor unei flori, sugerand incetarea functiilor vitale celulare.
S-a mai propus si termenul de oncosis care presupune conceptul de moarte celulara atunci cand celula nu doreste sa participe la propria sa moarte, respectiv cand celula moare inainte de terminarea ciclului celular. Oncoza reprezinta prima faza a unei morti accidentale a celulei in care are loc o edematiere (umflare) a celulei (oncos=umflare). Clasic se considera oncoza drept o serie de modificari morfologice inglobate in procesul de necroza. Majno si Joris diferentiaza net acesti termeni considerand necroza ca o suma de procese celulare care apar la un interval mare de timp, dupa moartea propriu-zisa a celulei.
Conceptul de apoptoza inglobeaza doua aspecte: primul se refera la faptul ca celula isi poate intrerupe functiile vitale, murind in absenta unor factori externi, iar al doilea aspect se refera la faptul ca pentru a-si intrerupe functiile vitale celula dispune de mecanisme proprii (cu consum de energie) biologice si biochimice, relativ specifice. Activarea mecanismelor prin care se realizeaza apoptoza duce la modificari celulare caracteristice, care se pot observa prin tehnici uzuale de microscopie optica fluorescenta sau tehnici imunohistochimice.
Aceste modificari morfologice sunt net diferite de cele din cursul mortii celulare datorate unor agenti externi, respectiv ai necrozei si cuprind: condensarea citoplasmei, fragmentarea ADN, depozitarea cromatinei in partea interna a membranei nucleare, formarea de vezicule ce contin parti de nucleu si organite celulare intacte si, in final, formarea de corpi apoptotici care vor fi fagocitati.
Cel mai tipic exemplu de apoptoza se observa la organismele pluricelulare in cursul dezvoltarii embrionare, unde datorita dezvoltarii rapide o serie de celule trebuie distruse inainte ca ciclul lor de viata sa se incheie, pentru a face loc altor celule si a realiza organul respectiv cu forma si volumul corespunzator.
Existenta unor mecanisme celulare proprii de autodistrugere celulara a presupus, si ulterior s-a demonstrat, existenta unor gene care sa declanseze si sa coordoneze aceste procese. Astfel se considera ca fiecare celula poseda programe genetice pentru autodistrugere. Asa a aparut termenul de moarte celulara programata similar celui de apoptoza .
Nu exista o definitie stricta a apoptozei sau a mortii celulare programate. Definitia data de Kerr in anul 1972 si completata de Wyllie in 1987 si Smith in 1994 evidentiaza faptul ca apoptoza este un proces ordonat al mortii celulare care necesita functionalitate mecanismelor genetice si sinteze de proteine. Este deci un proces activ, cu consum de energie care duce in final la moartea celulei.
Tot Kerr in 1994 defineste apoptoza ca un proces de moarte celulara in absenta supravegherii imunologice, insistand asupra faptului ca prin intermediul apoptozei organismul multicelular isi distruge celulele nedorite raspandite in masa unui tesut.
Ceea ce ramane esential in definitia data de Kerr, cu completarile ulterioare, este faptul ca apoptoza sau moartea celulara programata este un proces fiziologic care intervine in urma activarii programelor de autodistrugere inscrise in genomul tuturor celulelor unui organism pluricelular. Pornind de la aceste repere date de Kerr in definirea conceptului de apoptoza au loc o serie de reinterpretari sau de extinderi ale conceptului.
Astfel, desi initial sinonimi, termenii de moarte celulara programata si apoptoza au primit semnificatii diferite pentru unii cercetatori.
Horvitz in anul 1994 arata ca moartea celulara programata si apoptoza sunt termeni utilizati pentru acelasi concept si totusi ei desemneaza notiuni diferite. Astfel, moartea celulara programata este o moarte naturala, fiziologica produsa prin activarea programelor genetice de autodistrugere celulara. Termenul de apoptoza desemneaza un ansamblu de fenomene intracelulare, tot fiziologice (condensarea citoplasmei, fragmentarea ADN, formarea de corpi apoptotici) care sunt asociate mortii celulare programate.
In prezent, se utilizeaza termenul de apoptoza in ambele variante: fie ca sinonim cu moartea celulara programata, fie desemnand numai modificarile morfologice celulare care sunt asociate mortii celulare programate. Din aceste motive formularea "moarte celulara programata prin apoptoza " este corecta.
Exista concepte care tind sa largeasca conceptul de moarte celulara programata (sau apoptoza). Acestea pleaca de la faptul, unanim acceptat, ca celulele poseda un mecanism de autodistrugere (un adevarat program) controlat genetic. Se pune problema in ce conditii se declanseaza acest program.
Un prim raspuns ar fi faptul ca celulele primesc din partea celorlalte celule mesaje de supravietuire. Absenta lor, sau modificarea acestor mesaje ar duce la declansarea proceselor de autodistrugere. Celula supusa unei agresiuni ce conduce la alterarea ADN are in fata trei posibilitati de manifestare in functie de natura stimulului: sa-si repare ADN prin intermediul echipamentului enzimatic de care dispune si sa-si continue ciclul de viata (stimul cu actiune redusa), sa fie distrusa imediat indiferent daca s-a distrus ADN (stimul cu intensitate mare), si sa prezinte modificari ale ADN ireparabile dar inca compatibile cu viata. In acest ultim caz se declanseaza procesele de autodistrugere, de suicid, respectiv moartea celulara programata sau apoptoza.
Astfel, apare ideea ca apoptoza depinde in anumite conditii si de anumiti factori externi. S-a constatat totodata ca anumiti agenti externi cunoscuti ca avand actiuni agresive asupra celulelor pot declansa procesul de moarte celulara programata. Astfel, radiatiile ionizante, unele substante chimice sau chiar medicamente, expunerea la temperaturi crescute si privarea de factori vitali, pot declansa, prin mecanisme mai putin cunoscute procesul de apoptoza. Conditia ca acesti agenti sa induca fenomenul de apoptoza este ca intensitatea cu care lucreaza sa fie redusa. In caz contrar, distrugerea este rapida, masiva, moartea instalandu-se imediat. Este ceea ce se defineste uzual prin fenomenul de necroza.
Una din definitiile cele mai complete care ia in considerare in special modificarile morfologice, a fost data de Willie, Kerr si Currie inca din anul 1980 pastrandu-si valabilitatea si astazi: apoptoza este un proces strict reglat fiziologic caracterizat partial de condensarea nucleara si micsorarea volumului celular, cu pastrarea intacta a membranei plasmatice, culminand cu distrugerea cromatinei nucleare si digestia ADN genomic, ca eveniment ireversibil.
Unul dintre punctele comune ale definitiilor sau incercarilor de definitie a procesului de apoptoza prezentat anterior este faptul ca acesta este un proces normal, fiziologic, care se inscrie impreuna cu mitoza, diferentierea sau moartea celulara accidentala ca unul dintre evenimentele cele mai importante ale ciclului celular.
Declansarea, desfasurarea si incheierea acestui mecanism duce invariabil la moartea celulei. In general, procesului de moarte celulara programata sau apoptoza nu ii este proprie extinderea pe arii celulare intinse care sa cuprinda un numar mare de celule ci se desfasoara relativ punctiform implicand o celula sau un numar mic de celule. Desigur, numarul de celule moarte prin apoptoza este mai mic in cazul organelor constituite si infinit mai mare in cursul dezvoltarii embrionare.
O caracteristica importanta a apoptozei este faptul ca celulele moarte prin acest proces sunt eliminate rapid prin recunoasterea si ingestia lor de catre celulele specializate in fagocitoza (sau chiar celule invecinate) fara sa existe alterari ale celulelor vecine si fara sa existe reactii inflamatorii. In acest fel sunt eliminate celulele nedorite dintr-un tesut sau celulele care au suferit alterari structurale ireparabile. Astfel, apoptoza apare ca un mecanism de mentinere a dinamicii celulare intr-un tesut prin faptul ca apoptoza este un proces antagonist mitozei. Exista practic o balanta mitoza/apoptoza intr-un tesut sau organism pluricelular care in conditii normale duce la o dezvoltare sau functionalitate normala a acestora. Astfel, cresterea tisulara ca si numarul de celule dintr-un tesut depind de raportul mitoza/apoptoza.
Apoptoza pare un mecanism principal de modelare a formei unui organism pluricelular, dar distrugerea unor celule pentru ca altele sa le ia locul trebuie privita si in alt sens. Astfel, se cunoaste foarte bine dezvoltarea degetelor la vertebrate, cu eliminarea prin apoptoza a celulelor (membranelor interdigitale) in cursul dezvoltarii embrionare. Inhibarea mortii celulare prin apoptoza a acestor celule prin administrare de peptide inhibitorii ale enzimelor participante la apoptoza (caspaze) inhiba dezvoltarea si formarea degetelor.
Existenta balantei apoptoza/mitoza este intalnita si in cazul proliferarilor tumorale dar, in tumori, mitozele depasesc cu mult capacitatea celulelor de a fi distruse prin apoptoza; sau, se poate spune ca un defect in producerea apoptozei sau in inhibitia acesteia ar avea ca rezultat proliferarea necontrolata a unor clone de celule care nu ar mai raspunde la stimulii inductori ai apoptozei. De mentionat este si faptul ca pana in prezent, in cancer s-a acordat cea mai mare importanta aspectului legat de proliferarea celulara si mai putin proceselor de limitare a proliferarii, respectiv ale apoptozei. Diviziunea aberanta a celulelor tumorale depaseste posibilitatile de limitare a acestei cresteri prin intermediul apoptozei. Exista corelatii privind proliferarea tumorala si apoptoza si la nivel genetic. Astfel, tumorile in care expresia genelor bcl-2 este crescuta sunt rezistente la apoptoza si au un raspuns slab la terapia anticanceroasa. Mecanismul poate consta in activarea genelor antiapoptotice bcl-2 intr-o serie de celule tumorale.
Indiferent daca au o desfasurare normala sau prezinta alterari, procesele apoptotice au o determinare genetica.
Primul model experimental: Caernorhabditis elegans
Primele cercetari pentru determinarea genelor care coordoneaza procesele apoptotice au fost facute pe modele experimentale care folosesc nematodul Caenorhabditis elegans. Acesta are 1090 de celule somatice care se formeaza in cursul dezvoltarii sale, dintre care 131 mor prin apoptoza, respectiv prin activarea unui numar de 11 gene. Mutatiile survenite accidental sau induse la nivelul acestor gene au aratat ca unele dintre aceste gene pot provoca moartea celulelor, in timp ce altele pot prelungi supravietuirea. De exemplu, genele ced-3 si ced-4 sunt necesare pentru derularea proceselor specifice apoptozei iar gena ced-9 le blocheaza. Aceste gene, ced-3, ced-4, ced-9 intalnite la C. Elegans au gene omoloage la mamifere. De exemplu, gena ced-9 are drept corespondent la mamifere gena bcl-2 care la randul ei apartine unei familii de gene. Produsii acestor gene, la mamifere, regleaza canalele transmembranare inhiband sau exacerband apoptoza. Gena ced-3 este omologa unei familie de gene, ICE, CPP 32, NEDD 2 care codifica o serie de proteaze numite caspase cu rol de enzime efectoare. Gena ced-4 codifica o serie de factori activatori ai apoptozei (Apaf) de fapt activatori ai caspazelor.
De la C. elegans la mamifere
Corespondenta (omologia) intre genele implicate in procesul de apoptoza la C. elegans si mamiferele superioare a putut fi demonstrata prin actiunea antiapoptotica a proteinei p53. Aceasta, printr-un mecanism necunoscut blocheaza genele care sunt implicate in apoptoza atat la C. elegans cat si la om. Faptul arata ca programul genetic al apoptozei s-a mentinut aproape intact in cursul dezvoltarii filogenetice, ceea ce demonstreaza importanta sa deosebita.
Declansarea proceselor biochimice apoptotice, procese active care se fac cu consum de energie pe intreaga perioada a ciclului celular, duce la aparitia unor modificari morfologice celulare definitorii pentru apoptoza. Ulterior se instaleaza moartea celulara.
Celulele care au murit prin intermediul apoptozei pastreaza aceste modificari morfologice pana cand sunt fagocitate de macrofage sau de celulele vecine si degradate de sistemul lizozomal al acestora.
Aceste modificari morfologice pot fi identificate prin metode histologice sau imunohistologice. Modificarile morfologice se instaleaza treptat, dar in final cuprind intreaga celula. Este important faptul ca in cursul desfasurarii apoptozei se pastreaza integritatea celulara, integritatea si functionalitatea citomembranelor fara eliminarea continutului celular, ceea ce face imposibila lezarea celulelor vecine si declansarea unei reactii inflamatorii la nivelul tesutului unde are loc apoptoza. In cursul necrozei are loc o distrugere directa, neselectiva a membranelor celulare. Ceea ce ramane intact in necroza este nucleul (in cazul in care nu este de asemenea distrus direct).
Astfel, membranele plasmatice devin in apoptoza, zbarcite, cu numeroase adancituri realizand un aspect veziculos, dar intacte. Are loc o diminuare a volumului celular cu condensarea marcanta a citoplasmei si a nucleului, dar cu mentinerea aparent normala a organitelor celulare. Nu s-au semnalat pana in prezent modificari specifice ale organitelor citoplasmatice in cursul apoptozei. O explicatie simpla a reducerii volumului celular ar fi pierderea de apa si de diversi ioni, mentinandu-se o osmolaritate relativ normala. Pastrarea integritatii membranelor celulare si a reticulului endoplasmic este necesara pentru a mentine posibilitatea desfasurarii activitatii enzimatice "caracteristice" a apoptozei care ar putea fi perturbata de o eventuala liza a membranelor, si de eliberarea sau activarea unor enzime care ar duce la blocarea apoptozei. In acest caz, s-ar putea instala moartea celulara, fara modificarile morfologice tipice apoptozei ceea ce ar avea ce urmare imposibilitatea ca aceste celule sa fie eliminate de celulele fagocitare sau de celulele vecine.
Pierderea de apa, ca si integritatea relativa a membranelor nu este urmata de pierderea de proteine, contribuind la mentinerea echilibrului osmotic si la posibilitatea de desfasurare a proceselor biochimice specifice apoptozei.
Pierderea apei intracelulare are ca urmare condensarea citoplasmei si modificari ale marimii si formei celulei. celulele de obicei rotunde devin mult mai mici, alungite sau de forme neregulate.
Prima modificare observabila o data cu declansarea apoptozei o reprezinta condensarea cromatinei care formeaza mase dense, compacte, de forma concava sau hemisferica adiacente partii interne a membranei nucleare. Este un proces care se instaleaza gradat, in paralel cu aparitia unui caracter osmofilic al cromatinei, ceea ce are ca rezultat ocuparea unei parti insemnate a periferiei nucleului de catre aceste mase de cromatina. Cromatina nucleolului se disperseaza formand agregate osmofile dispuse in centrul acestei formatiuni. De asemenea, miezul fibrilar apare de obicei in opozitie cu suprafata cromatinei nucleare. Aceste mase de cromatina ale nucleolului se pot dezintegra si da nastere la fragmente mai mici, unele devenind mai putin osmofile. Se considera ca acestea ar contine zone mai bogate in proteine. In final, nucleul apare ca format din fragmente granulare condensate ce grupeaza atat fragmente de ADN cat si proteine matriceale.
In culturile celulare, acest proces este evidentiat prin pierderea contactului cu celulele vecine, timp in care orice structura specializata de la suprafata celulei dispare (exemplu microvilii), iar la suprafata membranei celulare incep sa apara circumvolutiuni urmate de pierderea apei, a electrolitilor si a blocarii sistemului de transport Na+, Cl-, si K+.
Astfel, celula apare la microscopul optic mai mica mai densa, cu un nucleu picnotic, cu mase dense de cromatina, eozinofile. Fata de necroza, picnoza este un element relativ timpuriu in apoptoza, iar forma si rezultatul modificarilor structurale ale cromatinei sunt net diferite intre cele doua tipuri de moarte celulara. Condensarea cromatinei reprezinta un aspect important al apoptozei. Cu toate acestea, s-a demonstrat ca exista o condensare normala a cromatinei in cursul mitozei. In apoptoza are loc o condensare rapida a heterocromatinei care este rapid degradata de endonucleaze in fragmente de ADN de aproximativ 180-200 pb tipice procesului de apoptoza.
Circumvolutiunile membranei nucleare ca si ale membranelor plasmatice intracelulare apar concomitent cu condensarea cromatinei nucleare dand aspectul vezicular al suprafetei acestor membrane.
Celulele zbarcite incep sa isi conflueze invaginarile membranare intracelulare situate in vecinatate incluzand portiuni celulare mai mici. Concomitent cu acest proces apare ruperea nucleului in fragmente mai mici care contin cromatina condensata si sunt acoperite cu o membrana formata din doua straturi care apar in urma procesului de separare a veziculelor. Dupa Darzynkiewicz membrana nucleara este degradata si dezintegrata proteolitic iar nucleul se fragmenteaza. Fragmentele nucleare care contin resturi internucleosomale de ADN sunt imprastiate in citoplasma si impreuna cu parti citoplasmatice si organite intacte formeaza corpi apoptotici. Aceste structuri nou formate se detaseaza de celula moarta printr-un proces denumit "inmugurire". Odata cu inceperea formarii veziculelor pot aparea si modificari structurale ale membranelor intracelulare si celulare. Aceste modificari membranare, atat morfologice cat si biochimice permit recunoasterea lor de catre fagocite sau de catre celulele invecinate in vederea fagocitarii. Organitele celulare sufera putin in urma declansarii procesului apoptotic, fiind inglobate in final in corpii apoptotici. In general, celula compacteaza aceste organite aparand uneori o dilatare a reticulului endoplsmic si o dezagregare a polizomilor. Aceste modificari ale organitelor celulare nu se intalnesc obligatoriu la toate celulele intrate in apoptoza.
Modificari morfologice in apoptoza
|
1 Incretirea suprafetei celulare Scaderea volumului celular si modificari ale formei celulei Conservarea cromatinei nucleare -pierderea vizualizarii structurii nucleare -hipercromicitatea ADN Disparitia anvelopei nucleare Fragmentarea nucleara Pierderea structurilor de pe suprafata celulei(pseudopode, microvili) Condensarea citoplasmei Formarea corpilor apoptotici Detasarea celulelor in culturi Fagocitoza corpilor apoptotici |
Corpii apoptotici reprezentand structuri neviabile care rezulta in urma apoptozei, ajung in spatiul intercelular persista putin, cateva minute sau maxim o ora deoarece sunt fagocitati de macrofage sau de celulele vecine si degradati dupa fagocitare de aparatul lizozomal. Deci, corpii apoptotici sunt fagocitati atat de macrofage (celulele specializate in fagocitoza) cat si de celulele invecinate celulelor ce intra in apoptoza, (celule de origine epiteliala sau fibroblastica ce nu sunt specializate pentru fagocitoza) fara sa existe reactie inflamatorie. Pare interesant ca fagocitele nu raspund la mediatorii inflamatiei dupa ce au fagocitat sau degradat un corp apoptotic.
Modificarile nucleare descrise par cele mai importante modificari morfologice din apoptoza. Acestea sunt insotite de fragmentari aparent aleatoare ale moleculelor de ADN. Fragmentarea are loc intre nucleosomi, avand drept rezultat o celula care contine peste un milion de fragmente relativ egale ,care nu mai pot fi reparate.
Clivarea ADN la nivelul filamentelor internuclosomale nu este propriu sau definitoriu pentru apoptoza.
Apoptoza tipica se poate desfasura in unele celule si in absenta acestui tip de clivaj,cu modificari nucleare tipice. Exista si situatia inversa in care acest tip de clivaj este intalnit intr-o serie de procese necrotice (necroza hepatica indusa la soarece prin tratament cu paracetamol).
Cu toate acestea, fragmentarea internucleosomala este considerata un marker important in apoptoza .
Degradarea ADN este un eveniment major in derularea apoptozei, insa s-a observat ca oprirea transcriptiei nu este urmata de o moarte rapida a celulei prin apoptoza, ceea ce sugereaza ca ar mai putea interveni si alte procese.
Mitocondria este implicata esential in procesele morfologice care au loc in procesul apoptozei. Membrana mitocondriala este tinta si locul de actiune al proteazelor pro si antiapoptotice din familia Bcl-2. Aceste proteine fie ca sunt pro sau anti apoptotice printr-o serie de reactii induc scaderea potentialului membranar mitocondrial si eliberarea citocromului c in citosol. Toate aceste evenimente duc la eliberarea enzimelor efectorii ale apoptozei. De asemenea, alterarea membranei mitocondriale, datorata unor cauze diverse, poate sa fie un element declansator al enzimelor efectorii ale apoptozei atat la nivelul citoplasmei cat si al endonucleazelor din nucleu.
Mitocondria intra ca si alte organite citoplasmatice in procesul de comprimare a citoplasmei, care duce la formarea corpilor apoptotici. Datorita rolului important pe care il are mitocondria in declansarea procesului de apoptoza pare foarte interesant de privit acest proces prin prisma teoriei care sustine ca mitocondria a fost la origine o bacterie anaeroba, care a fost captata de celula eucariota cu care traieste intr-un tip special de simbioza.
Etapele apoptozei
Initierea apoptozei intr-o anumit celula este indusa de o varietate de semnale din mediul intern al celulei, precum si din mediul extern.
Acest proces se desfasoara prin actiunea unor substante celulare extrem de variate, cu rol de transductor, dar mecanismul procesului nu este in intregime cunoscut. In general, aceste substante transmit semnale de la nivelul receptorilor membranari la structurile efectoare ale apoptozei, in principal, din nucleul celular.
In general, procesul de desfasurare a apoptozei poate fi impartit in trei faze: faza de initiere, faza de executie si faza de degradare.
In etapa de initiere (reversibila), foarte eterogena, secventa de evenimente biochimice depinde de stimulul initiator al apoptozei, mesagerii secunzi se acumuleaza in celula si in final vor actiona asupra mitocondriei.
Etapa de executie (reglatoare) este comuna la toate tipurile de apoptoza (indiferent de stimulul initiator) si in timpul careia celulele integreaza diferitele informatii, dupa care « decide » sinuciderea ; aceasta etapa odata depasita moartea va fi inevitabila.
Etapa de degradare (ireversibila) este cea in care celulele executa «sentinta» activand hidrolaze catabolice, in principal, caspaze ( cysteinyl aspartate specific proteinases, proteaze specifice apoptozei care cliveaza substratul dupa resturi aspartat) si nucleaze, DNA nucleaze, care vor decupa cromatina in fragmente de masa moleculara mare si apoi in oligonucleozomi. Aceste cascade catabolice sunt asociate cu modificari morfologice specifice la nivel citoplasmic (dezorganizarea citoscheletului si a reticulului endoplasmic) si nuclear: condensarea cromatinei si dezorganizarea nucleolilor. Un alt aspect important al fazei de degradare consta in pierderea asimetriei lipidice a membranei plasmatice ce va fi utilizat ca sistem de recunoastere de catre fagocite a caror misiune este de a elimina celulele apoptotice inainte de a suferi necroza secundara si de a declansa reactii pro-inflamatorii. Una din modificarile precoce ale mortii celulare programate este translocarea fosfatidilserinei (PS) de pe fata interna catre fata externa a membranei plasmatice, implicarea ionilor de calciu mitocondriali in miscarile « flip-flop » ale translocazelor calciu dependente. Acest proces are un rol important in recunoasterea acestor celule in apoptoza de catre macrofagele active, in vederea eliminarii lor.
Numerosi stimuli sunt capabili de a induce moartea celulara: stimuli fizici (raze X, UV, etc), chimici (de ex : etoposid) si biologici . Printre factorii biologici se enumara reglatori ai expresiei genice (precum NF-kB) si ai proliferarii celulare (de exemplu oncoproteina c-Myc), receptori membranari (in special receptorii mortii Fas si TNF), molecule implicate in mentinerea integritatii genomului (de ex : p53) sau toxine de origine microbiana.
Exista o familie de receptori specializati in inducerea mortii celulare programate; receptori ai mortii ce apartin familiei de receptori TNF-R. Odata stimulati, acesti receptori induc activarea caspazelor.
Privita in ansamblu, apoptoza apare nu numai ca un proces care implica o singura celula ci si celulele invecinate celei in care s-a declansat efectiv procesul, atat in faza de initiere prin semnalele proapoptotice emise de celulele din jur cat si in faza finala, dupa moartea celulei. Odata procesul apoptotic incheiat cu formarea modificarilor morfologice tipice si moartea celulei, are loc ingestia celulei apoptotice/corpilor apoptotici de catre fagocite, sau in unele cazuri chiar de catre celulele invecinate daca acestea au capacitate de fagocitoza. Important este faptul ca ingestia se face fara a se produce leziuni in celulele vecine si fara declansarea unui proces inflamator. Este vorba despre o eliminare a corpilor apoptotici fara a perturba activitatea si arhitectura tesutului respectiv.
Se pune problema cum recunosc fagocitele corpii apoptotici, aspect deosebit de important pentru realizarea functiei lor. Modificarile morfologice ce apar la nivelul celulelor ce finalizeaza apoptoza par sa ofere raspunsul. Astfel, au loc modificari ale carbohidratilor membranari, precum si ale altor molecule membranare. Fosfatidilserina (orientata catre fata interna a membranei celulare in celule vitale devine expusa la suprafata membranei in stadiile timpurii ale apoptozei) ar putea juca un rol important in recunoasterea celulelor apoptotice de catre macrofage.
In final, se poate spune ca sfarsitul unui proces de apoptoza declansat la nivelul unei celule are ca rezultat nu numai moartea celulei dar si disparitia ei completa, fapt ce nu afecteaza in conditii normale fiziologia celulelor din jur.
Familia Bcl-2
Oncogenele bcl2 au fost identificate initial in celulele tumorale ale limfoamelor B umane, ulterior fiind identificate si in alte tipuri de cancere.
Denumirea de Bcl-2 este data de aceasta prima identificare in limfoamele cu celule B. In cazul acestor limfoame, apar o serie de translocatii cromozomale, iar bcl-2 a fost identificata la nivelul punctului de rupere al translocatiei al regiunii cromozomiale 18q21, ceea ce face ca gena Bcl-2 sa se plaseze in apropierea factorului de elongatie, a locusului lantului greu al imunoglobulinelor la 14g32, rezultand o exprimare dereglata a proteinelor in celulele B.
Experimental, s-a demonstrat ca celulele B imature in lipsa IL-3 mor prin apoptoza. In cazul unei functionalitati normale a genelor bcl-2, celulele B rezista la apoptoza chiar in absenta IL-3, sugerand faptul ca aceste gene blocheaza apoptoza. Acest experiment demonstreaza atat rolul genelor, cat si faptul ca dezvoltarea tumorala depinde nu numai de scaparea de sub control a cresterii celulare, dar si de posibilitatea de a preveni apoptoza indusa de alti stimuli.
Cercetarile ulterioare au aratat ca genele bcl-2 sunt de fapt capul de serie a unei numeroase familii de gene, in care unii membrii au rolul de a inhiba apoptoza, iar altii de a exacerba acest proces.
La mamifere, aceasta familie de gene cuprinde: bcl-2, bcl-XL, mcl-1, a1, bcl-w, bax, bak, bad, nbk/Bik. La virusuri, se intalnesc urmatoarele gene din aceasta familie: ASFV, LMW-5, EBV, BNRF-1, HVS, ORF 16, E1B19K (adenovirusuri), iar la nevertebrate genele CED .
Deficienta sau blocarea acestor gene indusa experimental la soarece a urmarit sa evidentieze o serie de particularitati de functionare ale acestor gene.
DESFASURAREA APOPTOZEI
![]()
![]()
![]() ABSENTA FACTORILOR
ABSENTA FACTORILOR
ACTIVAREA PROTEZELOR (ICE) SEMNAL MORTII
DE CRESTERE
CELULAR
![]()
![]()
![]()
![]()
![]() P53
P53
PERTURBAREA
METABOLISMULUI SI A CICLULUI CELULAR
![]() ALTERAREA
ALTERAREA
GENE PROAPOPTOTICE (BAX)
ADN
FAGOCITOZA CORPILOR APOPTOTICI

Astfel, deficienta in Bcl-2 sau Bax nu influenteaza dezvoltarea embrionara, iar la soarecii la nastere sunt normali. Insa, moartea survine la acesti soareci datorita unor dezvoltari deficiente aleunor organe dupa nastere cum ar fi involutia timusului si a splinei, scaderea numarului de limfocite T si B prin apoptoza, perturbari ale dezvoltarii renale (boala rinichiului polichistic ). Nefunctionalitatea genei bcl-XL perturba ireparabil dezvoltarea embrionara, ducand la moartea embrionilor, inspecial prin apoptoza celulelor sistemului hematopoietic si al neuronilor.
Deficienta genelor Bax conduce la hiperplazia limfoida si sterilitate prin perturbari ale spermatogenezei si atrofie testiculara.
Familia de gene Bcl-2 codifica proteine de 25-26 kD, cu o structura relativ comuna, care explica in mica masura modul de actiune al acestor proteine in cursul apoptozei. Aceste proteine prezinta un capat C terminal necesar pentru insertia de membrana. Insertia pe diverse membrane intracelulare este asociata cu capacitatea Bcl-2 de a influenta dezvoltarea apoptozei.
Din punct de vedere al functiilor biologice, membrii familiei Bcl-2 sunt clasificati in doua clase:
- proteine anti-apoptotice: Bcl-2, Bcl-XL, Bcl-w, Mcl-1.
- proteine pro-apoptotice: Bax, Bad, Bak, Bos, Bcl-XS, Bik, Bim, BNIP3.
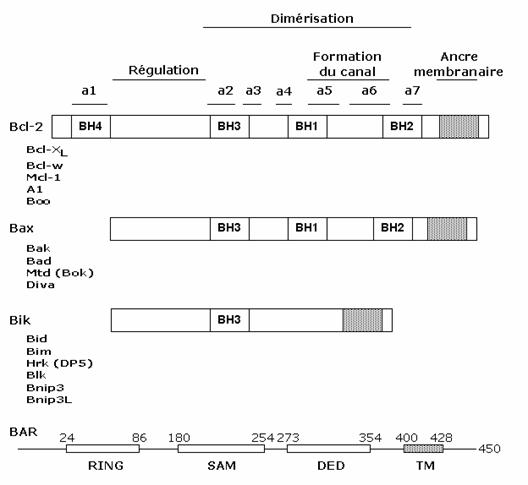
Figura: Reprezentarea schematica a membrilor familiei Bcl-2
Deosebit de importante sunt in structura proteinelor codificate de aceste gene regiunile de interactiune a acestor proteine cu alte proteine. Au fost identificate pana in prezent patru astfel de domenii BH (Bcl-2 homology domain): BH1, BH2, BH3, BH4.
Distributia acestor domenii permite gruparea acestei familii in 3 clase:
membrii anti-apoptotici precum Bcl-2, Bcl-XL, Bcl-w, Mcl-1 si Boo prezinta homologie intre secventele domeniilor BH1, 2, 3 si 4.
membrii anti-apoptotici precum Bax, Bak, Bad, Bok, Diva prezinta homologie intre secventele domeniilor BH1, 2 si 3.
Membrii care nu au decat un singur domeniu, BH3. Ele sunt proteine anti-apoptotice precum Bik, Bim, Bik, Bid, Hrk si BNIP3.
Domeniul BH1 (intre aminoacizii 136 si 155) si domeniul BH2 (intre 187 si 202) au fost definite ca secvente omologe pentru interactiunea proteina/proteina, intre proteinele codificate de familia de gene bcl2. Substitutia unor aminoacizi la nivelul acestor domenii, de exemplu substitutia Gly 145 in BH1 sau Trp 188 in BH2 duce la anularea capacitatii acestor proteine de a se cupla cu proteina codificata de Bax (heterodimerizare), dar nu au efect asupra homodimerizarii (1,2). Aminoacizii cu rol critic pentru functionarea Bcl-2 nu sunt aceeasi cu cei esentiali pentru functionarea proteinelor Bcl-X1 (1,2).
Domeniul BH3 s-a descoperit demonstrandu-se omologia functionala (inhibitor al apoptozei ) si secventiala (unele secvente de aminoacizi) cu proteina E1B19K a adenovirusurilor.
Aceasta proteina virala interactioneaza si cu Bcl-2 si cu proteinele codificate de bax. Interactiunea intre E1B19K si proteinele Bax se face printr-o secventa de 28 aminoacizi, secventa deosebita de domeniile BH1 si BH2. Regiunea BH3 din proteinele Bax si Bak este suficienta pentru ca acestea sa se cupleze cu regiunile omoloage de pe Bcl-2 si Bcl-X1.
In general, domeniile mentionate sunt conservate si deci prezente in structura maim multor proteine codificate de genele familiei bcl-2. Domeniul intalnit la toate proteinele codificate de aceste gene, cunoscute pana in prezent, este domeniul BH3. Tot prin intermediul acestui domeniu exista numeroase interactiuni intre proteinele codificate de aceste gene, domeniul BH3 avand de cele mai multe ori un rol principal, mai ales ca promotor al apoptozei. Astfel, BH3 din structura proteinei Bak se poate lega de Bcl-2 si induce apoptoza., la fel ca si Nbk/Bik (care contine un domeniu BH3 ) care poate lega Bcl-2 si E1B19K si induce apoptoza. Astfel se naste ipoteza ca moleculele produse de Bcl-2 sunt molecule efector, avand rol antiapoptotic, rol care este antagonizat de proteinele care contin domeniul BH3.
Existenta in structura proteinelor codificate de familia de gene bcl-2, regiuni cu un mare grad de similitudine respectiv domeniile BH1, BH2, BH3 care face posibila dimerizarea si heterodimerizarea acestor proteine. Se considera ca interactiunea heterodimerica este posibila in prezenta oricaruia dintre domeniile: BH1 si BH2 sau intre un domeniu BH3 si o secventa necunoscuta. Homodimerizarea si heterodimerizarea acestor proteine este un moment esential in blocarea raspunsului la stimulul apoptotic.
In cadrul familiei de gene bcl-2 exista gene care inhiba apoptoza cum ar fi: genele propriu-zise bcl-2 si bcl-XL si alte gene care promoveaza apoptoza respectiv genele bax, bik si bcl-Xs.
Esential pare raportul intre produsii genelor bax si bcl-2. Supraexpresia proteinelor codificate de bax accelereaza declansarea apoptozei la o serie de stimuli cum ar fi factorii de crestere, iradiere, administrarea de glucocorticoizi. Bcl-2 si Bax pot forma heterodimeri si supraexpresia unuia antagonizeaza efectul celorlalte. Interactiunea proteina/proteina si balanta intre nivelele de exprimare a celor doua proteine influenteaza decizia celulei de a intra in procesul de apoptoza. Este esentiala omologia domeniilor BH1,BH2 si BH3 la proteinele codificate de aceste gene, indiferent daca ele sunt proapoptotice sau antiapoptotice .
Unul din modurile de activare a genelor bcl-2 este apropierea acestor gene de locusul factorului de elongatie a lanturilor grele ale imunoglobulinelor. Acest eveniment se intampla in momentul translocatiei, intalnita in principal la limfoamele foliculare la nivelul cromozomului 18.
Se considera ca proteinele codificate de genele bcl-2 produse in limfoamele foliculare sunt identice cu proteinele codificate de aceste gene in mod normal .
Genele bcl-XL sunt considerate ca si genele bcl-2 gene antiapoptotice. In afara de acest efect, genele bcl-XL sunt necesare pentru dezvoltarea embrionara .
Proteinele codificate de genele bcl-XL prezinta o structura tridimensionala, care consta in afara de domeniul de prindere membranara, in doua helixuri centrale hidrofobe, inconjurate de 5 helixuri amfipatice (97). Se considera totusi ca structura tridimensionala a Bcl-XL nu este compacta, evidentiindu-se prezenta unei bucle hidrofobe la suprafata proteinei, formate partial din domeniile: BH1, BH2, BH3
Domeniile BH1, BH2 si BH3 au aceeasi importanta in realizarea efectului antiapoptotic al acestor proteine, ca si in cazul proteinelor codificate de bcl-2. Astfel mutatiile intalnite la nivelul acestor domenii duc la pierderea efectului antiapoptotic al proteinelor respectiv pierderea capacitatii de heterodimerizare cu proteinele proapoptotice, codificate de genele bak sau bax. De exemplu, substitutia glicinei in pozitia 148 sau 187 duce la pierderea completa a interactiunii Bcl-XL sau Bax si pierderea capacitatii antiapoptotice. Se pare ca Bcl-XL blocheaza apoptoza nu numai prin interactiune cu Bax dar si prin alte mecanisme. De asemenea secventele de aminoacizi absolut necesare ale Bcl-XL nu sunt aceleasi cu ale Bcl-2.
Studiile structurale au aratat ca Bcl-XL poseda un domeniu transmembranar la capatul C-terminal esential in mecanismul de actiune al acestei proteine. Acest domeniu de insertie, ca si structura spatiala seamana cu domeniul de insertie membranar identificat la toxinale bacteriene, respectiv la toxina difterica.
Acest domeniu de insertie membranara contine doua helixuri centrale, formate din reziduuri apolare si sunt suficient de lungi pentru a patrunde in membrana. Ca si Bcl-2 si Bcl-XL poate forma pori la nivelul zonei unde se localizeaza pe membrana .
Proteinele Bax
Se cunosc destul de putine date despre aceste proteine, desi se gasesc ca si proteinele bak exprimate intr-o mare varietate de tesuturi. Aceste proteine pot sa formeze heterodimeri cu proteinele Bcl-2 iar din raportul acesta rezulta inducerea sau neinducerea apoptozei dupa actiunea stimulilor proapoptotici. Astfel, cresterea cantitatii de homodimeri bax-bax in detrimentul Bax-Bcl-2 heterodimeri , duce la apoptoza, in timp ce o cantitate crescuta de homodimeri Bcl-2-Bcl-2, fata de heterodimerii Bcl-2-Bax conduce celula spre supravietiure (6,10).
Proteinele codificate de genele bax contin ca si celelalte proteine codificate de familia de gene Bcl-2 cele 3 domenii BH1, BH2 si BH3 care permit homodimerizarea sau heterodimerizarea, la carea se adauga domeniul transmembranar dinspre capatul C-terminal. Structural se considera ca bax este omoloaga in proportie de 45% cu Bcl-2
Ca si in cazul proteinelor Bcl-2, mutatiile in domeniile BH ale proteinei Bax duc la incapacitatea acesteia de a forma dimeri sau heterodimeri cu proteinele Bcl-2. Proteinele Bax se localizeaza la nivelul membranelor mitocondriale si pot realiza canale dependentede pH, producand un flux pasiv de ionisi mici molecule prin membrana mitocondriala. In formarea canalelor ionice in membrana mitocondriala, proteinele Bax coopereaza cu o proteina ANT cu rol putin cunoscut
Inducerea apoptozei de catre radioterapie a fost asociata cu cresterea expresiei de proteine Bax intr-o serie de cancere cum ar fi cel pulmonar sau de col uterin. Totodata, iradierea tesuturilor considerate radiorezistente nu induce cresterea expresiei de proteine Bax. Mutatiile genelor bax s-au intalnit intr-o serie de cancere cum ar fi cancerul gastric, endometrial si de colon.
Proteinele Bak
Reprezinta un alt grup de proteine cu efect proapoptotic si prin analize genetice s-a putut demonstra ca exista 3 genece codifica proteinele Bak.
Gena bak1 este localizata pe cromozomul 6, bak2 pe cromozomul 20 si gena bak3 pe cromozomul 11. Utilizandu-se studiul expresiei ARNm al genelor bak in diverse tesuturi, s-a descoperit prezenta sa in tesutul cardiac, muschii scheletici, ficat, pancreas si rinichi. De asemenea, ARNm al genelor bak a fost evidentiat in toate regiunile sistemului nervos central
Proteinele codificate de genele bak au o structura asemanatoare cu structura proteinelor Bcl-2 si a celorlalti membrii ai acestei familii. In cazul domeniilor BH1 si BH2 exista o similitudine de 53% in ceea ce priveste secventa aminoacizilor intre proteinele Bak si Bcl-2.
In general, intre proteinele Bcl-2, Bcl-XL si Bax exista o identitate de 25%, 22% si respectiv de 19%
Structura spatiala a proteinelor Bak este asemanatoare cu a proteinelor Bcl-2 prezentand asemenea Bcl-2 la capatul C-terminal un domeniu hidrofob transmembranar, indicand faptul ca aceste proteine se pot integra in membrane.
S-a demonstrat ca produsii genelor bak au o actiune clar proapoptotica. O serie de experimente vin insa sa confirme acest rol. Astfel, in cultura de fibroblaste in absenta serului, daca se induce expresia genelor bak, printr-un procedeu oarecare, celulele mor rapid prin apoptoza. Moartea celulara prin apoptoza este considerabil redusa sau intarziata, daca in aceeasi cultura se adauga ser, respectiv citokine. Deci, citokinele serice pot atenua efectul proteinelor Bak. De asemenea, o serie de gene cum ar fi: c-myc, c-fox, E2F, ele pot conduce culturile de fibroblaste in conditiile absentei serului spre apoptoza, dar proteinele Bak induc apoptoza fara insa ca aceasta sa fie acompaniata de progresia in ciclul celular. Exista o similitudine intre actiunea genelor bak si bax in a antagoniza efectul genelor bcl-2.
Forma scurta a bcl-x (bcl-xs) poate de asemenea abroga functiile genelor bcl-2 dar bcl-xs singura nu accelereaza producerea apoptozei sub efectul citokinelor cum se intalneste la bak si bax, mai ales ca proteinele Bcl-xs nu au foarte multe secvente omologe in domeniile BH1 si BH2 cu domeniile Bcl-2
|
Desi au acelasi tip de actiune, Bak si Bax au o structura mult mai diferita intre ele decat au proteinele Bak si Bcl-2 sau Bcl-XL, care au functii contrare respectiv pro- si antiapoptotice. Nu se cunosc pana in prezent care ar fi elementele care ar separa proteinele Bak de Bax.
Un comportament interesant il au proteinele Bak fata de proteinele E1B19K produse de adenovirusi. Aceasta proteina poate inhiba apoptoza declansata de TNF alfa, FAS si lipsa factorului de crestere a nervilor, fara a se cunoaste bine mecanismul de activare, comportandu-se practic ca si Bcl-2. Proteinele Bak se pot cupla cu aceasta proteina virala si astfel favorizeaza sau accelereaza apoptoza
Mecanismul de actiune al proteinelor Bak este inca la nivelul ipotezelor. Se considera ca proteinele Bax interactioneaza cu proteinele Bcl-2 si in special cu Bcl-XL avand deci rol proapoptotic .
Alte studii, folosind alte sisteme celulare ca baza experimentala au aratat ca Bak nu dimerizeaza cu Bcl-2, Bcl-Xs sau Bax sugerand faptul ca Bax poate induce apoptoza in absenta interactiunilor cu membrii familiei Bcl-2, interactionand cu un partener necunoscut. De asemenea, se considera ca proteinele Bak ar interactiona direct cu proteinele implicate in procesele antiapoptotice sau chiar ar activa caile proapoptotice.
Proteinele Bad
Ca si in alte cazuri, se cunosc putine date despre aceste gene cu rol proapoptotic care fac parte din familia Bcl-2. Ca si in cazul genelor bak sau bax s-au descoperit si studiat proteinele codificate de aceste gene; date efective despre aceste gene sunt inca in curs de acumulare.
Proteinele codificate de genele bad prezinta un numar de 204 aminoacizi avand o greutate moleculara de 221 kD.
Exista o similitudine mult mai mica intre proteinele Bad si Bcl-2 decat intre proteinele Bcl-2 si alte proteine codificate de genele apartinand familiei Bcl-2 (Bcl-XL, bax, bak).
Proteinele Bad poseda domeniile BH1 si BH2 cu un grad relativ mare de identitate, putand dimeriza cu membrii familiei de proteine Bcl-2. Insa, proteinele Bad nu poseda domeniul de ancorare de la capatul C-terminal care se intalneste constant la ceilalti mambrii ai familiei de proteine Bcl-2. Absenta acestui domeniu conduce la ideea ca aceasta proteina nu se poate integra in membrane. Astfel este posibil ca modul de actiune al proteinelor Bad sa fie dat de ancorarea lor de proteinele citoplasmatice, conectand programul genetic de inducere a apoptozei prin alte procese celulare.
Proteinele Bad au capacitatea de a dimeriza cu proteinele Bcl-2 si Bcl-XL. S-a demonstrat ca proteinele Bad au afinitatea mult mai mare pentru proteinele Bcl-XL decat pentru proteinele Bcl-2. De asemenea, s-au evidentiat prin studii de imunoprecipitare numai dimeri Bad/Bcl-XL si Bad/Bcl-2 dar nu si heterodimeri. S-a semnalat si formarea unor complexe intre Bad si Bax care interactioneaza cu proteinele Bcl-2 si Bcl-XL
Se pare ca exista o simpla competitie in care Bad se leaga de Bcl-XL ceea ce duce la formarea de heterodimeri Bax prin absenta proteinelor Bcl-2. Cu cat exista o concentratie mai mare de heterodimeri Bax fata de homodimeri Bax cu atat celulele sunt mai sensibile la inducerea apoptozei. Totusi, nu se cunoaste cu certitudine daca homodimerii Bax-Bax sunt partea cea mai activa in interactiunea cu caile efectoare ale apoptozei sau heterodimerii Bcl-2/Bax sau Bcl-XL/Bax
Este posibil ca proteinele Bad sa nu actioneze singure, ci numai ca antagonist al efectelor proteinelor Bcl-XL prin sechestrarea acestei proteine prevenind formarea de heterodimeri de tipul Bcl-XL/Bax. In cazul acestei ipoteze, proteinele Bad ar avea rol direct in supresia apoptozei . Astfel, cand Bad dimerizeaza cu Bcl-XL, Bax este liber si celula are mari sanse de a intra in apoptoza, iar heterodimerizarea Bax inhiba apoptoza .
Mecanismul de actiune al proteinelor familiei Bcl-2
Actual este cert ca marea familie de proteine Bcl-2 joaca un rol major in reglarea apoptozei. Membrii familiei Bcl-2 exercita doua functii esentiale: pe de o parte, ei participa la formarea porilor ce regleaza trecerea ionilor si a numeroase substante activatoare ale apoptozei si , pe de alta parte, moduleaza functia moleculelor reglatoare ale apoptozei prin intermediul interactiilor proteina-proteina.
Mecanismul de reglarea activitatii a acestor proteine este deosebit de complex si se poate realiza prin dimerizare si prin fosforilare.
O caracteristica importanta a membrilor familiei Bcl-2 este datorata de capacitatea de a forma homo sau heterodimeri.
Interactiunea directa intre proteinele Bcl-2 este datorata in special domeniilor omologe foarte bine conservate la toti membrii acestei familii, care permit oligo- si heterodimerizarea lor prin interactiuni de tip proteina/proteina. Homodimerii proteinelor anti-apoptotice Bcl-2 sau Bcl-XL se formeaza prin intermediul domeniilor BH1 si BH2. Membrii pro-apoptotici ce contin domeniul BH-3 precum Bax sau Bak pot interactiona cu Bcl-2 sau Bcl-XL prin intermediul, de o parte, a domeniului BH-3 si pe de alta parte regiunii hidrofobe formate de domeniile BH-1, BH-2 si BH-3 din structura Bcl-2 si Bcl-XL. Se pare ca balanta dintre viata si moarte celulara este influentata de tipul si proportia dimerilor anti sau pro-apoptotici formati.
Prin heterodimerizarea unui membru al acestei familii se blocheaza actiunea acesteia, fie ca este pro- sau antiapoptotica. Un exemplu clasic il constituie heterodimerizarea proteinei Bax cu Bcl-2 sau Bcl-XL. Atunci cand jumatate sau peste jumatate din cantitatea de Bax existenta este heterodimerizata, apoptoza este inhibata. Mutantii proteici cu modificari minime in domrniile respective nu pot heterodimeriza. Pana in prezent nu se cunoaste nici o functie a heterodimerilor si nici nu se cunoaste daca heterodimerii formati dintr-o proteina proapoptotica cu una antiapoptotica ar avea vreo functie in cursul apoptozei.
De asemenea, se cunosc putine lucruri despre interactiunile intre aceeasi membri ai familiei Bcl-2 sau in ce masura dimerii sau heterodimerii ar avea alte proprietati comparativ cu molecula de baza. Oricum, interactiunea proteina/proteina intre doi membrii diferiti ai acestei familii pare sa-i inactiveze pe amandoi.
S-a stabilit ca fiecare membru al familiei Bcl-2 poate forma heterodimeri cu alti membrii ai familiei, dar nu se cunoaste cu exactitate daca toate aceste interactiuni au loc in toate celulele sau numai in anumite tipuri de celule.
Pare cert ca inducerea sau inhibitia apoptozei intr-o celula depinde de expresia sau interactiunea dintre membrii acestei familii de proteine la un anumit moment dat. Raportul intre homo- si heterodimeri pare a fi foarte important pentru desfasurarea sau blocarea apoptozei.
Urmarindu-se actiunea antiapoptotica a proteinelor Bcl-2 in celule in care s-a indus apoptoza prin medicamente s-a observat ca proteina Bcl-2 poate preveni apoptoza, dar nu poate preveni alterarile structurale produse. Deci, actiunea Bcl-2 s-ar limita numai la inhibitia apoptozei. De asemenea exista situatii cand Bcl-2 nu poate proteja celula de apoptoza. Spre exemplu, granzimele B induc apoptoza prin activarea uneia sau a mai multor caspaze. Aceasta cale pare sa fie independenta de actiunea Bcl-2 , dar pare foarte posibil ca unul dintre membrii familiei Bcl-2 sa blocheze aceasta cale. Este posibil ca membrii familiei Bcl-2 sa aiba actiuni complementare pro- sau antiapoptotice.
In plus de nivelele de expresie respective a fiecarui membru si de capacitatea lor
de a forma dimeri, actiunea acestei familii de proteine in viata celulara poate si de asemenea modulata prin modificari post-transcriptionale.
Exemplul caracteristic al acestui tip de reglare este dat de fosforilarea Bad in linii celulare dependente de factori de crestere. In prezenta interleukinei 3, IL-3, Bad este fosforilat la restul de serina din pozitiaia 136 de catre Akt kinaza. Aceasta fosforilare este realizata in prezenta unor factori de crestere, hormoni sau a forbol esterului. Ea antreneaza asocierea Bad cu o proteina citosolica 14-3-3. O data domeniul BH-3 eliberat din structura Bad, el poate intereactiona cu Bcl-XL blocand astfel actiunea lui protectoare. Tratamentul celulelor cu Taxol (agent chimioterapeutic) sau cu acid okadaic (inhibitor de fosfataze) permite fosforilarea unui rest de serina a Bcl-2 facand-o incapabila de a interfera in apoptoza. Raf1 ar putea fi serin/treonin kinaza responsabila de aceasta modificare si a fost demonstrat ca Raf1 si Bcl-2 pot interactiona. In plus, SAPK ca si proteinkinaza A dependenta de AMPc sunt implicati in fosforilarea Bcl-2.
Un mecanism de actiune al proteinelor codificate de familia de gene bcl-2 se refera la capacitatea acestor proteine de a forma pori sau canale la nivelul membranar.
Aceasta proprietate a fost sugerata de asemanarile de structura dintre proteinele unor toxine bacteriene cu aceasta proprietate si proteinele codificate de genele bcl-2. Structura tridimensionala a Bcl-XL, de exemplu, care contine un domeniu de insertie membranar format din doua helixuri centrale, din lanturi apolare suficient de lungi pentru a penetra membrana, se intalneste si la toxina difterica. Aceste doua helixuri, atat la proteina Bcl-XL cat si la unele toxine bacteriene se orienteaza perpendicular pe dublul strat lipidic.
Pierderea acestor doua helixuri duce la pierderea capacitatii de a forma structuri transmembranare in vitro si la pierderea efectului antiapoptotic al proteinelor Bcl-XL.
Modul concret de formare al acestor canale nu este in intregime cunoscut in ceea ce priveste proteinele Bcl-2 si Bcl-XL. Prin analogie cu alte canale de tip alfa helix, moleculele Bcl-2/Bcl-XL ar forma un inel in jurul lumenului. Nu se cunoaste cum sunt asamblate moleculele de Bcl-2 si Bcl-XL in structura acestor canale. Totusi, se considera ca desi portiunile din molecula Bcl-2 si Bcl-XL care contin alfa helixurile T si G sunt necesare pentru insertia acestor molecule in membrana, o parte a helixurilor cu lanturi hidrofe poate probabil sa se situeze la marginea lumenului.
Diametrul acestor canale pare sa varieze intre 20-300 picosiemens (pS). Canalele sunt de cele mai multe ori inchise deschizandu-se sporadic.
In general, capacitatea Bcl-2 si Bcl-XL de a forma canale depinde de proprietatile membranei pe care sunt atasate sau de interactiunea cu alte proteine care regleaza permeabilitatea membranei.
O importanta mare o prezinta si pH-ul. La un pH cuprins intre 4 si 7,2 canalele prezinta nivele diferite de conductanta care induc deschideri diferite ce influenteaza direct nivelul de transport prin canal. Se poate vorbi de o anume selestivitate a acestor canale, dependenta de mai multi factori inclusiv pH, care insa nu diferentiaza Na+ de K+ dar deosebesc Na+ de Ca2+. Oricum este valabila urmatoarea secventa privind selectivitatea ionica: Na+=K+>Ca2+>Cl-.
Aceste canale sau pori transmembranari formati prin intermediul proteinelor Bcl-2, Bcl-XL au capacitatea de a transporta prin membrana in special ioni, dintre care cel mai important este calciul si posibil si proteine. Proteinele Bcl-2, Bcl-XL se localizeaza pe partea interna a unor membrane intracelulare, cum ar fi membrana mitocondriala, a reticulului endoplasmatic si membrana nucleara.
Ca urmare a formarii acestor canale apar mai multe consecinte, in primul rand are loc o reglare a distribuirii calciului intre lumen si citoplasma. Pare o proprietate generala a proteinelor Bcl-2 si Bcl-XL de a influenta distributia calciului intre doua spatii biologice. Cel mai important efect pare sa fie formarea canalelor transmembranare la nivelul membranelor mitocondriale. Prin acestea se poate controla permeabilitatea membranelor mitocondriale, cu rol deosebit de important in apoptoza.
Rolul antiapoptotic al proteinelor Bcl-2 si Bcl-XL ar putea consta in inhibarea sau modularea acestui tranzit prin intermediul canalelor transmembranare. Se cunoaste ca supraexpresia proteinei Bcl-2 inhiba aceasta permeabilitate tranzitorie a membranei mitocondriale, in timp ce supraexpresia proteinelor Bax avand efect opus.
Este foarte important faptul ca alaturi de proteinele Bcl-2 si Bcl-XL, proteinele Bax pot forma canale transmembranare prin insertie in membranele de la nivelul mitocondriei si reticulului endoplasmatic. Diferenta intre canalele formate de Bcl-2 si Bax este posibil sa fie data de selectivitatea ionica sau chiar a acestor canale.
Actiunea proteinelor Bax de tip proapoptotic pare sa se realizeze la nivelul contactului direct cu proteinele antiapoptotice Bcl-2 si Bcl-XL producand heterodimeri Bcl-2/Bax si Bcl-x-Xl/Bax impiedicandu-se formarea de canale. O a doua alternativa de actiune pentru Bax ar fi formarea de canale asemanatoare cu cele formate de Bcl-2 si Bcl-XL, dar cu alt tip de selectivitate si cu rol proapoptotic.
Formarea de canale de catre Bcl-XL in special, dar si de proteinele Bcl-2 au o deosebita importanta cand se realizeaza la nivelul membranelor mitocondriale. Astfel, Bcl-XL are capacitatea de a modula in ansamblu homeostazia osmotica si electricaa mitocondriei. De exemplu, Bcl-XL poate modula fluxul calcic si acumularea de ioni de hidrogen in spatial intermembranar sau poate inhiba o serie de proteine care pot aduce alterari ale functiei mitocondriale.
Exista o cooperare si cu alte proteine membranare formatoare de canale transmembranare, cum ar fi proteinele ANT.
Actiunea antiapoptotica a Bcl-XL este mai complexa. Un alt mod de a proteja celulele de a intra in apoptoza il reprezinta proprietatea acestei proteine de a impiedica hiperpolarizarea membranei mitocondriale si balonizarea mitoconriilor.Se poate spune ca proteinele Bcl-2 si Bcl-XL au o actiune antiapoptotica la nivelul mitocondriei, impiedicand alterarea homeostazei mitocondriale. Bcl-XL poate preveni rupturile membranei mitocondriale independent de capacitatea acestor proteine de a inhiba activitatea caspazelor.
Actiunea Bcl-XL de a mentine homeostaza mitocondriei pare sa fie realizata prin cresterea eficientei fosforilarii oxidative. Functia protectiva a Bcl-XL se poate realiza si in mitocondriile care si-au pierdut ADN-ul, dar aceasta functie necesita in multe cazuri cooperarea cu proteinele ce regleaza permeabilitatea membranei mitocondriale. Efectele pe care le induc Bcl-XL si Bcl-2 la nivelul mitocondriei par sa sugereze ca rolul antiapoptotic al acestor proteine ar fi dat de actiunea lor asupra mitocondriei. Mitocondria reprzinta organitul celular prin care Bcl-2 si Bcl-XL isi manifesta functiile antiapoptotice.
O problema importanta care apare in descrierea modului de actiune a proteinelor familiei Bcl-2 este relatia acestora cu proteinele efectorii ale apoptozei, respectiv caspazele. Se cunosc putine date despre aceasta relatie, dar se stie ca proteinele Bcl-2, Bcl-XL si E1B19K, in general modeleaza activarea caspazelor .
S-a demonstrat ca supraexpresia proteinelor Bcl-2 si Bcl-XL in celulele Jurkat inhiba apoptoza indusa prin staurosporina si diminueaza activarea CPP32 si ICE-3. Dar, in unele celule Jurkat, Bcl-2 si Bcl-XL nu au efect in apoptoza indusa prin activarea receptorul Fas.
Exista doua cai distincte de desfasurare a apoptozei in aceste celule: una in care proteinele Bcl-2 si Bcl-XL activeaza caspazele si alta in care aceste proteine nu au nici un efect. De exemplu in celulele HeLa atat Bcl-2 cat si E1B19K pot inhiba apoptoza indusa de TNF si FAS (23).
Cercetarile privind mecanismul de actiune al caspazelor au aratat ca aceste proteine cliveaza proenzime precursoare rezultand subunitati active ale caspazelor. Studiile referitoare la substratele caspazelor au cuprins si proteinele Bcl-2. S-a demonstrat ca Bcl-2 poate fi clivat de caspaza-3 activata, producand un fragment proteolitic de 23kD. Locul de clivaj intre aminoacizii 32-80, denumit domeniul 4 (BH4) spre capatul N-terminal, este prezent la toate proteinele din familia Bcl-2 cu rol antiapoptotic, dar este absent la proteinele cu rol proapoptotic din aceeasi familie. Mutantii Bcl-2 care nu au acest domeniu nu pot fi clivati de caspaze si nici mutantii care rezulta prin schimbarea de aminoacizi in acest domeniu.
Studiile in vivo au aratat ca Bcl-2 este clivat la nivelul acestui domeniu rezultand un produs de 34 aminoacizi dinspre capatul N-terminal denumit deltaN34, cu o puternica activitate proapoptotica prin activarea caspazelor, conducand celula spre moarte celulara prin apoptoza. Acest fragment proteic poate induce apoptoza ca si proteinele Bax printr-un mecanim independent de domeniile BH3.
Prin clivarea Bcl-2 si Bcl-XL se formeaza un fragment cu proprietati proapoptotice certe. S-a presupus ca exista un feed-back intre Bcl-2 si caspaze, Bcl-2 inhiband apoptoza nu numai prin formarea de pori sau prin impiedicarea eliberarii citocromului c, dar si prin alte mecanisme. Astfel, Bax si Bak desi sunt proteine proapoptotice pot inhiba apoptoza posibil prin "acoperirea" domeniilor proapoptotice
Faptul ca Bcl-2 nu poate inhiba apoptoza in toate situatiile denota faptul ca efectorii apoptotici-caspazele pot converti actiunea antiapoptotica a Bcl-2 intr-una proapoptotica prin clivarea acestei proteine. Un element important in interactiunea dintre caspaze si Bcl-2 este proteina Bik. Aceasta proteina care contine un singur domeniu BH3 poate sa scoata caspaza CED4 din combinatia cu Bcl-XL.
Actiunea proteinelor Bcl-2 de a promova sau inhiba apoptoza este deosebit de complexa, realizandu-se la nivelul unor structuri subcelulare biologice sau biochimice, interferand uneori cu desfasurarea normala a mai multor procese metabolice.
Datele cunoscute pana in prezent ca formarea de canale sau producerea unei permeabilitati tranzitorii a membranelor, in special mitocondriale, reprezinta actiunea principala a acestor proteine. Atat proteinele cu actiune proapoptotica (Bax), cat si cele cu actiune antiapoptotica (Bcl-2, Bcl-XL) produc aceleasi tipuri de modificari: formarea de canale, modificari ale potentialului membranar, eliberarea de factori in citoplasma, dar cu efecte opuse, inhiband sau generand apoptoza. Inducerea sau blocarea apoptozei este modulata de interactiunile directe intre aceste proteine
Formarea de pori sau canale la nivelul membranelor intracelulere induce o serie de modificari tipice ale apoptozei: modificari in statusul redox al citoplasmei, cu formarea speciilor reactive de oxigen (ROS "reactive oxygen species"), expunerea la diverse molecule la nivelul membranei celulare, modificari celulare.
De exemplu, modificarile nucleare induse de proteinele mitocondriale in vitro, chiar in prezenta antioxidantilor, sau generarea de ROS si expunerea de molecule pe suprafata celulei se pot observa si in celule anucleate.
Bcl-2 poate inhiba prin mecanisme inca putin cunoscute atat efectele ROS cat si generarea de ROS care reprezinta o consecinta a aparitiei acestei permeabilitati tranzitorii. Bcl-2 actioneaza ca inhibitor al apoptozei, producand canale transmembranare, dar trebuie sa previna depletia de ATP, generarea de ROS, cresterea nivelului calciului nuclear si citoplasmatic si activarea nucleazelor. Din aceste motive, se considera ca formarea acestor canale reprezinta un punct nodal privind desfasurarea procesului apoptotic. Depasirea acestui punct conduce celula ireversibil spre apoptoza.
Mitocondria: integrator al cailor de semnalizare a mortii celulare
Mitocondria este tinta comuna a numeroase molecule transductoare de semnale ce provoaca permeabilizarea membranelor mitocondriale. Membrana externa a mitocondriei este practic permeabila pentru toate moleculele de marime inferioara de 1,5 kDa. Aceasta pemeabilitate non selectiva este datorata in principiu de porina mitocondriala sau VDAC (voltage dependent anionic channel). Membrana externa contine de asemenea un canal cationic, PSC (peptide sensitive channel) asociat mecanismului de translocare a proteinelor.
Membrana interna este mult mai selectiva : schimburile sunt efectuate de transportori specifici cum ar fi de exemplu tranlocatorul ADP/ATP (adenine nucleotide translocator, ANT).
In timpul apoptozei, mitocondria sufera modificari de permeabilitate la nivelul acestor membrane, interna si externa. G. Kroemer si B. Mignotte au fost primii care au demonstrat ca disiparea potentialului mitocondrial a membranei interne mitocondriale este un eveniment precoce al apoptozei. In 1996, grupul lui X. Wang a demonstrat ca o proteina din spatiul intermembranar mitocondrial, citocromul c , este eliberata in citoplasma si interactioneaza cu proteina Apaf-1 (apoptosis activating factor-1) ce contribuie la activarea caspazelor. De asemenea, in timpul apoptozei scaderea potentialului membranar mitocondrial determina redistribuirea unei proteine din spatiul intermembranar mitocondrial AIF (apoptosis inducing factor) catre nucleu unde va induce condensarea cromatinei.
In timpul fazei de decizie (sau faza efectoare), aceste modificari sunt controlate de familia de proteine Bcl-2 proteine care se gasesc, in general, asociate membranei externe mitocondriale. Actual se considera ca familia de proteine Bcl-2 joaca un rol central in reglarea apoptozei. Bcl-2 protejeaza celula impotriva inducerii apoptozei de catre diversi stimuli si este considerata proto-tipul acestei familii de proteine.
Unul din evenimentele esentiale ale fazei de decizie apoptotica este aparitia permeabilitatii tranzitorii mitocondriale (PT).
Potentialul membranar mitocondrial DY rezulta din distributia asimetrica a protonilor si ionilor de o parte si alta a membranei mitocondriale ce conduce la un gradient chimic (pH) si electric. Acest potential membranar mitocondrial este un indicator sensibil al starii energetice al mitocondriei si al celulei ce poate fi folosit in determinarea activitatii pompei de protoni mitocondriale, sistemelor de transport al electronilor si activarii permeabilitatii tranzitorii mitocondriale.
Aceasta modificare rapida a gradientului electrochimic a membranei mitocondriale interne DY este datorata deschiderii unui complex multiproteic, numit megacanal, format din puncte de contact intre membranele mitocondriale interna si externa.
Studii recente indica ca megacanalul este reglat de proteine din familia Bcl-2 care inhiba (Bcl-2, Bcl-XL) sau faciliteaza (Bax) deschiderea lui. Studiul interactiei proteinelor familiei Bcl-2 cu mitocondria poate fi determinanta in intelegerea mecanismelor apoptozei. `
Pana in prezent, exista trei modele care incearca sa explice modul in care membrii familiei Bcl-2 regleaza eliberarea citocromului c din mitocondrie (Hengartner, 2000).
Primul model presupune ca membrii familiei Bcl-2 formeaza canale ce faciliteaza transportul proteic. Bazandu-se pe similitudinea structurala a Bcl-XL cu cea a porului format de subunitatea toxinei difterice, s-a presupus ca proteinele Bcl-2 se pot insera in bistratul lipidic, oligomerizeaza si pot forma pori.
Al doilea model considera ca proteinele Bcl-2 (Bax) interactioneaza cu alte proteine din membrana mitocondriala externa de exemplu cu VDAC sau ANT conducand fie la formarea unui por de eliberare a citocromului c fie la modularea homeostaziei mitocondriale.
Exista de asemenea posibilitatea ca membrii familiei Bcl-2 sa controleze homeostazia mitocondriei. In acest model, semnalul apoptotic modifica fiziologia mitocondriala (de exemplu, schimburile ionice sau fosforilarea oxidativa) rezultand o ruptura fizica a membranei externe si eliberarea proteinelor in intermembranare in citosol.
Proteinele Bcl-2 pot influenta homeostazia mitocondriala in mod direct (de exemplu, prin activitatea intrinseca a canalului ionic) sau indirect prin modularea altor proteine mitocondriale.
Probabilitatea deschiderii megacanalului este de asemenea influentata de conditii metabolice defavorabile (scaderea raportului ATP/ADP, scaderea nivelului glutationului, glucozei). Durata si nivelul (conductanta) deschiderii megacanalului este asociat unui sistem de auto-amplificare dependent de caspaze ce controleaza viteza acestor evenimente conducand la ruperea membranei mitocondriale externe. Aceasta ruptura a membranelor mitocondriale are consecinte metabolice pe plan bio-energetic, al echilibrului redox si al homeostaziei ionice si conduc celula la moarte.
Mitocondriile pot omori (si se pot omori) prin supraproductia de specii reactive de oxigen. Anionii superoxid si peroxizii lipidici prezinta nivele crescute in timpul apoptozei. In acelasi timp, daca ROS sunt capabili sa induca apoptoza, acumularea lor in mari cantitati poate deturna celulele angajate in apoptoza spre distrugerea prin necroza.
Supraproductia de ROS poate antrena o scadere a disponibilitatii sistemului antioxidant si joaca un rol important in deschiderea megacanalului si in permeabilitatea tranzitorie mitocondriala conducand la eliminarea citocromului c in citosol si ruperea membranelor mitocondriale. In final, ele favorizeaza fagocitoza celulelor in apoptoza probabil prin oxidarea fosfatidilsetinei din membrana citoplastica care se regaseste apoi anormal localizata la exterior.
In acelasi timp, ROS sunt capabili sa activeze sistemul antioxidant prin intermediul factorului nuclear NF-aB si stimularea UCP2.
Mecanismele de protectie impotrica stressului oxidativ la nivel mitocondrial implica proteinele Bcl-2 si Hsp.
Mecanismul de protectie utilizat de Bcl-2 impotriva ROS este putin cunoscut; el poate implica mai putin enzimele protectoare si mai mult cresterea nivelului de glutation redus.
Mitocondriile beneficiaza de efectele protectoare ale proteinelor de soc termic Hsp citoplasmatice si in particular de Hsp 70 si Hsp 27. Hsp functioneaza ca agenti antiapoptotici si asigura protectia impotriva radicalilor liberi ai oxigenului prin interactia cu diferite molecule cum ar fi glutationul si caspazele prin mecanisme inca putin cunoscute.
Toate acestea conduc la concluzia ca mitocondria joaca un rol de integrator al diferitelor semnale si familia de proteine Bcl-2 regleaza inducerea apoptozei printr-un mecanism ce implica eliberarea citocromului c si activarea caspazelor (caspaza 9 ce va actiona asupra caspazelor efectoare finale 7, 6 si respectiv 3) ( Kroemer, G., 2001).
Caspazele, efectori ai apoptozei
Mecanismele care stau la baza procesului de autodistructie celulara prin apoptoza au fost studiate initial la nival molecular pe nematomul Caenorhabditis elegans. In cursul dezvoltarii acestuia, din cele 1090 de celule somatice 131 mor prin apoptoza. Pe acest model de studiu, s-au identificat 3 gene implicate in moartea sau supravietuirea genelor respectiv: ced-3, ced-4 si ced-9. S-a constatat ca deletiile sau mutatiile primelor doua au ca rezultat supravietuirea celulelor care normal mor in dezvoltare. Analiza mutatiilor genei ced-9 a permis definirea rolului sau in prevenirea apoptozei, clonarea acesteia relevand o omologie secventiala a produsului sau cu proteina antiapoptotica Bcl-2 cunoscuta la om din anul 1985 pentru supraexpresia sa in limfoamele foliculare de tipB.
Determinarea secventei genei ced-3 a permis identificarea unui analog al produsului sau la mamifare, respectiv ICE cunoscuta anterior pentru activitatea sa proteazica implicata in maturarea IL-1 beta, o cistein proteaza care a capatat denumirea de caspaza-1.
Caspazele (cysteinyl aspartate specific proteinas) mediaza ultima etapa a mortii celulare (Earnshaw si colab, 1999). C reprezinta cisteina din centrul cataltic activ, iar aspase defineste specificitatea stricta de clivarea a substratului dupa un acid aspartic (Asp-XXX). In prezent, au fost identificate 14 caspaze ce sunt exprimate sub forma inactiva de pro-caspase sau zimogen.
Structura caspazelor
Studiile pentru determinarea structurii si functionalitatilor caspazelor au urmarit purificarea din surse naturale, apoi clonarea si determinarea structurii prin cristalografie in raze X determinandu-se faptul ca in general sunt dimeri din doua subunitati de 10 si 20 kDa strans asociate. Ele poseda un situs catalitic bine conservat, compus dintr-un reziduu cisteinic compus dintr-o secventa peptidica de tip QACRG, ceea ce confera specificitatea de recunoastere si de clivare la nivelul restului aspartat din pozitia p1. Aminoacidul din vecinatatea aspartatului influenteaza specificiatea macromoleculara si functionala a acestora (tabel)
Toate caspazele au o structura inalt conservata ce contine un domeniu N-terminal de marime variabila, un domeniu corespunzator subunitatii mari dupa clivare (17-21 kDa care poarta centru activ) si un domeniu corespunzator subunitatii mici (10-14 kDa).
Dupa rolul lor, caspazele sunt grupate in caspaze initiatoare (1, 2, 4, 5, 8, 9, 10, 11) ce vor activa caspazele efectoare (3, 6, 7).
Unii membrii ai familiei caspazelor poseda un domeniu de legare intre subunitatea mica si subunitatea mare. Prodomeniile sunt variabile in functie de marimea si de secventa lor. Astfel, caspazele initiatoare (3,6 si 7) au un prodomeniu mic in timp ce procaspazele efectoare (1 ,2, 4, 5, 8, 9, 10, 11, 12 si 13) poseda un prodomeniu mare. Prodomeniile par a juca un rol in interactiile proteina-proteina. Prodomeniile caspazelor 8 si 10 contin Domeniile Efectoare ale Mortii Celulare (sau Death Effector Domains : DEDs) a caror structura permite legarea caspazelor de moleculele adaptatoare FADD sau TRADD. Alte caspaze (1, 2, 4 si 9) contin un Domeniu de Recrutare al Caspazelor (sau Caspase Recruitment Domain : CARD) . Aceste domenii CARD au un rol in interactia atat intre caspaze cat si cu o mare varietate de molecule adaptatoare sau reglatoare.
Tabel : Principalele subtrate clivate de caspaze in timpul apoptozei.
Activarea caspazelor
Trecerea unei caspaze din zimogen in enzima matura necesita cel putin doua clivaje la nivelul legaturii Asp-X (tabel). Substituirea acidului aspartic din pozitia P1 cu alt aminoacid duce la scaderea de 100 de ori a capacitatii de clivare. Aceste clivaje succesive au loc in maniera secventiala : intai are loc ruperea legaturii intre subunitatea mica si cea mare (deci, are loc eliberarea subunitatii mici de restul moleculei) urmata de eliberarea prodomeniului (figura).
|
Noua si vechea denumire |
Situsul de clivare in zimogen |
Substrat |
Posibilitate de autoclivare |
Inhibitie datorata |
Localizarea cromozomiala |
||
|
CrmA |
p35 |
XIAP |
|||||
|
Caspaza 1 ICE |
TPLD/S FEDD/A AVQD/N |
YEVD-X WEHD-X |
|
|
|
|
11q22 |
|
Caspaza 2 Ich-IL NEDD2 |
DQQD/G EESD/A |
VDVAD-X DEHD/X |
|
|
|
|
|
|
Caspaza 3 CPP32 Apopaina |
IETD/S ESMD/S |
DMQD-X DEVD-X |
|
|
|
|
4q34 |
|
Caspaza 4 ICErelII Tx,Ich-2 |
WVRD/S LEED/A |
LEVD-X (W/L)EHD-X |
|
|
|
|
11q22 |
|
Caspaza 5 ICErelIII, Ty |
WVRD/S LEAD/S |
(W/LEHD)X |
|
|
|
|
11q22 |
|
Caspaza 6 Mch2 |
DVVD/N TEDV/A TETD/A |
VEID-N VEHD-H |
|
|
|
|
4q25 |
|
Caspaza7 Mch3, CMH-1, ICE-LAP3 |
IQAD/S DSVD/A |
DEVD-X |
|
|
|
|
10q25 |
|
Caspaza 8 Mch5, FLICE, MACH |
VETD/S LEMD/L REOD/Sh |
IETD-X LETD-X |
|
|
|
|
2q33 |
|
Caspaza 9 Mch6, ICE-LAP6 |
PEPD/A DQLD/A |
LEHD-X |
|
|
|
|
1q34 |
|
Caspaza10 Mch4, FLICE-2 |
IEAD/A SQTD/V |
IEAD-X |
|
|
|
|
2q33 |
|
Caspaza 11 |
|
|
|
|
|
|
|
|
Caspaza 12 |
|
|
|
|
|
|
|
|
Caspaza 13 ERICE |
|
|
|
|
|
|
|
|
Caspaza 14 |
|
|
|
|
|
|
|
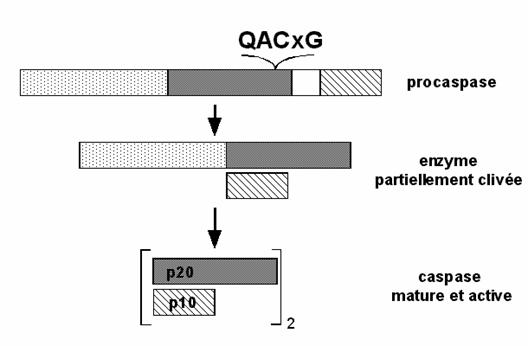
Figura : Structura si activarea caspazelor
Astfel, caspaza va putea sa se asambleze sub forma activa, alcatuita din doua subunitati mari si doua subunitati mici, structura generala astfel obtinuta fii,d (p10/p20)2.
In continuare, caspazele vor putea sa se autoactiveze si/sau sa fie activate de alte caspaze. Aceasta introduce notiunea de cascada de activare. O data ce caspazele initioare sunt activate, ele vor putea cliva alte caspaze ce sunt inca in starea de zimogene (caspazele efectoare). Acest tip de activare in cascada permite reglarea si amplificarea semnalului.
Numeroase studii au descris posibilitatea ca subunitatea p10 a unui zimogen poate sa se asocieze cu subunitatea p20 a altui zimogen.
Substratele caspazelor
Rolul caspazelor este in principal executiv, adica ele se vor participa la oprirea caii protectoare a apoptozei si la activarea moleculelor care vor contribui la distrugerea celulara. Caspazele sunt enzime extrem de selective. Proteinele tinta trebuie sa sa posede un rest aspartat in pozitia P1. Acest rest aspartat va fi integrat intr-o fanta (denumita situsul S1) si va fi aliniat la Arg 179, Gln 283, Arg 341 si Ser 347 (numerotarea corespunde caspazei 1). Aceasta structura este conservata la toate caspazele umane (cu exceptia serinei Ser347 care este inlocuita printr-o Thr la caspaza 8). (Figura)
Structura tridimensionala a caspazelor
Tabelul pg 36 indica principalele substrate clivate de catre caspaze in timpul apoptozei.
Aceste proteine tinta regrupeaza proteine citoplasmatice, nucleare, proteine implicate in metabolismul si repararea ADN, protein kinaze. De asemenea, proteine implicate in transmiterea semnalelor si in expresia genelor, in reglarea ciclului celular, proliferare, in maladii genetice sau proteine reglarea ale apoptozei sunt substrate ale caspazei.
Este important de mentionat ca anumite substrate nu sunt clivate in toate tipurile celulare. Actina, de exemplu, este clivata in celulele liniei mielomonocitare U937, in neuroni si in timocite, dar nu in alte tipuri celulare in timpul etapei de executie a programului apoptotic.
De asemenea, unume substrate sunt clivate la situsuri diferite in functie de tipul celular. Astfel, topoizomeraza I are un profil de clivare diferit daca este cazul celulelor de cancer pulmonar (A549) sau daca este cazul celulelor de cancer mamar (MDA-MB-468). Aceasta heterogenitate poate fi datorata fie activarii a diferite caspaze, fie a variatiilor in accesibilitatea substratelor de catre proteaze fie combinarea celor doua ipoteze.
Reglarea caspazelor
Activarea inoportuna a caspazelor are atatea efecte devastatoare astfel ca nu este surprinzator ca aceasta etapa trebuie sa fie rigulos controlata. Nu numai activarea dar si activitatea si producerea caspazelor sunt reglate pe mai multe nivele.
a. Reglarea trascriptionala
In timp ce, apoptoza se poate produce in majoritatea tipurilor celulare in absenta ARNm si a sintezei proteice, numeroase observatii sugereaza ca reglarea expresiei genelor procaspazelor poate fi importanta in anumite conditii. Astfel, in ciuda faptului ca nivelul ARNm al procaspazelor este detectabil in cea mai mare parte a tipurilor celulare, nivelul zimogenelor este diferit de la un tip celular la altul. De exemplu, caspaza 3 este puternic exprimata in numeroase celule limfoide si mieloide mature in timp ce este slab exprimata in epiteliul mamar si in neuronii normali. In plus, nivelul expresiei acestor zimogene nu este constant. Numeroase studii au descris ca in conditiile inducerii apoptozei, neuronii (in vitro) precum si creierul de soarece (in vivo) exprima nivele ridicate de ARNm al caspazei 3. Pe perioada incubarii celulelor leucemice humane in prezenta etoposidului (un inhibitor al topoizomerazei II) , nivelul expresiei multor ARNm ai procaspazelor creste semnificativ.
Interferonul g este unul dintre factorii cu mare influenta asupra expresiei genelor a numeroase caspaze. Tratamentul celulelor U937 cu interferon g mareste sensibil expresia caspazelor cat si sensibilitatea celulelor la apoptoza. Insa modalitatea de actiune a interferonului g in reglarea expresiei genice a caspazelor ramane necunoscut.
b. Inhibitori naturali
Virusurile au dezvoltat diverse strategii foarte eficace de a inhiba moartea celulara si de a elibera citokine proinflamatoare de catre celulele infectate in scopul de a se integra ciclului lor celular si de a infecta noi celule. Numeroase molecule virale, celule animale si chiar vegetale au fost descrise ca avand o activitate inhibitoare a apoptozei.
p35 si CrmA
p35 este una din proteinele de baculovirus. Ea este capabila sa inhibe un mare numar de caspaze (tabel ), dar nu au efect asupra granzimei B. CrmA (Cytokine response modifier A) este produsul unei gene precoce ale virusului cowpox. CmrA are un efect inhibitor al inflamatiei precum si al recrutarii macrofagelor in situsurile de inflamatie. Supraexpresia ei permite inhibitia apoptozei induse prin lipsa factorilor de crestere, CD95 sau TNF. CmrA inhiba activitatea proteolitica a caspazelor 1, 8 si in intr-o mai mica masura caspaza 6. Alte caspaze, cum ar fi caspaza 3 sau caspaza 7, nu sunt afectate de aceasta molecula.
Aceste doua molecule virale (CrmA si p 35) sunt inhibitori competitivi, astfel ca o data clivata de catre o caspaza, ele se vor lega de aceste enzime si vor impiedica degradarea unor noi substrate.
FLIP
Exista o familie de receptori specializati in inducerea apoptozei : receptorii mortii. Stimularea acestor receptori, va conduce la recrutarea moleculelor adaptatoare apoi clivarea zimogenelor caspazelor initiatoare (caspazele 8 si 10) si in final, la activarea caspazelor efectoare. Aceasta etapa de recrutare poate fi reglata de o proteina numita FLIP (FLICE inhibitory protein) ce contine doua domenii efectoare ale mortii celulare care ii vor permite legarea la prodomeniile caspazelor 8 si 10 si asftel va impiedica recrutarea lor de catre receptorii mortii.
Exista o mare varietate de transcripti FLIP. Transcriptul cel mai lung poseda in plus de cele doua domenii DED, echivalentul unui domeniu inactif de caspaza, in timp ce forma scurta nu prezinta decat cele doua domenii DED. FLIP a fost descris ca protector al apoptozei (Hu si colab, 1997) sau inductor al apoptozei (Han si colab, 1997) in functie de natura transcriptului si de tipul celular. In conditii fiziologice, FLIP pare a fi inhibitor al procaspazei 8.
Rolul FLIP in modularea apoptozei pare a fi foarte complex. Efectul sau pro sau anti-apoptotic este dependent de natura transcriptului, de tipul celular ca si de nivelul expresiei fiecarei izoforme.
Proteina E8
Proteina E8 (din virusul herpesului de tip II) precum si MC159 si MC160 (din virusul Molluscum contagiosum) utilizeaza o strategie similara pentru a inhiba apoptoza.
Aceste proteine poseda ca si FLICE doua domenii DED ce le permite sa inhibe recrutarea procaspazelor 8 si 10 de catre receptorii lor.
Bcl-2
Este cunoscut ca marea familie a proteinelor Bcl-2 joaca un rol major in reglarea apoptozei. Aceasta reglare implica modularea activitatii a unor caspaze, in special a caspazei 9. Astfel, impiedicand eliberarea citocromului c de catre mitocondrie, Bcl-2 si Bax, de exemplu, inhiba formarea complexului Apaf-1/citocrom c/ caspaza 9 care este necesar apoptozei. Aceste puncte au fost tratate in capitolul precedent.
IAP
Baculovirusurile poseda o alta proteina capabila de a inhiba apoptoza: IAP (inhibitor of apoptosis). Au fost identificati la mamifere cel putin 5 omologi: NAIP (Liston si colab, 1996), cIAP-1 (Rothe si colab, 1995), cIAP-2 (Rothe si colab, 1995), XIAP (Liston si colab, 1996) si survivina (Liston si colab, 1996).
Efectul protector al proteinelor IAP, este datorat capacitatii lor de a inhiba activarea si deci activitatea caspazelor. Astfel, XIAP, cIAP-1 si cIAP-2 inhiba caspazele 3, 7 si 9, dar nu poate inhiba caspazele 1, 6 si 8. NAIP este incapabila de a inhiba caspazele 1, 3, 6, 7 sau 8.
Proteinele IAP, cu exceptia survivinei, sunt caracterizate de doua domenii BIR (baculovirus IAP repeats) in capatul N terminal si de un domeniu de interactiune proteina-proteina ce contine un atom de zinc (RING finger) la capatul C terminal. Srvivina nu contine decat domeniile BIR. Diferite studii au aratat ca doar domeniul BIR2 este necesar pentru a inhiba caspazele 3 si 7 .
c. osforilare
Numeroase studii au demonstrat ca apoptoza poate fi reglata de catre protein kinaze si protein fosfataze. Studiul lui Martins si colab. (1998) sugereaza ca, de asemenea, caspazele pot fi fosforilate in vivo. Aceasta fosforilare poate afecta activitatea lor enzimatica in vitro si ramane de demonstrat daca fosforilarea moduleaza activitatea caspazelor in vivo. S-a demonstrat ca defosforilarea caspazelor 3 si 6 este corelata cu cresterea capacitatii de a cliva PARP implicand posibilitatea ca fosforilarea sa poata inhiba clivarea anumitor substrate de catre aceste proteaze. Un alt studiu indica ca kinaza Akt poate fosforila procaspaza umana inhiband activarea ei, dar ca Akt este incapabila de a fosforila caspazele 3, 6 sau 7 (Cardone si colab, 1998).
Ramane de elucidat natura kinazelor responsabile de fosforilarea caspazelor efectoare precum si rolul fiziologic al acestei modificari post-transcriptionale.
Rolul caspazelor
Implicarea individuala a caspazelor in moartea celulara programata nu a putut fi studiata pana in prezent decat prin obtinerea de animale deficiente in expresia unora dintre ele. Pina in prezent, doar genele ce codifica caspazele 1, 2, 3, 8, 9, 11 si 12 sunt mai bine cunoscute (tabel).
|
Soareci ce nu exprima: |
Modificari in dezvoltarea si privinta expresiei citokine |
Modificari ale apoptozei |
|
Caspaza 1 |
Fara efecte in dezvoltare Rezistenta la soc septic Absenta clivarii IL-1b si IL-18 |
Sensibilitate normala la cea mai mare parte a agentilor pro-apoptotici; Diminuarea apoptozei induse de CD95 in limfocite; Rezistenta neuronilor la lipsa factorilor de crestere |
|
Caspaza 2 |
Viabili, fara probleme majore Exces de celule germinale femele |
Rezistenta ovocitelor la moartea indusa de medicamente; Sensibilitatea limfocitelelor la medicamente si la antiCD95 |
|
Caspaza 3 |
Talie mai mica. Moartea intre prima si a treia saptamana. Modificari ale dezvoltarii creierului cu un exces de celule post-mitotice |
Absenta fragmentarii nucleului de timocite si de hepatocite Absenta clivajului substratelor de catre caspaze |
|
Caspaza 8 |
Letal in utero.; Embrioni mai mici. Malformatii cardiace; Acumularea masiva de erotrocite si hemoragii masive; Diminuarea celulelor suse hematopoietice. |
Rezistenta fibroblastelor la apoptoza indusa prin TNFa, CD95, DR3 dar sensibile la majoritatea agentilor pro-apoptotici. Activarea normala a NFaB si JNK. |
|
Caspaza 9 |
Letalitate perinatala; Creier mult mai voluminos si deformat datorita reducerii apoptozei in timpul dezvoltarii creierului. Absenta activarii caspazei 3 in creierul embrionar. |
Rezistenta celulelor suse embrionare si a limfocitelor la stimuli pro-apoptotici, rezistenta timocitelor la apoptoza indusa de radiatii g si dexametazona, dar sensible la UV si CD95 |
|
Caspaza 11 |
Fara defecte in dezvoltare (similar caspazei 1) |
Rezistenta celulelor la apoptoza indusa prin supraexprimarea caspazei 1 |
|
Casapaza 12 |
Fara defecte in dezvoltare |
Soareci rezistenti la apoptoza indusa prin stressul RE dar sensibili la ceilalti stimuli apoptotici. Neuroni corticali rezistenti la lipsa factorilor de crestere. |
Caspaza 1
Studiile preliminare s-au concentrat asupra capacitatii caspazelor 1 de a cliva citokina inactiva pro-IL-1beta (31kD) la nivelul Asp-116-Ala-117 pentru a genera forma sa activa de 16 kD, respectiv IL-1beta, mediator cheie al inflamatiei.
Toate cele situsuri de clivare ale p45 apar la nivelul puntilor Asp-Xaa, ceea ce sugereaza ca in forma lor activa caspazele1 pot sa apara pri autoproteoliza.
Caspazele1 se gasesc predominant in citoplasma celulelor in forma inactiva (p45) unele existand la suprafata membranei celulere.
Caspaza 1 s-a demonstrat a fi un nou tip de proteaza ce contine un rest de cisteina in situsul activ (Cys-285) al subunitatii p20. Studii ale specificitatii de substrat au aratat ca aceasta caspaza are o puternica preferinta pentru acidul aspartic, adiacent situsului de clivare in pozitia p1, un aminoacid hidrofob in pozitia p1 si un necesar de 4 aminoacizi pe partea stanga a situsului de clivare. Cristalografia in raze X a determinat faptul ca forma activa a enzimei este un tetramer cu doua subunitati p20, inconjurand cele doua subunitati p10, zona cea mai extinsa de contact a dimerilor fiind intre subunitatile p10 . Stabilitatea moleculei este data si de interactiunole dintre capatul c-terminal al p20 si N-terminal al p10. Cys-285 si His-237 formeaza o diaza catalitica a situsului activ al caspazei1. situsul activ este un pentapeptid (QARCG). Studiul cristalografic a dus la elaborarea a doua modele de maturare a proenzimei. Fie 2 precursori p45 se asociaza si apoi o subunitate p10 formeaza cu o subunitate p20 un situs activ, fie procesarea este urmata de asocierea subunitatilor. S-a demonstrat ca este necesara oligomerizarea pentru autoprocesare.
Utilizand PCR revers transcriptaza, s-au identificat 4 izomorfe ale caspazei 1 cu roluri diferite in apoptoza.
Experimantal s-a demonstrat ca supraexpresia genei murine ICE induce apoptoza in fibroblastele Rat-1, fenomen ce nu se regaseste in urma mutatii punctiforme din pentapeptidul situsului activ la nivelul resturilor Cys sau Gly sau la nivelul genelor bcl-2 sau crmA. Gena crmA codifica o serpina de 38 kD inhibitoare specifica a caspazei 1 care previne procesarea proteolitica a IL-1 beta ajutand la supresarea raspunsului la infectiile virale. Virusurile si-au creat proteine capabile sa inhibe apoptoza in celulele infectate, pentru a putea infecta gazda.
Neuronii din ganglionii din radacina dorsala a nervilor spinali care sufera apoptoza prin lipsa de NGF sunt protejati de crmA ceea ce sugereaza implicarea caspazei 1 in moartea neuronala la vertebrate.
Soarecii deficienti in caspaza 1 se dezvolta normal ceea ce demonstreaza ca nu exista anomalii majore ale proceselor fiziologice ce implica aopptoza
Macrofagele de la soarecii deficienti in caspaza 1 prezinta aceeasi sensibilitate la apoptoza indusa de ATP ca si cele de la tipul normal.
Timocitele de la soarecii deficienti si normali prezinta o sensibilitate similara la apoptoza indusa de dexametazona sau iradiere gamma, dar timocitele de la soarecii deficienti prezinta o mai mare rezistenta la apoptoza indusa de anticorpi anti CD95 (FAS/APO-1). Aceste date sugereaza lipsa implicarii caspazei 1 in majoritatea formelor de apoptoza, sau faptul ca o alta caspaza poate substitui functia acesteia la soarecii deficienti.
S-a demonstrat experimental rolul caspazei 1 in apoptoza celulelor epiteliale mamare dupa distructia matrixului extracelular, precum si apoptoza limfocitelot T indusa de IFN.
Recent s-a demonstrat ca aceasta caspaza este activata direct prin interactiunea cu caspaza 11.
Caspaza 2
Caspaza 2 a fost initial identificata prin clonarea unei gene reglatoare participante la dezvoltarea creierului de soarece. Ulterior a fost identificat omologul uman Ich-1. Ambele codifica proteine similare caspazei 1, situsul activ fiind tot un pentapeptid (QACRG).
Studiul ARNm al caspazei 2 a dus la identificarea a doua forme obtinute prin splicing alternativ care genereaza doua proteine: una de 435 aminoacizi, caspaza 2L (Long) si alta de 312 aminoacizi, caspaza 2S (Small). Supraexpresia caspazei 2L in unele celule duce la apoptoza, in timp ce supraexpresia caspazei 2S inhiba apoptoza indusa de lipasa serului. Aceasta sugereaza participarea in reglarea pozitiva si negativa a mortii celulare.
Caspaza 2 pare a fi necesara in moartea celulelor germinale femele. In plus, ovocitele soarecilor prezinta rezistenta la apoptoza indusa prin agenti chimioterapeutici. La nastere, soarecii deficienti in caspaza 2 prezinta o diminuare a neuronilor motori faciali ceea ce indica ca aceasta caspaza nu reactioneaza nu numai ca un simplu efector pozitif al apoptozei dar ea este capabila, in acelasi timp , in functie de tipul celular, de a intarzia moartea celulara. Aceasta diferenta poate fi explicata prin prezenta celor doua forme ale caspazei.
In timpul dezvoltarii embrionare, caspaza 2 este exprimata considerabil in tesutul nervos, ficat, rinichi, plaman, tesutul nervos si rinichii prezentand nivele crescute ale mortii celulare in dezvoltare.
Referitor la situsurile de clivare, acestea par sa se situeze la Asp 333-Ala (capatul C-terminal al p20) si Asp347 (capatul N-terminal al p10).
Caspaza 2 poate fi activata in vitro de caspazele 1 si 3 precum si de granzimele B. In afara de aceasta cale clasica de activare se considera ca aceasta caspaza poate fi recrutata de receptorul pentru TNF printr-o asociere cu o proteina adaptor RAID asociata la randul ei cu proteina Rip.
Actiunea caspazei 2 in faza de executie a apoptozei a fost demonstrata pe linii de celule tumorale monocitare umane THP1.
Caspaza 2 este probabil esentiala in apoptoza celulelor germinale femele insa ea poate avea in anumite situatii un efect protector impotriva apoptozei. In plus, activitatea caspazei 2 pare a fi dependenta de tipul celular, de stadiul de dezvoltare, de splicingul ARN mesager ca si de prezenta sau absenta altor caspaze.
Caspaza 3
Caspaza 3 reprezinta unul dintre executantii cheie ai apoptozei, fiind responsabila de clivarea mai multor proteine cheie in procesul apoptotic cum ar fi PARP, proteina nucleara de 116 kD.
S-a reusit determinarea cistein proteazei de 32 kD numita caspaza 3 sau CPP 32. Analiza secventei N-terminale a dus la identificarea celor doua subunitati de 12 si 17 kD derivate din precursorul proteic prin clivarea intre subunitatea mare si mica.
O serie de studii au incercat sa demonstreze modalitatea de activare a caspazei 3. S-au determinat astfel doua proteine citosolice care interactioneaza cu citocromul c pentru a induce activarea caspazei 3: Apaf-1 si Apaf-3 (Apaf-2 s-a determinat a fi citocromul c, iar Apaf-3 caspaza 9). Eliberarea citocromului c din mitocondrie insoteste apoptoza in orice circumstanta in orice linie celulara studiata. Acesta poseda doua cai de omorare activand caspazele via Apaf-1 intrerupand lantul transportor de electroni si astfel prevenind fosforilarea oxidativa, promovand producerea de radicali liberi si deprivand celula de ATP. Calea dependenta de caspaze este mai rapida.
In timpul fazei de executie, caspaza-3 este responsabila pentru proteoliza unui mare numar de substate, fiecare continand un motiv Asp-Xaa-Xaa-Asp (DXXD). Fara a avea o peptida linker si cu un prodomeniu mai scurt, caspaza-3 prefera substratele DXXD fata de caspaza-1 care le prefera pe cele YVAD.
Ambele necesita Asp in pozitia p1, tolereaza anumite substitutii in p2 si p3 dar in p4 caspaza3 prefera Asp fata de caspaza1.
S-a demonstrat activarea caspazei 3 prin formarea subunitatilor ei active catalitic de 17 si 12 kD in celulele ce sufera apoptoza .
Soarecii deficienti sunt mai mici decat cei normali si mor in 1-3 saptamani de la nastere. Timocitele de la soarecii defecienti in caspaza3 prezinta o sensibilitate la apoptoza, similara cu cea indusa de CD95, anti CD3, staurosporina sau dexametazona. Dezvoltarea creierului la acestia este serios afectata cu hiperplazii, iar clusterele de picnoza din celoulele apoptotice din zonele de modificari majore morfogenetice din dzvoltarea creierului nu apar la soarecii deficienti. Citotoxicitatea T este mediata de granule de CD95. Exocitoza granulelor limfocitelor T citotoxice permite perforinei sa polimerizeze in membrana celulei tinta pentru a facilita intrarea granzimelor. Granzimele B exprima o specificitate neobisnuita pentru Asp in pozitia p1. In vitro granzimele B pot activa caspaza 3 in mod direct si pot cliva alte caspaze care la randul lor activeaza caspaza 3.
Modificari biochimice intalnite la apoptoza
Aparitia in cursul apoptozei a modificarilor morfologice caracteristice acestui proces se face in cea mai mare parte fara pierderea integritatii formatiunilor membranare celulare. Acest fapt permite conservarea si desfasurarea unor procese biochimice, cu consum de energie care au ca rezultat producerea modificarilor mofologice mentionate.
In general, modificarile morfologice si cele biochimice sunt asemanatoare pentru toate tipurile de celule cu cateva exceptii. Principalul proces biochimic al apoptozei pare sa fie proteoliza, atat la nivelul nucleului unde participa endonucleazele, cat si la nivelul organitelor celulare unde caspazele au rol preponderent.
Cu toate acestea, desfasurarea apoptozei necesita sinteza de ARN si de proteine, dar degradarea proteica depaseste mult sinteza proteinelor, mai ales pe masura ce celula se apropie de momentul mortii. Pe fundalul acestui proces de degradare proteice apar si alte modificari biochimice ce concura la realizarea morfologiei apoptotice.
Translocarea fosfatidilserinei
Majoritatea celulelor prezinta in mod fiziologic o asimetrie in ceea ce priveste distributia fosfolipidelor, de o parte si de alta a membranei plasmatice. De exemplu, fosfatidilcolina si sfingomielina sunt situate pe fata externa a membranei in timp ce aminofosfolipidele, fosfatidilserina sunt situate pe cea interna. Aceasta asimetrie este mentinuta de mai multe tipuri de substante printre care o serie de proteaze sau fodrina. Celulele au capacitatea ca in conditii controlate sa transfere fosfatidilserina de pe fata citoplasmatica pe cea externa
Fosfatidilserina constituie un component normal al membranei fiind intotdeauna dispus pe fata interna a acesteia. Translocarea se intalneste in mod normal in organism in conditii controlate sau in cursul unor procese patologice, de exemplu, in cursul procesului de transformare maligna a numeroaselor celule .
Translocarea fosfatidilserinei apare si in cusul apoptozei considerandu-se ca acest proces este unul general pentru apoptoza dar exista celule care intra in apoptoza fara exprimarea fosfatidilserinei la suprafata membranei plasmatice. Expunerea acesteia are loc in urma actiunii mai multor stimuli, tratamentul cu ceramide sintetice sau glicocorticoizi, mai multe tipuri de medicamente citotoxice ca si radiatiile ultraviolete
Studiile efectuate cu annexina V, o proteina care se leaga specific de fosfatidilserina in prezenta calciului, au aratat ca expunerea fosfatidilserinei reprezinta o modificare timpurie a procesului de apoptoza, precedand fragmentarea nucleara sau activitatea caspazelor .
Expunerea este accentuata de activitatea caspazelor care degradeaza fodrina si permite o mai rapida translocarea a fosfatidilserinei. O serie de substante cunoscute ca blocante ale producerii modificarilor initlnite la apoptoza inhiba si translocarea fosfatidilserinei. Inhibitorii caspazelor actioneaza ca si inhibitori ai expresiei extramembranare a fosfatidilserinei. Aparitia acesteia la suprafata celulelor aoptotice mareste sansele ca aceste celule sa fie recunoscute de macrofage si de fagocitate.
Mecanismele prin care are loc dispersia inegala a fosfatidilserinei pe suprafata externa a membranei plasmatice sunt necunoscute. Dispersia aminofosfolipidelor pare sa fie responsabila si de dispersia inegala a fosfatidilserinei, fapt evident in cazul trombocitelor s a eritrocitelor. Se presupune ca rolul fodrinei ar fi de a mentine fosfaidilserina pe suprafata interna a membranei plasmatice.
Inhibarea caspazelor inhiba si translocarea fosfatidilserinei, iar in cursul apoptozei membranele mitocondiale sufera o degradare a potentialului transmembranar inainte de expunerea fosfatidilserinei pe suprafata externa. Diferenta de potential este mediata de deschiderea unor pori sau megapori.
Desi se intalneste si in alte procese fiziologice sau patologice, translocarea fosfatidilserinei se considera a fi parte integranta a procesului de apoptoza. Cea mai importanta consecinta a acesteia este faptul ca celula are mai multe sanse sa fie recunoscuta si ulterior fagocitata de macrofage.
Fragmentarea ADN
Fragmentarea ADN nuclear se face initial in fragmente de 300 perechi de kilobaze sau de 50 kbp, urmata de cele mai multe ori de oligonucleosomizarea fragmentelor prin clivarea dublului helix de ADN la nivelul regiunii de legatura dintre nucleosomi. Clivarea este suficienta pentru formarea corpilor apoptotici chiar in absenta formarii nucleosomilor. Uneori endonucleazele pot cliva ADN in fragmente mai mici care pastreaza in continuare dispunerea in dublu helix a celor doua lanturi.
Formarea de fragmente ADN poate sa apara atunci cand nu exista oligonucleosomi. Cele mai multe date obtinite pana in prezent referitoare la clivarea ADN in cursul apoptozei au fost obtinute pe culturi de limfocite. Pe culturi embrionare de soarece s-a putut demonstra ca apoptoza reprezinta un proces degradativ ce altereaza ireversibil structura ADN independent de clivarea lantului dublu al ADN si aparitia mono- sau oligonucleosomilor.
Astfel, apoptoza nu depinde numai de clivarea internucleosomala dar acest proces este implicat in degradarea ADN si in reorganizarea cromatinei chiar in absenta formarii oligonucleosomilor. Atacul ulterior al endonucleazelor la nivelul regiunilor internucleosomale duce la formarea unor fragmente de ADN de 180-200 de perechi de baze. Clivajul internucleosomal se intalneste la o multitudine de celule fiind considerat ca modificare biochimica caracteristica apoptozei. Totusi, aparitia oligonucleosomilor nu se intalneste in toate formele de apoptoza cunoscute, iar ADN mitocondrial nu pare a fi clivat in cursul apoptozei.
Clivarea ADN in nucleosomi este realizata de endonucleaze prezente in numeroase tipuri de celule, enzime dependente de ionii de calciu si magneziu si inhibate de ionii de zinc. Este posibil ca endonucleazele sa fie activate de schimbul ionilor de calciu si magneziu pentru ionul de zinc la nivelul nucleului. Totodata, se presupune ca activitatea crescuta a endonucleazelor poate fi rezultatul cresterii nivelului calciului intracelular sau inducerii de proteine cu activitate de tip endonucleazica.
S-a identificat o proteina bazica cu greutate moleculara de 18 kDa, numita NUC 18, care necesita pH neutru si este dependenta de ionii de calciu. Asemenea NUC, a fost identificata o alta proteaza, DnaSE I, in extractele de timocite apoptotice tratate cu glucocorticoizi, ambele fiind inhibate de ionii de zinc. Acestea, alaturi de alte nucleaze identificate pana in prezent par a fi responsabile de clivarea internucleosomala a ADN.
Clivarea ADN, internucleosomala, cu formarea de fragmente cu numar asemanator de perechi de baze este caracteristica apoptozei fata de necroza in care clivarea este aleatoare fiind asociata si cu degradarea histonelor.
Pana in prezent nu se cunoaste foarte clar care este rolul acestei fragmentari, respectiv daca are un rol esential in desfasurarea procesului apoptotic.
O alta problema care se pune este mecanismul de activare al endonucleazelor. Lantul enzimatic efector al apoptozei (caspazele) este localizat in citoplasma si activat pe calea receptorului FAS/APO-1 si TNFR1, printr-un sistem de molecule adaptoare (FADD,TRADD) si molecule cu rol de comutator (NFkB). Este posibil ca unele dintre proteazele citoplasmatice sau fragmente rezultate din clivarea tintelor acestor enzime sa fie translocate in nucleu prin transport activ nuclear si sa introduca semnalul mortii. Transferul unor enzime proteolitice in nucleu pare sa fie posibil in cursul apoptozei, iar faptul ca multe dintre proteinele nucleare pot fi clivate de acestea este un argument indirect. Proteazele si produsii lor de clivaj pot ajunge in nucleu numai cand semnalul de transductie a fost dat.
Experimental, s-a demonstrat ca prin blocarea transportului nuclear activ cu factori inhibitori nu se observa nici o modificare a apoptozei la nivelul citoplasmei ceea ce sugereaza ca procesele principale ale apoptozei au loc in citoplasma.
De exemplu, injectarea unei aglutinine obtinute din germeni de WGA in nucleu, inhiba transportul activ nuclear si previne modificarile nucleare induse pe calea receptorului FAS si modificarile nucleare sunt inhibate atunci cand in nucleu se injecteaza o proteina din familia caspazelor (CPP32beta).
Transmiterea semnalului mortii in prima faza de la citoplasma la nucleu si posibil in a doua faza de la nucleu la citoplasma este mediata prin transport nuclear activ, cu consum de energie. In prezent, se considera ca modificarile de tip apoptotic in citoplasma pot determina modificarile nucleare, in special, atunci cand apoptoza este indusa prin activarea receptorul FAS .
Alte posibilitati de activare a endonucleazelor au fost sugerate de o serie de evenimente ce au vizat actiunea apoptotica a unor hormoni sau medicamente, studii realizate pe culturi celulare, in special pe timocite.
Se considera ca dexametazona poate induce in anumite doze stimularea sintezei de NUC18. Sinteza si activarea proteazei NUC18 ar putea sa se faca pe calea clasica respectiv a receptorilor steroidieni .
Receptorii mortii celulare
Numerosi stimuli sunt capabili de a induce apoptoza. Totodata, exista o familie de receptori specializati in inducerea mortii celulare programate: receptorii mortii. Odata stimulati, acesti receptori induc activarea caspazelor. Aceasta cale de activare este implicata in eliminarea celulelor potential periculoase pentru organism si in special a limfocitelor autoactive.
Receptorii mortii apartin familiei de receptori TNF-a. Acesti receptori pot promova in functie de contextul celular fie moartea celulara, fie supravietuirea. Urmatorii receptori: CD27, CD30, CD40, TNF-RII, Ox40, 4-1BB si p75 NGFR sunt implicati in supravietuirea celulara. Printre membrii familiei implicati in moartea celulara este important de mentionat CD95 (Fas/APO-1), TNF-RI, DR3, DR4, DR5 si DR6.
Membrii familiei TNF-a sunt proteine transmebranare de tip 1 ce poseda in domeniul extracelular una pana la 6 regiuni bogate in cisteina, regiune implicate in legarea ligandului. Acesti receptori poseda in portiunea intracelulara o regiune inalt conservata in evolutie de 80 aminoacizi numita domeniul mortii celulara (DD death domain). Un domeniu omolog a fost regasit ca fiind produsul genei reaper la Drosophila, proteina implicata in reglarea mortii celulare programate in cursul embriogenezei la Drosophila.
Sistemul FAS (APO1/CD95)/FAS ligand
Apoptoza apare atunci cand celulele sunt lipsite sau nu pot primi semnale extracelulare de supravietiure care inhiba permanent producerea acestui proces. Acesti factori sunt produsi de celulele vecine de tipuri diferite sau de acelasi tip.
In sistemul imun apare insa un alt tip de mecanism. Astfel apar situatii in care celulele specializate produc moartea altor celule prin inducerea apoptozei. In aceste cazuri, inducerea apoptozei se realizeaza prin molecule efectoare exprimate pe suprafata acestor celule, sau prin intermediul unor citokine pentru carea exista receptori pe suprafata celulelor tinta. Un astfel de sistem prin care este indusa apoptoza in celulele tinta cum ar fi celulele infectate viral sau celulele tumorale este reprezentat de sistemul FAS/FAS ligand.
FAS este o proteina transmembranara, formata din 325 aminoacizi, capatul amino-terminal situat in citoplasma si cu capatul carboxi-termonal la exterior. Prezinta o frecventa de semnal situata extracelular carea se cupleaza cu ligandul sau specific, FASL. Descoperirea receptorului FAS s-a facut in anul 1989 prin descoperirea unor anticorpi citolitici de soarece pentru o mare varietate de celule umane.
Proteina de pe suprafata celulelor carea recunoaste acesti anticorpi a fost numita FAS sau APO-1. Functia FAS a fost depistata tratand celulele transformate care exprima pe suprafata lor proteinele FAS cu anticorpi umani care se cupleaza cu FAS, celulele murind in interval de 5 ore, ceea ce a dus la concluzia ca activarea FAS poate transmite in interiorul celulei semnalul pentru declansarea apoptozei. Studiile efectuate pe ADN complementar au stabilit ca FAS este identic cu APO-1.
Receptorii de tip FAS sunt reprezentati variabil in diferite celule. O serie de celule exprima abundent receptorii fas, de exemplu timocitele de soarece sau celulele de ficat, inima, pulmon, ovar. FAS este exprimat pe limfocitele T umane activate ca si pe celulele T leucemice in cursul infectiei cu HIV sau cu virusul Epstein Barr. De asemenea, o serie de celule tumorale exprima receptorii FAS in cantitati variabile, dar mai scazuta decat celulele limfoblastice. Foitele embrionare exprima pe suprafata lor receptorul FAS cu un indice apopotic crescut ceea ce arata ca apoptoza indusa prin FAS are un rol inportant in modelarea foitelor embrionare in cursul gestatiei .
Mecanismele si circumstantele de expresie ale receptorului FAS (1) sunt mai putin cunoscute. Se stie insa ca interferonul gamma sau combinatia dintre interferonul gamma si TNF alfa cresc exprimarea receptorului FAS.
Receptorul FAS este codificat de o gena care se gaseste localizata pe bratul lung al cromozomului 10 la om si 19 la soarece, ambele gene continand 9 exoni.
Modelarea pe computer a permis sa se evidentieze o similitudine intre structura tertiara a FASL si cea a TNF-a si TNF-b
Structura ligandului FAS este codificata la om si la soarece de o singura gena localizata pe cromozomul 1 din vecinatatea genei care codifica un alt ligand OX40 din aceeasi familie. Gena care codifica ligadul FAS are 5 exoni ca si gena pentru TNF alfa
Sistemul FAS/FASL are rol important in 3 cazuri de apoptoza fiziologica: apoptoza limfocitelor T activate la sfarsitul raspunsului imun, distrugerea celulelor tinta afectate viral sau a celulelor tumorale de catre limfocitele T citotoxice si celulele NK care exprima FASL, si a treia situatie distrugerea celulelor inflamatorii, din teritoriile privilegiate imunologic cum ar fi ochiul
ARN mesager pentru FAS1 nu a fost detectat in limfocitele B, macrofage, fibroblaste, celule endoteliale sau timice. O exceptie a fost descoperirea FASL pe celulele testiculare de soarece si sobolan, dar nu si la om. Limfocitele B mature exprima pe suprafata lor receptorul FAS. Este posibil ca FAS de pe limfocitele T activate sa se lege de limfocitele B care exprima receptorul FAS inducand apoptoza
O serie de substante inhiba exprimarea ligandului FAS pe suprafata limfocitului T cum ar fi: herbimicina A, cyclosporina A, genisteina. Expresia ligandului FAS pe suprafata celulelor T este rapid indusa de ionomicina, PMA sau de aparitia si aranjamentul receptorilor pentru limfocitul T. FAS ligand ca si TNF exista si sub forme solubile. Aceste forme iau nastere prin proteoliza, proces care duce la ruperea FASL si TNF de membrana celulara, prin medierea metaloproteinelor membranare. Inhibitorii specifici ai acestor enzime blocheaza procesarea atat a FASL cat si a TNF, ceea ce sugereaza ca aceeasi enzima cliveaza FASL si TNF. Intreaga familie TNF poate trece in forme solubile prin acest mecanism.
Un alt exemplu il constituie ligandul CD40 care trece in forma solubila tot prin actiunea metaloproteinelor. Formele solubile FASL umane sunt functionale dar cele de soarece au o activitate redusa. De asemenea, formele legate de membrana celulara sunt mult mai active decat cele solubile in activarea receptorilor proprii. Din aceste motive, se considera ca FASL si TNF au o actiune in special locala : prin intermediul interactiunii intracelulare directe FASL este o molecula homotrimerica considerandu-se ca o molecula de FASL ce interactioneaza cu molecule FAS. Cuplarea FAS cu FASL duce la modificari conformationale ale domeniilor mortii intracitoplasmatice ale receptorului FAS ceea ce permite cuplarea moleculelor adaptor la acest domeniu. Pentru FAS, principala molecula adaptor este FADD (FAS-asociated death domain). Acessta proteina la randul ei contine un domeniu al mortii efector ce se leaga de un domeniu analog de pe proteina FLICE (MACH) sau caspaza 8. Acest domeniu efector al mortii este specific pentru mai multe caspaze (caspazele 2, 8, 9, 10) fiind denumit CARD (caspazele recruitment domain) (Figura).
Sub actiunea cuplarii cu FADD, procaspaza 8 se poate activa prin clivare. Exista mai multe proteine citoplasmatice care pot sa interactioneze cu FADD, una dintre acestea este Daxx care insa poate sa activeze si alte cai de transductie a semnalului independent de FADD cum ar fi kinazele c-JUN.
Privita in ansamlu, cuplarea receptorului FAS cu FASL duce la transmiterea semnalului de transductie aceasta cale fiind una dintre principalele cai de transmitere a semnalului apoptotic.
Receptorul FAS se poate cupla in regiunea sa extracelulara cu portiunea Fc a imunoglobulinelor umane rezultand un complex FAS-Fc. Experimental apoptoza se poate bloca prin aceasta cuplare. Totodata cuplarea cu receptorul Fc de pe imunoglobuline ridica posibilitatea actiunii asupra receptorului FAS in absenta limfociteloc T, activitate purtatoare de FASL, mai ales in unele teritorii din organism unde acestea nu pot patrunde cum ar fi unele portiuni ale ochiului.
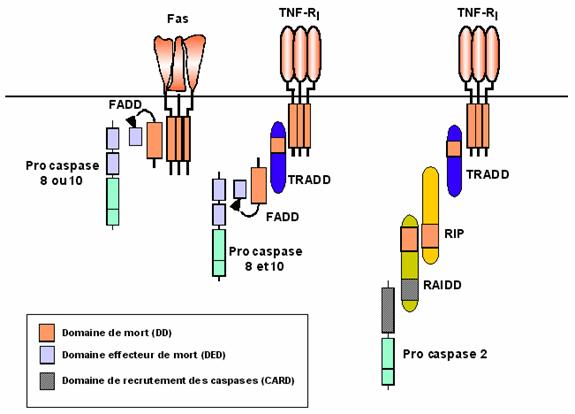 Figura Activarea
caspazelor prin intermediul receptorilor mortii
Figura Activarea
caspazelor prin intermediul receptorilor mortii
Determinarea genetica a complexului FAS/FAS1 se regaseste in aparitia spontana la soarece a unor mutatii "lpr" (lymphoproliferation) si "gld" (generalised lymphoproliferative disease) care sunt localizate la soarece pe cromozomul 19 si cromozomul 1. Fenotipic, aceste mutatii produc splenomegalie, adenopatie, mari cantitati de anticorpi inclusiv mari cantitati de anticorpi anti ADN factor reumatoid artrita si nefrita, soarecii murind dupa aproximativ 5 luni de la nastere.
Ulterior, s-a descoperit faptul ca lpr si gld sunt mutatii la nivelul genelor ce codifica perechi de proteine ce interactioneaza intre ele. Astfel gld afecteaza citokinele solubile sau membranare in timp ce rpl determina receptorii acestor citokine. Genele FAS au fost localizate langa locusul lpr pe cromozomul 19 la soarece (18,19). Genele lpr exprima in celulele din timus si ficat cantitati variabile de FAS si ARN. Transcriptia genelor fas este deteriorata de insertia unui element transportabil din intronul acestor gene. O mutatie punctiforma care apare in domeniul al mortii al FAS, respectiv inlocuirea izoleucinei cu asparagina duce la abolirea semnalului de transductie al receptorului FAS. Se considera ca orice mutatie lpr duce la scaderea sau pierderea functiilor receptorului FAS.
Genele care codifica FASL au fost localizate pe cromozomul 1 langa mutatia gld. Se cunosc destul de putine date despre acest amplasament dar s-au semnalat mutatii punctiforme la capatul carboxil terminal, codificate de aceasta regiune. O mutatie punctiforma, respectiv schimbarea fenilalaninei cu leucina in regiunea extracelulara a FASL duce la pierderea capacitatii de cuplare a ligandului cu receptorii FAS.
In afara de reglarea prin intermediul genelo,r exista si o serie de proteine care actioneaza ca reglatori ai semnalului transmis de FAS. De exemplu, c-abltirozinkinaza si proteinele de stres inhiba transmiterea semnalului prin intermediul FAS. Alte proteine cum ar fi proteina asociata FAS cresc semnalul apoptotic transmis prin FAS.
De asemenea, E-selectina actioneaza ca declansator al inducerii apoptozei prin calea receptorului FAS. Atat FAS cat si FASL exista sub forme solubile, ambele proteine fiind biologic active. Aparitia acestor forme poate sa aiba loc prin clivajul proteolitic al FAS si FASL de pe membranele celulare, prin intermediul proteinelor membranare sau prin producerea propriu-zisa a acestor proteine de catre celula. Se pare ca atat FAS cat si FASL sunt trunchiati (pierd de exemplu domeniul transmembranar, dar pastreaza capacitatea de a se lega intre ele ca si formele legate de membrana).
O serie de afectiuni cum ar fi bolile autoimune, prezinta forme solubile de FAS si FASL. Se pare ca formele solubile de FAS ar avea o actiune de blocare a apoptozei pe calea FASL care este exprimat de obicei pe suprafata unei celule efectoare si care se interactioneaza cu receptorul FAS de pe suprafata unei celule tinta si activeaza caspazele, inducand apoptoza.
Mai multe studii au aratat ca proteinele din clasa a II-a a HLA ar putea sa fie implicate in transmiterea semnalului apoptotic. Celulele purtatoare de antigen prezinta limfocitului T helper, antigenul procesat dar si un semnal secundar care ar putea duce la declansarea apoptozei limfocitelor b activate. Se considera ca stimularea limfocitelor B pe calea moleculelor HLA ar duce la aparitia pe suprafata acestora a FASL, ca si stimularea cu forbolester. Semnalele care vin pe calea HLA nu modifica expresia de receptor FAS, dar pot creste sensibilitatea la apoptoza indusa de receptorul FAS. Mai multe studii considera ca rolul FAS/FASL sau independent de FASL pe care limfocitele B il exprima in conditii speciale.
Cu toate acestea se considera ca prezenta antigenului de catre celulele purtatoare de antigen contribuie la reglarea numarului de celule B.
In hematopoeza, se considera ca HLA-DR mediaza semnale ce inhiba hematopoeza in maduva osoasa, printr-un mecanism ce implica functionalitatea sistemului FAS/FASL
Sistemul receptor pentru TNF(TNFR)/TNF
Factorul de necroza tumoral (TNF) este o citokina a carei actiune principala este distrugerea celulelor tumorale. Ea are un efect citotoxic asupra celulelor tumorale in mare parte necunoscut, dar efectul citotoxic nu se exercita si asupra celulelor normale. Descoperirea a fost facuta pe baza observatiilor lui Calley care a aratat ca daca pacientii au cancer dezvolta infectii bacteriene, unele tumori prezinta semne de necroza. Ulterior, asemenea altor citokine, TNF a fost izolat din supernatantul unor culturi bacteriene.
In afara de aceasta proprietate importanta a TNF, aceasta citokina are si alte actiuni importante in organism cum ar fi cea din raspunsul inflamator si din raspunsul imun actionand pe limfocitele T, limfocitele B, neutrofile, fibroblaste, celule endoteliale, celule ale maduvei hematogene in care se introduce secretia de diversi factori necesari in raspunsul inflamator si imun. De asemenea induce pe multe celule impreuna cu IL-1, exprimarea moleculelor de adeziune si este implicat in patogenia socului toxic bacterian
TNF se prezinta sub doua forme: TNF-a si TNF-b avand o structura identica in proportie de 28%, fiind codificate de dupa gene omoloage (9). TNF-a este secretata de macrofage si are un efect citotoxic pe celulele tumorale dar nu si pe cele normale, iar TNF-b este secretat de celulele T helper avand o activitate similara cu TNF-a crescand totodata activitatea macrofagelor si neutrofitelor. O serie de celule tumorale secreta atat TNF-a cat si TNF-b
Sunt cunoscute pana in prezent doua tipuri de receptori pentru TNF pe membrana celulara: receptorul pntru TNF de tip 1 (55-R sau p55 sau CD120a) si receptorul pentru TNF tip 2 (75-R).
TNFR-1 este exprimat pe o multitudine de celule din organism fiind considerat unul dintre primii receptori folositi in raspunsul inflamator. Experimental se cunoaste ca soarecii care au blocati receptorii de tip 1 pentru TNF alfa sunt rezistenti la socul endotoxic. Receptorii de tip 1 pentru TNF mediaza semnalele pentru formarea unor structuri limfoide, cum ar fi foliculii primari ai limfocitelor B sau centrii germinativi. Cuplarea receptorilor tip 1 pentru TNF cu TNF nu duce automat la moartea celulara prin apoptoza. Aceasta cuplare trebuie sa fie urmata si de cuplarea inregiunea intracitoplasmatica a acestui receptor de o serie de proteine adaptor, care in final activeaza celulele efectorii ele apoptozei, caspazele
Se considera ca receptorul de tip 1 induce citotoxicitatea iar TNFR 1(p60) mediaza citotoxicitatea si activarea factorului NF-kB, in timp ce functia TNFR2 (p80) nu este foarte clara. S-a observat pe culturi celulare care poseda numai receptorul TNFR1 ca daca se adauga prin transfer genetic TNFR2 efectul apoptotic este mai mare ceea ce denota existenta unui sinergism inactiuna acestor receptori . Receptorul de tip 2 pentru TNF (TNFR-2) este exprimat pe foarte multe tipuri de celule, dar are o capacitate mica de a se cupla de activa TNF-a legat de membrane. Spre deosebire de TNFR1, TNFR2 nu are domeniu mortii citoplasmatic, dar se poate cupla cu proteinele adaptor TNF-2 Aceasta cuplare poate constitui un semnal activator sau modulator al activitatii TNFR1. TNFR2 poate media proliferarea timocitelor independent de TNFR1
Exista o familie de receptori pentru TNF care mai cuprinde receptorii pentru limfotoxina B, receptorul pentru NGF, CD40, CD27, CD30. Aceasta familie de receptori are o structura similara in proportie de 25% in regiunea extracelulara. Domeniul extracelular al membrilor ecestei familii de receptori prezinta 2-6 domenii repetitive asemanatoare bogate in cisteina.
Familia de receptori TNF este intr-o continua crestere, descoperindu-se noi membrii cum ar fi DR-3, ESL-1, HVEM si CAR-1
Cuplarea TNF cu TNFR1 si TNFR2 poate induce semnalul pentru apoptoza. De asemenea, prin intermediul cuplarii atat cu TNFR1 cat si cu TNFR2 se poate induce factorul transcriptional NF-kB. In cele mai multe cazuri TNFR1 este responsabil pentru semnalul declansarii apoptozei. Pe de alta parte, TNFR2 este responsabil cu inducerea semnalului de proliferare pentru timocite .
Desi au o frecventa similara in portiunea extracelulara, membrii familiei receptorilor pentru TNF nu induc toti apoptoza atunci cand sunt activati prin cuplarea cu ligandul specific. Numai o parte din ei cum ar fi: CD40 si CD30 pot inhiba cresterea celulara inducand apoptoza. Cei mai multi receptori ai familiei induc semnale stimulatorii sau de activare.
Un alt membru al familiei TNF recent descoperit numit TRAIL are capacitatea de a induce epoptoza similar cu TNF. Este exprimat de celulele CD4+ si CD8+ ceea ce sugereaza faptul ca acest factor poate participa la inducerea apoptozi prin intermediul limfocitelor T.
Domeniul citoplasmatic al mortii intalnit la receptorul FAS ca si la TNFR1 se intalneste si la alti receptori din aceeasi familie: DR-4, Wsl-1 si la CAR-1 presupunandu-se ca acesti receptori transmit semnalul de inducere a apoptozei sau, cu exceptia FAS, semnalul pentru activarea factorului NF-kB.
Acest domeniu al mortii are tendinta de autoagregare, iar structura lui evidentiata in cazul FAS prin spectroscopie RMN multidimensionala heteronucleara, arata ca acest domeniu este o proteina cu o structura alcatuita din 6 alfa helixuri dispuse antiparalel, amfipatice. La suprafata sunt prezenti mai multi aminoacizi cu sarcina electrica responsabili de interactiunea dintre acest domeniu al mortii si alte substante , inclusiv cu proteine care prezinta acest domeniu. Structural, domeniul mortii (DD) este foarte asemanator cu alte domenii numite DED si CARD .
Mai multe citokine cunoscute cum ar fi: factorul de crestere hematopoietic, factorul stimulator al coloniilor si interferonii, induc interactia cu receptorii specifici, activarea acestor receptori si trecerea lor in forma dimera ceea ce are ca rezultat inducerea de semnale de proliferare si diferentiere.
Structura asemanatoare a FAS1 si TNF, ca si structura asemanatoare a receptorului FAS si a receptorului pentru TNF sugereaza faptul ca FAS1 induce trimerizarea la nivelul receptorului FAS, necesara initierii semnalului de inducere.
Chiar si celulele anucleate prezinta modificari de tip apoptotic ca rezultat al activarii receptoilor de tip FAS ceea ce sugereaza ideea ca aceste componente ale semnalului de inducere a apoptozei sunt prezente, iar activarea receptorului FAS ar fi un simplu trigger. Apoptoza indusa de FAS si TNFR1 nu necesita sinteza proteica, nu necesita prezenta nucleilor, se desfasoara relativ rapid si depinde in mica masura de calciul extracelular. Ceilalti receptori care prezinta similitidine in portiunea intracitoplasmatica cu domeniul al mortii al FAS sau TNFR1 cum ar fi DR4 CAR1 si Ws1 par a putea induce apopotoza dar intr-un timp mai lung, fara a se cunoaste pana in perzent alte caracteristici.
Sistemul DR-4/TRAIL
Familia de receptori DR cuprinde o serie de membrii cum ar fi DR1 si DR2 care leaga TRAIL/APO2L, DR3 care nu are secventa intermembranara receptorul DR4 aflat liber ca molecula secretata. Toti sunt considerati membrii ai familiei TNT. DR3 nu leaga TRAIL sau TNF alfa putand bloca astfel indepartarea celulelor canceroase de catre limfocitele T citotoxice, sau celulele NK care exprima FASL.
Cu tehnica PCR s-au determinat nivele crescute de DR3 in tumori primare de colon si pulmonare.
TRAIL (APO2L) este o proteina ce induce apoptoza in numeroase linii de celule transformate dar nu si in celulele normale. Chiar daca TRAIL se cupleaza cu receptorul sau specific, DR4 care este exprimat atat pe celulele transformate cat si pe celulele normale. Exista 2 receptori pentru TRAIL: DR4 si DR5 care apartin familiei de receptori care apartin familiei de receptori TNF cu care prezinta similitudini de structura. De exemplu DR4 prezinta o structura identica cu DR3(Apo3, WSL1) TRAMP sau LARD in proportie de 29% iar cu TNFR-1 de 19%. Ca si ceilalti receptori ai familiei TNF, proteina TRAIL (APO2L) contine o portiune extracelulara, doua domenii bogate in cisteina si o portiune intracitoplasmatica pe care se gaseste domeniul mortii pe care o contine numai DR5. DR4 nu contine portiunea citoplasmatica si din acest motiv receptorul DR4 a fost numit si TRID.
Cuplarea trail cu DR4 si DR5 poate induce activarea caspazelor dar printr-un mecanism independent de FADD, FAS si TNFR. Aceasta activare a caspazelor este mult mai importanta cand se face prin receptorul DR5 decat prin DR4.
Supraexpresia TRID in linii celulare in care TRAIL poate induce apoptoza protejeaza aceste celule de apoptoza indusa de TRAIL. In aceste celule supraexpresia de TRID nu induce apoptoza.
Sistemul DR4/TRAIL este in prezent putin cunoscut, cunoscandu-se ca prin formarea complexului DR5 cu TRAIL se poate activa FLICE2 (caspaza 10b). Nu se cunosc celelalte proteine care participa la complexul de proteine adaptor realizat de DR5 dar se considera ca TRID ar avea un reglator al apoptozei induse pe calea TAIL/DR5. portiunile intracitoplasmatice ale receptorului DR5 si DR4 (TRID) se pot lega de receptorul Fc de pe imunoglobulinele umane (lgG) cu toate consecintele care decurg.
Exista si un mecanism de protectie impotriva apoptozei induse de receptorii DR4 si DR5. Acest mecanism este constituit de un set de receptori capcana care intra in competitie cu receptorii DR4 si DR5, pentru a se cupla cu TRAIL Unul dintre acesti receptori capcana DcR2 (TRAIL-R4 sau TRUNDD) poate interactiona competitiv cu DR4 sau DR5 si prezinta si un domeniu citoplasmatic. Acest receptor, cand exista in nivele crescute in celule, interactioneaza cu NF-kB.
In afara de receptorii DR4 si DR5, s-au pus in evidenta si receptori DR3 care prezinta mai multe secvente de structura similare cu TNF R1.
La fel ca TNFR1, receptorul DR3 se leaga de ligandul sau specific (Apo3 ligand sau TWEAK) si poate activa NF-kB prin TRADD, TRAF-2 si RIP, precum si apoptoza prin TRAD, FADD si caspaza 8. In timp ce TNF este produs de macrofage si limfocite activate, ligandul receptorului DR3 se gaseste exprimat pe mai multe tesuturi. TNFR1 este exprimat pe numeroase celule in organism ; DR este exprimat de celulele sangelui periferic, timus, splina.
Factorul de transcriptie nuclear-kappa B (NF-kB)
Citokinele proinflamatorii cum ar fi TNF alfa ca si interleukina-1 induc rapid translocarea acestui factor prin degradarea IKB, o proteina citoplasmatica inhibitorie .
Factorul de transcriptie NF-kB induce transcriptia a numeroase gene care regleaza cresterea celulara, citokine si receptori de suprafata, molecule de adeziune. Principala tinta a NF-kB o reprezinta genele IAP a caror produsi, proteinele IAP, inhiba apoptoza. Transcriptia genelor IAP la care se adauga si transcriptia gtenelor care codifica proteinele TAF-1 si TRAF-2 este dependenta de activarea acestui factor. De asemenea, genele reglate de NF-kB sunt implicate in raspunsul inflamator .
Forma cea mai comuna a NF-kB este un heterodimer, respectiv o proteina de 50KD (p50) dar exista si o a doua forma, o proteina de 65 KD (RelA sau p65) Subunitatea RelA este necesara genelor dependente de TNF .
Sub actiunea sistemului apoptotic dat prin intermediul TNFR-1, NF-kB este activat protejand celula de a intra in procesul de apoptoza. Inhibarea acestui factor creste moartea celulara prin apoptoza, dar nu prin stimulii apoptotici ce nu activeaza acest factor.
Semnalul de apoptoza dat de TNF produce o serie de evenimente manifestate prin apoptoza si prin activarea NF-kB. Datorita faptului ca TNF-a si alti agenti apoptotici induc apoptoza prin semnale ce au o actiune crescuta in prezenta inhibitorilor secventei proteice, s-a presupus ca NF-kB actioneaza asupra unui grup de gene care codifica proteine protectoare impotriva apoptozei .
O serie de agenti terapeutici antitumorali care induc apoptoza in procesele tumorale au un efect mai scazut deoarece induc si aparitia de forme active de NF-kB. Se poate spune ca exista un feed-back negativ intreTNF si NF-kB, in care NF-kB inhiba apoptoza indusa de TNF. Aparitia formelor active de NF-kB reprezinta unmecanism celular de protectie antiapoptotic. S-a demonstrat ca unul dintre mecanismele antiinflamatoare al saluicilatilor este activarea NF-kB prin blocarea degrararii IkB .
Se considera caprin cuplarea TNF cu TNFR-1 se induce un semnal de declansare a apoptozei in celulele care prezinta acest receptor, si un alt semnal dependent de RelA cu actiune de protectie antiapoptotica.
Una din diferentele de transmitere a mesajului de inducere a apoptozei intre receptorul FAS si TNFR-1 este faptul ca receptorul FAS transmite acest semnal fara activarea NF-kB. Totusi, in unele circumstante, pe unele linii celulare, receptorul FAS poate induce activarea NF-kB. Astfel in prezenta inhibitorilor sintezei proteice si a inhibitorilor ARN, semnalul transmis de FAS poate induce comutarea spre activarea NF-kB.
Celula careia i s-a indus semnalul apoptotic prin TNFR1 mai poate fi salvata prin actiunea NF-kB, in timp ce apoptoza indusa prin FAS, mult mai rapida, nu mai poate fi oprita. Mecanismul de salvare la receptorul FAS este dat de prezenta unui domeniu de salvare, situat in portiunea COOH terminala a lantului peptidic si poate fi blocata de o proteina, tiron-fosfataza, blocandu-se astfel semnalul de declansare a apoptozei. Momentul sau conditiile cand acest receptor este blocat in acest mod sunt putin cunoscute.
Moleculele FLICE
Semnalul de inducere a apoptozei prin intermediul receptorilor TNF si a receptorului FAS duce in final la activarea caspazelor. Aceste enzime se gasesc sub forma inactiva, pana cand semnalul apoptotic activeza una dintre aceste enzime ceea ce are ca efect activarea in cascada a unui intreg lant de proteine cu activitate enzimatica. Rolul acestor proteine este de a media clivarea intracelulara a unor proteine vitale pentru celula, producand in final modificarile caracteristice apoptozei.
Cuplarea cu citokine a principalilor receptori prin care este indus semnalul apoptotic TNFR1 si receptorul FAS duce la o serie de modificari ale acestor receptori si cuplarea in portiunea intracitoplasmatica cu o serie de proteine care poseda un domeniu al mortii asemanator sau identic cu portiunea intracitoplasmarica a acestor receptori.
Se realizeaza un complex de proteine adaptor care inconjoara portiunea intracitoplasmatica a receptorilor FAS si TNF denumit DISC. Complexul realizat nu activeaza insa moleculele efectoare ale apoptozei respectiv caspazele. Cercetarile efectuate au dus la identificarea unei proteine numite FLICE care a prezenta proprietati deosebit de enteresante. Acestea rezulta din structura sa oarticulara, care prezinta domenii comune atat cu FADD cat si cu familia ICE/CED3 a caspazelor. Receptorul FAS se asociaza cu FADD prin intermediul domeniului mortii dispus in portiunea C-terminala intracitoplasmatica a acestui receptor. Un fragment de FADD care contine numai domeniul mortii functioneaza ca un potential reglator negativ al apoptozei induse prin FAS.
Capatul N-terminal poate fi un inhibitor pentru inducerea apoptozei, putandu-se considera ca acest segment al FADD este un adevarat domeniu al mortii "efector" .
FLICE contine doua lanturi N-terminale de 60 de aminoacizi fiecare. Intre anumite portiuni ale moleculei de FLICE (resturile de aminoacizi 7-75 si 101-169) exista o similitudine cu domeniul mortii al FADD de 55% ceea ce face ca FADD sa se poate cupla cu FLICE prin aceste domenii.
Ceea ce mai ramane din FLICE in afara domeniilor omoloage cu cele FADD sunt portiuni care au un grad mare de asemanare cu proteazele din familia ICE/CED3. Aceasta omogenitate se refera in special la domeniile activate ale acestor proteaze. Analizele structurale si filogenetice au aratat ca FLICE este un membru al familiei proteazelor ICE/CED3 alaturi de proteinele YAMA/CPP32, Mch-2, ICE-LAP6. Nu au mai fost identificate la nici un alt membru al familiei ICE/CED3 domeniile mortii asa cum s-au identificat la FLICE .
Se considera ca activarea receptorului FAS duce la recrutarea si asocierea cu FADD ceea ce are ca afect modificari conformationale ale domeniului mortii al FADD. Aceste modificari conformationale permit domeniilor mortii N-terminale ale proteazei FLICE sa se interactioneze cu domeniile mortii omologe de pe FADD. Disocierea acestui complex (DISC) duce la eliberarea de fragmente proteice (p20/p10) cu activitate enzimatica ce initiaza activarea in cascada a altor membrii ai familiei ICE/CED3.
Molecula FLICE a fost evidentiata atat in tesuturile embrionare, cat si in tesuturile adulte umane, dar nu si in tesutul nervos fetal. Cea mai mare concentratie de FLICE a fost evidentiata in limfocite, ceea ce demenstreaza ca apoptoza indusa prin FAS are un rol important in reglarea numarului acestor celule
Mai multe studii care au cautat sa evidentieze rolul pe care il are FLICE in declansarea apoptozei au aratat ca transferul acestor molecule in alte celule induce apoptoza. Supraexprimarea de FLICE, ca si cea a altor membrii ai familiei ICE/CED3 induce apoptoza. Inhibitorii de ICE pot inhiba inducerea apoptozei prin intermediul moleculei FLICE. De exemplu 2-VAD-mc care este un inhibitor puternic al apoptozei induse pe calea FAS blocheaza apoptoza indusa de FLICE . Molecula CrmA produsa de virusul pox blocheaza apoptoza indusa de molecula FLICE. Acest fapt dovedeste legatura care exista intre proteinele virale si sistemul apoptotic, sugerand faptul ca molecula FLICE poate fi tinta unor proteine virale care ar interfera sistemul apoptotic.
Urmarind rolul moleculei FLICE in inducerea semnalului apoptotic se pune problema daca aceasta molecula este specifica transmiterii semnalului prin intermediul moleculei FAS. TNFR1 se asociaza cu TRAD si cu RIP care contine de asemenea un domeniu mortii .
TNFR1 se poate asocia si cu TRAD care la randul ei se poate asocia cu FADD. Este posibil ca molecula FLICE sa se asocieze si cu complexul TNFR1/TRAD/FADD activand lantul caspazelor. Chiar daca aceasta ipoteza ar fi adevarata, molecula FLICE ramane un element mult maiimportant al receptorului FAS, decat al receptorului pentru TNF. Exista si proteine care ihiba activitatea proteinei FLICE. Una dintre acestea este proteina FLIP care prezinta doua domenii DD si un domeniu asemanator cu domeniul caspazelor, dar nu are activitate proteolitica. FLIP poate interationa cu FADD prevenind astfel activarea caspazei 8.
Moleculele MACH
O alta molecula cu functie asemanatoare cu FLICE este molecula MACH (molecula homologa cu CED3 asociata moleculei FADD/MORT1).
Descoperita concomitent cu FADD in anul 1996, molecula MACH are o greutate moleculara de 34 KD si este formata dintr-un singur lant de aminoacizi.
Exista foarte multe forme asemanatoare acestei molecule care prezinta capatul N-terminal comun (un numar de 182 de aminoacizi comuni) si care difera intre ele prin capatul C-terminal. Unele dintre aceste molecule prezinta la capatul C-terminal secvente asemanatoare cu proteinele familiei ICE/CED3. Aceste regiuni omologe ce au activiate proteazica de tip caspaza (ICE/CED3) pot induce activarea in cascada a acestor proteaze si apoptoza. Exista diferente intre izomorfele moleculei MACH si efectul de inducere a apoptozei, respectiv numarul de celule in care s-a produs apoptoza in cultur celulare, cand in aceste molecule s-a transferat molecula MACH. Acest fapt sugereaza ca MACH poate avea regiuni incomplete de tip ICE/CED3 care ar avea efect negativ asupra actiunii formelor cu aceste regiuni complate. Capatul N-terminal al MACH MACH beta prezintadoua secvente identice, care sunt omologe cu doua secvente de pe molecula FADD, altele decat secventele cu care aceasta proteina interactioneaza cu portiunea intracitoplasmatica a receptorului FAS.
Se considera ca semnalul apoptotic primit de FAS/APO1 sau TNFR1 duce la cuplarea acestora cu FADD, respectiv TRAD. Ulterior, acest complex se cupleaza cu moleculele de tip MACH si induc activarea in cascada a caspazelor.
Moleculele MACH sunt prezente in majoritatea tesuturilor, dar nivelele de exprimare difera de la tesut la tesut. Diferentele pot contribui la capacitatea diferita a tesuturilor de a raspunde la stimuli FAS/TNFR1.
Existenta numeroaselor izomorfe ale moleculei MACH sugereaza faptul ca aceasta ar avea si alte functii. De exemplu, formele cu regiuni incomplete ICE/CED3 inhiba activarea formelor MACH alfa1 si MACH alfa2 si pot bloca inducerea apoptozei atat pe calea receptorului FAS cat si pe cea a receptorului pentru TNF, constituind un mecanusm de protectie celular impotriva declansarii apoptozei .
Nu numai caspazele participa ca efectori ai apoptozei ci si o serie de enzime cum ar fi fosfolipazele si sfingomielinazele, cu rol mai putim important, dar inducerea activarii acestor enzime are loc tot prin semnalul primit de receptorii FAS/APO1 si TNFR1 .
Unele dintre aceste enzime pot fi activate prin clivaj proteolitic initiat de moleculele MACH, dar aceasta cale nu este exclusiva, existand si alte cai de activare independente de molecula MACH
Molecula MACH reprezinta un component important al transmiterii semnalului apoptotic de la receptori catre elementele efectoare ale apoptozei. Atat FADD cat si TRAD nu se pot combina decat cu o singura molecula, fie cu FLICE fie cu MACH sugerand o posibila relatie de competitie. Proteinele FLICE si MACH au fost descoperite concomitent in anul 1995 de doua grupuri de cercetatori independenti, utilizand doua metode diferite. Studiile ulterioare au aratat ca desi au mase moleculare diferite, proteinele au caracteristici asemanatoare in ceea ce priveste capacitatea lor de legare a moleculelor FADD si TRAD si proprietati enzimatice asemanatoare intre ele si grupul caspazelor. Mai mult, multiplele izoforme de MACH care au fost identificate a facut sa se considere ca FLICE si MACH reprezinta un acelasi grup de proteine cu activitate de tip caspaza numite caspaze 8. Se poate considera ca in complexul de inducere al semnalului mortii DISC intra si moleculele FLICE si MACH avand rolul nu numai de transmitere a semnalului mortii dar si de initiere a activitatii enzimatice a caspazelor. In cadrul acestui complex DISC are loc o autoactivare proteolitica prin oligomerizarea caspazei 8, ceea ce duce la activarea acesteia.
Moleculele FLASH
Aceste molecule descoperite recent au un rol similar cu FLICE si MACH, prezinta secvente similare cu CED4 de la C elegans si cu domenii efectoare (DED) ce pot interactiona cu domeniile similare ale caspazei 8 sau ale proteinelor adaptor. Aceasta proteina s-a pus in evidenta in numeroase celule ale mamiferelor. ARNm al proteinelor FLASH s-a evidentiat in timocite, hepatocite si in alte tipuri de celule. Stimularea receptorului FAS duce la inglobarea in complexul DISC a proteinei FLAS care se poate lega de proteina FADD sau cu procaspaza 8.
In complexul DISC, FLASH poate promova activarea procaspazei 8 cu ajutorul proteinei FADD. Ea are un rol foarte important in activarea caspazei 8, deoarece mutantii FLASH inhiba activarea acestei caspaze. De asemenea formele clivate de FLASH care contineau numai domeniul DED nu pot activa caspaza 8.
Rolul proteinei FLASH este totusi putin cunoscut. S-a demonstrat ca in unele tipuri de celule, complexul DISC format fara FLASH este suficient pentru a induce activarea caspazei 8, in timp ce in alte tipuri de celule, proteina FLASH este necesara activarii acestei caspaze.
S-a demonstrat ca in culturi celulare umane transfectate cu proteina FLASH, aceasta proteina a fost clivata proteolitic, fara interventia sistemului FAS. Se presupune ca prin acest mod s-ar putea activa caspaza 8 fara interventia sistemilui FAS .
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2026 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Esee pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








