
| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Hibridarea somatica |
Hibridarea somatica
HIBRIDAREA SOMATICA
Incrucișarea sexuata convenționala la plantele superioare implica un sistem complex de reglare a procesului de hibridizare in care incrucișarea este limitata la speciile de plante inrudite filogenetic. De asemenea, ameliorarea prin metode clasice prin care se dorește transferul unor caractere de la specii salbatice la varietați cultivate, este un procedeu de lunga lurata și necesita mai multe retro-incrucișari (back-cros in scopul eliminarii marii majoritați a genomului speciei salbatice și pastrarea numai a genelor utile la noul hibrid).
Pe langa metodele de fecundare in vitro și 'salvare a embrionilor imaturi', o alta metoda neconvenționala este recombinarea genetic prin fuziunea intre protoplaști somatic izolați in condiții in vitro și dezvoltarea ulterioara a plantelor hibride.
Incepand cu 1972, cand a fost raportata pentru prima data obținerea de plante hibride prin fuziunea de protoplaști de Nicotiana guauca x N. langsdorffii de catre Carlson și colaboratorii, tehnicile de obținere a protoplaștilor și de inducere a fuzionarii lor au fost permanent perfecționate.
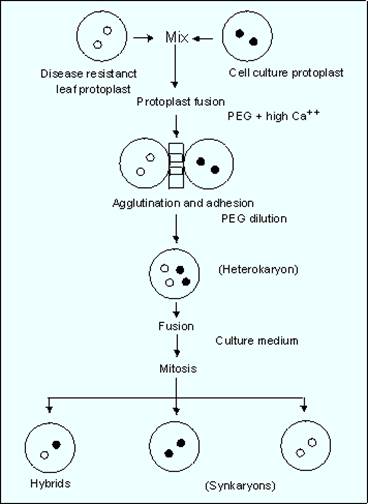
HIBRIDAREA SOMATICA consta in fuziunea celulelor somatice obtinute de la linii apartinand aceleasi specii, sau de la specii diferite. Prin fuzionarea protoplastilor apartinand unor linii sau specii diferite, se obtin hibrizi somatici. Daca in nucleul protoplastului a fost integrat material genetic strain (una, sau mai multe gene, sau constructii de gene), se obtin protoplasti transformati, din care pot regenera plante transgenece.
Acesta tehnologie presupune parcurgerea mai multor etape de lucru:
- izolarea protoplastilor apartinand celor doua specii implicate
specia donor de la care urmeaza sa se transfere caracterele dorite
specia receptor - la care urmeaza sa se realizeze introgresia genetica.
- inducerea fuziunii protoplastilor apartinand speciilor donor si receptor
- selectia produsilor de fiziune, respectiv a protoplastilor fuzionati din totalul amestecului de protoplasti
- regenerarea plantelor din calusurile / structurile regenrative obtinute din celulele hibride
- caracterizarea hibrizilor somatici si a descendentilor lor
- utilizarea hibrizilor somatici ca material initial in ameliorare
Izolarea protoplastilor.
Protoplastul reprezinta celula vegetala fara perete celular, care isi pastreaza capacitatea de de crestere, de diviziune si de refacere a peretelui celular indepartat. Protoplastul este un sistem experimental optim pentru manipulari genetice, pentru fuzionare sau inglobare de material genetic.
La inceput se folosea metoda mecanica, care consta in plasarea celulelor intr-o soluție hipertonica care determina plasmoliza celulelor, respectiv desprinderea protoplastului de peretele celular. Apoi, cu un cuțit foarte fin se elibereaza protoplaștii din țesuturi intr-o soluție cu presiune osmotica normala (deplasmoliza celulelor). Aceasta metoda a fost utilizata pentru izolarea protoplaștilor din celule vacuolizate (bulbi de ceapa, sau radacini de ridiche). Datorita eficienței foarte scazute, aceasta metoda este foarte rar utilizata, și numai in scop didactic.
Acum, pentru indepartarea peretelui celular se utilizeaza tratamente cu enzime care degradeaza structura complexa a peretelui celular, respectiv descompun compusi de celuloza, hemiceluloza (galactoza, xiloza, arabinoza) si pectinele (acizi poliglucuronic si poligalacturonic). Celulazele si pectinazele care distrug peretele celular se obtin din extractele ciupercilor Myrothecium verrucaria, Trichoderma viride si Aspergillus niger.
Obtinerea protoplastilor
Sursa ideala pentru obținerea protoplaștilor este reprezentata de tesuturile vegetale tinere: frunze, hipocotil, frunze cotiledonare, meristem, embrioni zigotici imaturi, suspensii de celule embriogene.
Daca se folosesc frunze tinere de la plante din camp sau sera, prima operatiune este eliminarea epidermei inferioare. Daca se folosesc plante in vitro, de la frunzele detasate se pastreaza doar mezofilul, indepartandu-se nervura principala si petiolul.
Tesutul vegetal selectat se taie in fragmente, sau fasii si se plaseaza in solutia de digestie enzimatica, care contine:
un stabilizator osmotic (manitol sau sorbitol), care asigura echilibrul osmotic intre interiorul celulei si mediul exterior al celulei si previne spargerea protoplastilor
o pectinaza, care dizolva lamela mijlocie a peretelui celular
celulaze si hemicelulaze, care degradeaza peretele celulozic si elibereaza protoplastii.
Concentratia enzimelor si durata tratamentului enzimatic aplicate in tehnica de obtinere a protoplastilor difera de la o specie la alta, de aceea trebuie stabilite experimental, influentand hotarator cantitatea si viabilitatea protoplastilor.
De obicei se folosesc amestecuri enzimatice alcatuite din: 0.5% macerozyme + 2% cellulase in 13% sorbitol or mannitol la pH 5.4.
Solutia rezultata in urma tratamentului enzimatic (suspensia de protoplaști) este apoi filtrata si centrifugata pentru eliminarea resturilor nedigerate. Pentru indepartarea completa din solutie a enzimelor de digestie, protoplastii izolati sunt spalati de 2-3 ori cu o solutie nutritiva izotonica, urmata de centrifugare.
Verificarea viabilitatii protoplastilor obținuți este esentiala. Aceasta se determina la microscopul optic: 1 ml solutie rezultata - colorata cu albastru Evans, sau diacetat de fluoresceina.
Fuziunea protoplastilor
In hibridarea somatica fiziunea protoplaștilor se realizeaza fie intre protoplaști aparținand unor specii diferite (fuziune interspecifica), fie intre protoplaști aparținand unor soiuri ale aceleași specii (fuziune intraspecifica). Pentru inducerea fuziunii se folosesc diferiți agenți de aglutinare și fuziune. De exemplu, in cazul celulelor cu origine animala se folosește virusul inactivat Sendai. La plante, in ultimii 30 ani pentru fuziunea protoplaștilor s-au utilizat cu succes diferite metode
(a) Tratamentul cu NaNO3. A fost utilizata pentru fuziunea protoplaștilor obținuți din varfuri de radacinide orz și din rasaduri de porumb. Metoda implica trei etape:
Izolarea protoplaștilor intr-o mixtura de 5% nitrat de sodiu in 10% sucroza și incubare pe baie de apa la 35°C. Se poate obține o frecvența mai mare de fuziune daca se centrifugheaza suspensia, iar apoi pelet-ul resuspendat in mixtura de nitrat de sodiu și sucroza este din nou menținut pe baie de apa la 35°C.
Soluția conținand protoplaști este trecuta pe un mediu solid. Rata fuziunii protoplaștilor poate fi periodic monitorizata prin examinare la microscopul inversat.
(b) Tratament cu ioni de calciu (Ca++) la ph ridicat. Protoplaștii se suspenda intr-o soluție cu rol de inducere a fuziunii, obținuta din 0,05M CaCl2 și 0,4M manitol la pH 10. Se centrifugheaza timp de 30 min, dupa care tuburile se trec pe baie de apa pentru 40-50 min la 37°C. Aceasta metoda poate asigura obținerea unui procent de 20-50% de protoplaști fizionați.
(c) Tratamentul cu polietilen glicol (PEG). Din 1974 se folosește metoda aceasta pentru fuziune intre protoplaștii de la specii neinrudite de plante (soia, tutun, porumb, orz), pentru fuziune intre protoplaști obținuți de la animale foarte diferite taxonomic și chiar pentru fuziune intre celule animale și vegetale. In plus, aceasta metoda s-a dovedit foarte eficienta, slab cito-toxica și reproductibila.
Aglutinarea protoplaștilor in timpul tratamentului cu PEG se poate obține prin doua metode diferite:
|
1 ml de mediu de cultura conținand protoplaști in suspensie + 1 ml soluție 56% PEG. Dupa agitarea amestecului timp de 5 sec, se lasa sa se formeze sedimentul de protoplaști. La microscop se pot obține rezultate privind gradul de fuzionare a celulelor nude;
In vase Petri conținand mediu de cultura adecvat se pun 4-6 picaturi mici de suspensii de protoplaști (donor și receptor) in amestec. Dupa 5-10 min la temperatura camerei se adauga la periferia vasului cateva picaturi de PEG. La interval de 30 min protoplaștii se spala cu apa bidistilata sterila și apoi sunt trecuți pe mediu de cultura care favorizeaza creșterea și fuzionarea lor.
© solutie PEG (25-40%) ©® solutie de fuziune
![]()
![]() © ® © ©® CR CR
© ® © ©® CR CR
® © ©® ©® Ca2+ (0,3M); pH = 10
Amestec de protoplasti Aglutinare Heterocarioni
apartinand linnilor C și R
d) Fuzionate in camp electric Daca o suspensie de protoplaști se pune intr-o micro camera de cultura cu electrozi, la care se aplica o diferența de potențial, protoplaștii se vor alinia intre cei doi electrozi. Printr-un șoc electric foarte scurt se poate induce fuziunea protoplaștilor.
© camp electric soc electric
![]()
![]() © ® © ©®©® CR CR
© ® © ©®©® CR CR
® © curent alternativ curent continuu 220V, 10-100milisec
0,5-1,5 MHz
Amestec Aglutinare Heterocarion de protoplasti
de protoplaști apartinand linnilor/speciilor C și R
Selectia produsilor de fiziune
Indiferent de metoda folosita, in amestecul final vor fi prezenți atat protoplasti nefuzionati, apartinand ambilor parinti, cat și homocarioni (sincarioni) si heterocarioni. Pentru selectia produsilor de fuziune in vederea cultivarii lor ulterioare si regenerarea de plante posedand material genetic de la ambele linii parentale, se folosesc medii de selectie a caror compozitie permit numai supravietuirea produsilor de fuziune. De exemplu, daca la fuziune au fost folositi protoplasti posedand gene pentru rezistenta la antibiotice diferite, selectia se va face pe un mediu continand ambele antibiotice, astfel, vor supravietui doar produsii fuzionati care poseda genele de rezistenta pentru ambele antibiotice.
In mod similar, daca la hibridare se folosesc protoplasti A iradiati cu nucleul inactivat si protoplasti B a caror citoplasma este nefunctionala (in urma tratamentului cu iod acetat), vor fi viabili doar produsii de fuziune care sunt alcatuiti din citoplasma protoplastilor A si nucleul protoplastilor B.
Produsii de fuziune vor fi cultivati pe medii cu compozitie adecvata, vor forma calusuri, din care, ulterior vor regenera plante care sunt de fapt hibrizi somatici.
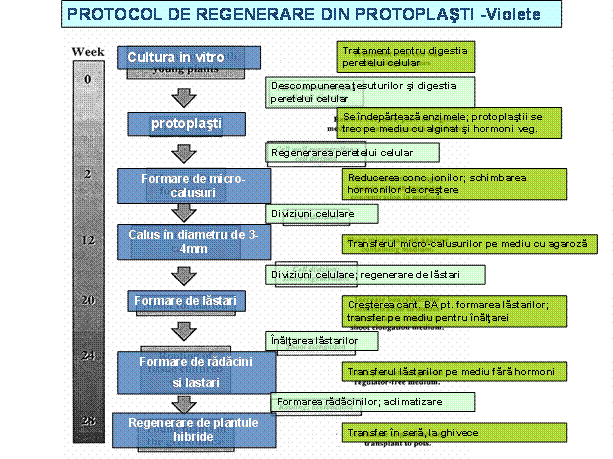
Regenerarea plantelor din calusurile / structurile regenrative obtinute din celulele hibride
Cultura protoplastilor
a) Protoplastii sunt cultivati intr-un mediu cu osmolaritate ridicata (mediu trebuie sa contina sorbitol, sau manitol)
b) Dupa 2-7 zile, perioada in care are loc refacerea peretelui celular si au loc primele diviziuni celulare, se transfera protoplastii pe un mediu cu compozitie asemanatoare, dar cu osmolaritate mai scazuta. Se verifica periodic densitate protoplastilor obtinuti prin diviziune.
c) Cand se atinge o densitate a numarului de protoplasti cuprinsa intre 0,5 si 2 x 105 protoplasti/ ml, se transfera pe un mediu a carui compozitie stimuleaza formarea de calus. Cel mai adesea se utilizeaza mediul Kao si Michaylux (1975).
d) Pentru inducerea proceselor regenerative, calusurile sunt transferate pe medii adecvate pentru inducere a embriogenezei somatice indirecte, sau a organogenezei indirecte. Compozitia acestor medii difera in functie de specie, dar cele mai eficiente s-au dovedit a fi mediile de baza B5 (Gamborg - 1968, sau Murashige&Skoog - 1962).
Regenerarea plantelor din cultura de protoplasti are loc prin procese regenerative indirecte, din calusuri, prin embriogeneza somatica sau organogeneza.
Pentru ca protoplastii sa poata fi utilizati in manipulari genetice - prin hibridare somatica, sau transfer de gene - protocolul pentru obtinerea protoplastilor, cultivarea si regenerarea lor trebuie sa fie reproductibil si sa asigure un minim de 10% regenerare.
5. Caracterizarea hibrizilor somatici si a descendentilor lor
Selectia hibrizilor trebuie sa fie urmata de confirmarea naturii hibride a plantelor obtinute, folosind diferite metode, dintre care mentionam:
a) Metode genetice: evidentierea cromozomilor, numararea si caracterizarea morfologica a lor sunt evidentiate prin tehnici citogenetice. In plus caracterele fenotipice determinate de genele citoplasmatice, respectiv - morfologia florilor, pigmentatia frunzelor si petalelor, androsterilitatea - sunt analizate comparativ: plantele obtinute prin fuziune protoplastilor si plantele parentale
b) Metode biochimice: studiul izoenzimelor planlelor hibride comparativ cu izoenzimele partenerilor participante la fuziune si evidentierea lor prin electroforeza
c) Metode moleculare: care constau in determinarea anumitor secvente de ADN specifice din nucleu, mitocondrii si cloroplaste si verificarea identitatii lor - plante participante la hibridare comparativ cu cele obtinute.
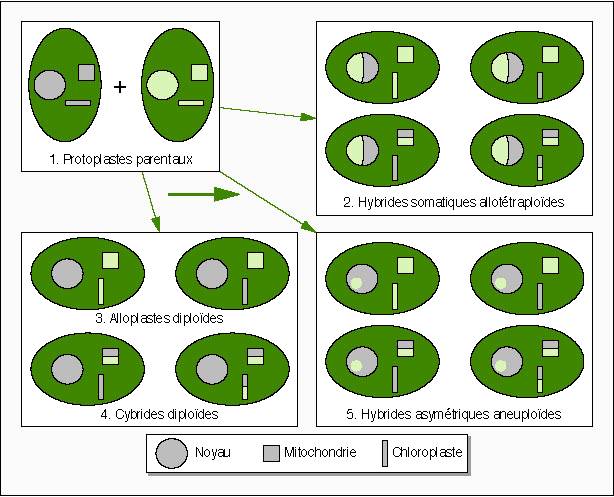
Evenimente genetice nucleare post fuziune au fost adesea observate la plante. In urma fuziunii protoplastilor, informatia genetica nucleara poate evolua diferit:
are loc aditia completa a genomurilor nucleare și astfel iau nastere hibrizii somatici simetrici
dupa fuziune are loc eliminarea partiala a unuia dintre genomurile nucleare, astfel se formeaza hibrizii somatici asimetrici
dupa fuziune, la primele diviziuni celulare se pierde complet informatia genetica a unui nucleu, astfel iau nastere cibrizii, care contin citoplasma hibrida si nucleul de la un singur partener.
Ex: din hibridari intraspecifice s-au obtinut atat protoplasti simetrici, cat si protoplasti cu numar diferit de cromozomi (aneuploizi si poliploizi) la Nicotiana, Petunia, Datura, Daucus.
Fuziunea protoplastilor obtinuti din specii indepartate filogenetic, adesea este urmata de eliminarea spontana, preferentiala a cromozomilor unuia dintre parteneri, rezultand hibrizi asimetrici, partial fertili. Ex: in cazul hibridarii protoplastilor de Arabidopsis cu Brassica, s-au obtinut plante de tip Arabidopsis, dar si plante tip Brassica.
Utilizarea hibrizilor somatici ca material initial in ameliorare
Initial hibridarea somatica a fost utilizata doar la unele specii 'model', care apartineau familiilor: Solanaceae, Cruciferae si Leguminosae. Hibridarea somatica reprezinta doar o etapa in procesul de introgresie a unor gene de la o specie donor la o alta specie cultivata. Ulterior urmeaza serii repetate de retroincrucisari si selectii.
Aplicații ale hibridizarii somatice:
depasirea barierelor de incompatibilitate sexuala. Fuziunea celulelor somatice este singura care permite recombinarea genomurilor parentale intre plante care in mod normal nu se pot reproduce sexual (se reproduc asexuat, sau sunt sterile)
cresterea gradului de variabilitate genetica - obținerea de plante fertile diploide, sau poliploide prin fuziunea protoplaștilor sexual sterili proveniți de la plante haploide, triploide, sau aneuploide)
obtinerea de cibrizi
transferul androsterilitatii, care are aplicații extraordinare in ameliorarea plantelor
rearanjarea genomurilor citoplasmatice.
4. Somatic cell fusion is useful in the study of cytoplasmic genes and their
activities and this information can be applied in plant-breeding experiments.

|
Fuziunea protoplaștilor B. napus cu B. nigra |
Plasmodiophora brassicae-planta infectata in dreapta cu simptome specific. Stanga - planta hibrida |
Lista hibrizilor intergenerici obținuți prin fuziunea protoplaștilor
|
Specii parentale |
Noul gen obținut |
|
Raphanus sativus (2n = 18) + B. oberacea (2n = 18) |
Raphanobrassica |
|
Moricandia arvensis (2n = 24,28) + B. oberacea (2n = 18) |
Moricandiobrassica |
|
Eruca sativa (2n = 22) + B.napus (2n = 38) |
Erucabrassica |
|
E. sativa (2n = 22) + B. juncea (2n = 36) |
Erussica |
|
Diplotaxis muralis (2n= 42) + B.napus (2n = 38) |
Diplotaxobrassica |
|
D. muralis (2n = 42) + B. juncea (2n = 36) |
Diplotaxojuncea |
|
Sinapis alba (2n= 24) + B.napus (2n = 38) |
Sinapobrassica |
|
S. alba (2n= 24) + B.oleracea (2n = 18) |
Sinapo-oleracea |
|
Nicotiana tabacum (2n = 24) + Lycopersicon esculentum (2n = 24) |
Nicotiopersicon |
|
N. tabacum (2n = 24) + Petunia inflorata (2n = 14) |
Nicotiopetunia |
|
Solanum tuberosum (2n = 24) + Lycopersicon esculentum (2n = 24) |
Solanopersicon |
|
Daucus carota (2n = 18) + Petroselinum hortense (2n = 22) |
Daucoselenium |
|
Datura innoxia (2n = 48) + Atropa belladona (2n =24) |
Daturotropa |
|
Oryza sativa (2n = 24) + Echinochloa oryzicola (2n = 24) |
Oryzochloa |
Lista hibrizilor interspecifici obținuți prin fuziunea protoplaștilor
Specii parentale și numarul de cromozomi Nr. Cromozomi la hibrizi
|
Brassica oleracea (2n=18) + B.camperstris (2n=20) |
Variație foarte mare |
|
B. napus (2n = 38) + B. oleracea (2n = 18) |
|
|
B. napus (2n = 38) + B. nigra (2n = 16) |
|
|
B. napus (2n = 38) + B. carillata (2n = 34) |
|
|
B. napus (2n = 38) + B juncea (2n = 36) |
|
|
Nicotiana glauca (2n = 24) + N. longsdorffii (2 n = 18) |
|
|
N. tabacum (2n = 48) + N. alata (2n = 18) |
|
|
N. tabacum (2n = 48) + N. glauca (2n = 24) |
|
|
N. tabacum (2n = 48) + N. glutinosa (2n = 24) |
|
|
N. tabacum (2n = 48) + N. knightialla (2n = 24) |
|
|
N. tabacum (2n = 48) + N. mesophila (2n = 48) |
|
|
N. tabacum (2n = 48) + N. octophora (2n = 24) |
|
|
N. tabacum (2n = 48) + N. rustica (2n = 48) |
|
|
N. tabacum (2n = 48) + N. stocktonii(2n = 48) |
|
|
N. tabacum (2n = 48) + N. sylvestris (2n = 24) |
|
|
N. tabacum (2n = 48) + N. plumbaginifolia (2n = 20) |
|
|
Petunia parodii (2n = 48) + P. hybrida (2n = 14) |
|
|
P. parodii (2n = 14) + P. hybrida (2n = 14) |
|
|
P. parodii (2n = 14) + P. parviflora (2n = 18) |
|
|
Solanum tuberosum (2n = 24, 48) + S. chapcoense (2n = 14) |
|
|
S. tuberosum (2n = 24, 48) + S. brevidens (2n = 24) |
|
|
Lycopersicon esculentum (2n = 24) + L. peruvianum (2n = 24) |
|
|
Daucua carota (2n = 18) + D. capillifolills (2n = 18) |
|
|
Datura innoxia (2n = 24) + D. stramonium (2n = 24) |
|
|
D. innoxia (2n = 24) + D. sanguinea (2n = 24) |
|
|
D. innoxia (2n = 24) + D. candida (2n = 24) |
|
Hibrizi intergenerici obținuți in cadrul familiei Brassicaceae
|
Arabidopsis thaliana (2n = 10) + B.campestris (2n = 20) |
Arabidobrassica |
|
Thlaspi perfoliatum (2n = 14) + B.napus (2n = 38) |
Thlaspobrassica |
|
Barbarea vulgaris (2n = 16) + B.napus (2n = 38) |
Barbareobrassica |
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2024 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Esee pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








