
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Biologie
|
|
Qdidactic » didactica & scoala » biologie Citoscheletul |
Citoscheletul
CITOSCHELETUL
Faza solida sau polimerizata a citoplasmei sau citoscheletul este o retea complexa, tridimensionala alcatuita din filamente proteice,care se intretaie in toate directiile si de care depinde forma celulei, miscarile celulare si organizarea interna, spatiala a citoplasmei. De asemenea, citoscheletul interactioneaza cu macromoleculele din citosol, cu organitele celulare si cu plasmalema, generand citoscheletul de membrana, care constituie suportul pentru membrana celulara.
Citoscheletul este o structura dinamica care se modifica in functie de necesitatile de moment ale celulei. Caracterul dinamic este asigurat de fenomenele de polimerizare si depolimerizare ale filamentelor proteice care alcatuiesc citoscheletul.
Proteinele care intra in structura citoscheletului sunt:
filamente de miozina;
filamente de actina;
filamente intermediare si proteine adezive;
microtubulii
Filamentele de miozina
Miozina este o holoproteina intalnita in aproape toate tipurile de celule eucariote, concentratia ei cea mai mare fiind inregistrata in celulele musculare. Molecula de miozina este formata din 6 lanturi polipeptidice, dintre care doua sunt lanturi grele iar doua perechi sunt lanturi usoare.
Molecula de miozina prezinta o coada, formata din portiunile alungite ale lanturilor grele rasucite in dublu helix si un cap bilobat, alcatuit din capetele lanturilor grele, de care sunt atasate cele doua perechi de lanturi usoare (Fig. 21).
Miozina se caracterizeaza prin activitate ATP-azica, datorita careia poate interactiona cu actina (in absenta actinei, activitate ATP-azica nu este detectabila, iar in prezenta acesteia, fiecare molecula de miozina poate hidroliza intre 5 si 10 molecule de ATP pe secunda).
Lant usor Lant
usor
Rasucire in dublu helix Lanturi grele -coada- Cap globular bilobat![]()
![]()
![]()
![]()

Fig. 21. Structura moleculei de miozina (Mariana Sincai, 2000)
Moleculele de miozina prin polimerizare formeaza filamente de miozina. Acestea au o structura caracteristica bipolara, datorata asocierii cozilor de miozina intr-o zona mijlocie, mai subtire, in timp ce capetele globulare se dispun la extremitatile filamentelor (Fig. 22).
Filament de miozina in fibrele musculare Filament de miozina in celulele nemusculare


Fig. 22. Filamentele de miozina (Mariana Sincai, 2000)
|
In celulele nemusculare, filamentele de miozina rezulta din polimerizarea a 10 - 20 molecule de miozina sunt mai scurte si au un caracter labil. Cand se asociaza cu actina, filamentele de miozina au rol in unele miscari celulare.
In celulele musculare, filamentele de miozina sunt alcatuite din aproximativ 500 molecule de miozina. Acestea sunt structuri stabile, aranjate ordonat intr-o retea hexagonala impreuna cu filamentele de actina, realizeazand contractia musculara.
Filamentele de actina
Actina este o proteina intalnita in toate tipurile de celule, prezentandu-se sub doua forme: cea de monomer sau actina globulara (actina G) si cea polimerizata sau actina filamentoasa (actina F).
Din totalul de proteine ale celulei eucariote, actinele reprezinta 5 - 15%.
Actina G este alcatuita dintr-un singur polipeptid, de care este atasat un ion de calciu care ii stabilizeaza conformatia globulara si o molecula de ATP.
Prin polimerizarea actinei G rezulta actina F, filamentoasa, fiecare monomer fiind orientat aproape perpendicular pe axul helicoidal. Doua lanturi de actina filamentoasa se asociaza infasurandu-se in dublu helix, rezultand microfilamentele de actina. In celulele musculare, filamentele de actina mai contin asociate si alte proteine (Fig. 23).
Tropomiozina
![]()
![]()
Fig. 23. Structura microfilamentului de actina (Mariana Sincai, 2000)
Microfilamentele de actina prezinta polaritate, cele doua capete fiind diferite, fenomen care determina interactiunea actinei cu miozina si respectiv motilitatea celulara.
In celulele nemusculare, filamentele de actina se gasesc izolate sau mai ales grupate in manunchiuri, formand spre exemplu:
fibrele de stres de la periferia celulelor;
inelul tranzitoriu care va imparti celula in doua la sfarsitul diviziunii celulare;
legaturile intercelulare de tipul desmozomilor.
De asemenea, ansambluri de filamente de actina se intalnesc in prelungirile celulare cu caracter permanent (in microvilii celulelor absorbante si in stereocili) precum si in cele cu caracter temporar (pseudopodele macrofagelor si fibroblastelor).
In celulele nemusculare filamentele de actina indeplinesc doua roluri esentiale:
structural sau de sustinere (ca suport al prelungirilor celulare);
dinamic (in motilitatea pe baza mecanismului molecular de interactiune al actinei cu miozina).
Procesele de polimerizare si depolimerizare ale actinei joaca un rol principal in tranzitiile intre starea de gel si sol ale citoplasmei. Polimerizarea actinei este inhibata de unele droguri sau metaboliti (citocalazine) secretati de diferite mucegaiuri si care astfel blocheaza miscarile celulare care au la baza interactiunea miozina+actina, de ex: locomotia ameboidala si fagocitoza.
Pe de alta parte un alcaloid foarte toxic -faloidina- produs de o ciuperca din genul Amanita, respective Amanita phalloides, inhiba depolimerizarea actinei, mentinand contractia.
Filamentele intermediare
Proteinele care alcatuiesc filamentele intermediare sunt molecule filiforme. Procesul de polimerizare se realizeaza prin alaturarea si impletirea lor ca intr-o franghie, aceasta structura, conferind filamentelor o mare stabilitate. Odata asamblate filamentele intermediare nu se mai depolimerizeaza, intre subunitati existand adesea legaturi covalente de intarire. Aceste filamente ale citoscheletului sunt pozitionate mai ales in profunzimea citoplasmei, desi se pot observa si la periferia celulei, de exemplu in desmozonii sau in prelungirile neuronului (axon).
O caracteristica a filamentelor intermediare este aceea ca proteinele componente sunt foarte diferite dupa tipul de celula in care apar si dupa specie.
Se cunosc cinci tipuri de filamente intermediare, dupa cum urmeaza:
Filamentele de cheratina cunoscute si sub numele de tonofilamente sunt caracteristice celulelor epiteliale, in care formeaza o adevarata retea ancorata de jonctiunile celulare de tipul desmozomilor. Au rol structural, conferind rezistenta epiteliilor la factori mecanici. In celulele mature ale epidermului filamentele de cheratina devin mai numeroase si se leaga prin punti disulfidice, iar dupa moartea celulelor genereaza stratul cornos sau diferite productii cornoase.
Neurofilamentele se intalnesc in neuroni, fiind alcatuite din trei polipeptide cu greutati moleculare diferite. Sunt structuri relativ fixe pentru toata viata si au mai ales un rol de sustinere a prelungirilor neuronale.
Filamentele de vimentina (lat, vimentus = nuia; ramurica ondulata) sunt caracteristice celulelor mezenchimale si frecvent intalnite in fibroblaste, macrofage, celulele endoteliale si in celulele musculare netede.
Filamentele gliale sunt alcatuite din vimentina si o proteina gliala fibrilara acida. Sunt prezente in celulele gliale din tesutul nervos.
Filamentele de desmina (scheletina) se intalnesc in celulele musculare striate si in miocitele netede cu exceptia celor din peretii vaselor de sange. Au rol in sustinerea miofibrilelor.
Functiile filamentelor intermediare nu sunt inca bine clarificate, dar identificarea tipului, folosind anticorpi cu afinitate speciala sau monoclonali pentru proteinele care le compun, este de importanta practica pentru depistarea cancerului, prin stabilirea tipului de celula din care provine o tumora. Astfel, clasificarea tumorilor dupa tipul specific de filamente intermediare a inceput sa fie folosita in clinica pe baza diagnosticului histologic: carcinoame, sarcoame, glioame, neuroblastoame, miosarcoame etc. Chiar si cand apar metastaze se pastreaza si in acestea tipul de filament intermediar caracteristic celulei de origine a cancerului.
Dintre proteinele adezive existente in citoplasma, redam in continuare cateva care au fost identificate pana in prezent.
spectrina, o proteina scheletala majoritara, cu mare flexibilitate si care prin legare cap la cap formeaza tetrameri, octomeri etc.;
anchirina (nectina, sindeina), o proteina cu forma rotunda sau piramidala;
actina, sub forma unor mici fragmente din subunitati globulare;
proteina benzii 4,1, o mica proteina globulara;
riboforina, o proteina care leaga ribozomii la suprafata reticulului endoplasmatic;
fimbrina, care intra in structura microvililor etc.
Microtubulii
Microtubulii sunt formatiuni citoplasmatice rezultate din polimerizarea unor proteine globulare numite tubuline. In procesul de polimerizare participa un dimer alcatuit din doua polipeptide: alfa-tubulina si beta-tubulina.
Prin polimerizarea dimerilor se formeaza protofilamente (protofibrile). Microtubulii rezulta din asamblarea a 13 protofibrile sub forma unui cilindru cu o lungime de cativa micrometri (Fig. 24).
In procesul de polimerizare al tubulinelor este implicat GTP si nu ATP ca si in cazul actinei.
Microtubulii prezinta o polaritate in sensul ca la unul din capete predomina asamblarea dimerilor, aceasta fiind capatul +, iar la celalalt capat are loc depolimerizarea, capatul -.
Procesul de polimerizare si depolimerizare al microtubulilor este influentat de o serie de factori, dupa cum urmeaza:
temperatura: la 37 0C, polimerizarea se realizeaza spontan, iar la 0 0C are loc depolimerizarea;
prezenta ionilor de Ca+2 (in concentratie mica, Ca+2 produce polimerizarea, iar daca se mareste concentratia se produce depolimerizarea microtubulilor) si Mg+2 este necesara fenomenului de polimerizare;
prezenta unor proteine asociate microtubulilor accelereaza polimerizarea;
actiunea unor alcaloizi: colchicina, vimblastina, vincristina blocheaza polimerizarea tubulilor;
actiunea unor medicamente, de ex. taxolul favorizeaza procesul de polimerizare.
Capatul " (de poli si
depolimerizare rapida)
Capatul "- " (de poli si depolimerizare lenta) beta-tubulina alfa-tubulina Dimeri de tubuline Protofilament
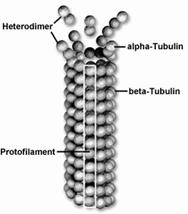
Fig. 24. Structura microtubulilor
Microtubulii se pot gasi liberi in citoplasma sau sub forma de ansambluri de microtubuli, intrand in structura cililor si flagelilor, a centriolilor si fusului de diviziune.
Microtubulii liberi din citosol si cei din fusul de diviziune sunt structuri labile, comparativ cu microtubulii care intra in structura organitelor celulare (cili, flageli, centrul celular).
Rolul microtubulilor. In celula microtubulii indeplinesc doua roluri esentiale:
rol structural, prin care microtubulii determina formarea celulei si a prelungirilor permanente ale acesteia (axoni, dendrite, cili, flageli), participa substantial in alcatuirea citoscheletului, determina distributia filamentelor intermediare si a filamentelor de actina si genereaza o serie de suporturi in citoplasma pe care se deplaseaza o serie de macromolecule(pigmenti, produsi de neurosecretie etc.) sau se ataseaza o serie de substante cum sunt unele enzime.
rol dinamic, prin care microtubulii intervin in unele tipuri de miscari celulare care au la baza mecanismul molecular microtubuli+dineina, (de ex.: miscarea cililor si a flagelilor, diviziunea celulara).
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Documente online pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








