
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Biologie
|
|
Qdidactic » didactica & scoala » biologie Modificari biochimice induse de extractul de Pleurotus ostreatus la nivelul liniei celulare de adenocarcinom colorectal - caco-2 |
Modificari biochimice induse de extractul de Pleurotus ostreatus la nivelul liniei celulare de adenocarcinom colorectal - caco-2
Modificari biochimice induse de extractul de Pleurotus ostreatus la nivelul liniei celulare de adenocarcinom colorectal - Caco-2
MATERIALE SI METODE
1.Linia celulara Caco-2
Caco-2 este o linie celulara de adenocarcinom colorectal, cu o structura epiteloida, provenita de la un caucasian de sex masulin, adult in varsta de 72 de ani. [Figura 8].
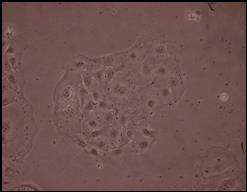
a b
Figura 8: Camp de celule Caco-2 in mediu MEM cu 20% ser fetal bovin: a) densitate mica; b) densitate mare.
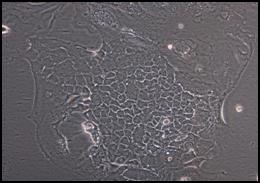
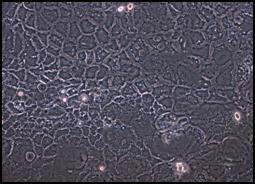
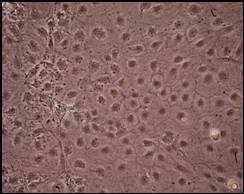
a b
 c
c
Figura 9: Campuri de celule Caco-2 cultivate in mediu MEM cu 20% ser fetal bovin: a) 24 ore; b) 72 ore; c) 96 ore.
Punerea in cultura a celulelor Caco-2
Mediul de cultura MEM Minimum essential medium Eagle cu 2 mM L-glutamina, suplimentat pentru a contine 1,5 g/L bicarbonat de Na, 0,1 mM aminoacizi neesentiali, 1 mM piruvat de Na si 20 % ser fetal bovin, fiind adaugat si un mix antibiotic (penicilina, streptomicina, amfotericina). Culturile au fost incubate in atmosfera umeda, cu CO2 5%, la 37sC. Solutia finala prezinta un pH = 7,2 - 7,4. Schimbarea mediului se realizeaza la 2-3 zile. Pentru tripsinizare s-a folosit tripsina 4X.
Decongelarea celulelor
Tuburile cu celule congelate la -80 C se decongeleaza rapid la 37°C si suspensia de celule este trecuta in tuburi de centrifuga ce contin 5 ml mediu MEM. Se centrifugheaza 10 min. la 1500 rpm iar sedimentul de celule se reia intr-un volum minim de mediu, se numara celulele si se distribuie in flaskuri la densitatea celulara dorita.
2.Obtinerea si caracterizarea extractului de Pleurotus ostreatus
2.1.Protocol de extractie a Pleurotus ostreatus
Obtinerea extractului de Pleurotus ostreatus s-a realizat prin folosirea metodei descrise de Dubois si colaboratorii sai.
Intr-o prima etapa are loc uscarea a 3,5 kg de Pleurotus ostreatus, la 75sC timp de 48 h intr-o etuva cu ventilatie dupa care se macina produsul rezultat. Urmeaza o etapa de refluxare cu CHCl3:MetOH (2:1v/v),la 60sC timp de 4 h, repetata de 3 ori. Are loc preluarea sedimentului in urma filtrarii la vid si refluxarea lui. Supernatantul se poate pastra pentru reciclare, folosind distilarea simpla. Urmeaza o noua etapa de refluxare cu MetOH:H2O (4:1v/v),la 60sC timp de 3 h, repetata de 3 ori. De asemenea, are loc preluarea sedimentului in urma filtrarii la vid si refluxarea lui.
Urmeaza o etapa de uscare la 50sC intr-o etuva cu ventilatie peste noapte. Apoi are loc extractia in H2O la 75-95sC, urmata de o concentrare prin evaporare folosind un stirer. Se centrifugheaza la 1500 rpm si se pastreaza supernatantul. Urmeaza o serie de spalari cu EtOHabs la 4sC: centrifugare, pastrare sediment, resuspendare in apa, precipitare cu EtOHabs - repetare pana la o culoare deschisa a precipitatului.
In final are loc uscarea precipitatului la 85sC, intr-o etuva cu ventilatie timp de 24 h, urmata de macinarea precipitatului uscat.
2.2.Protocol de dozare a polizaharidelor
Dozarea cantitatii de zaharuri simple, oligozaharide, polizaharide si derivatii lor care poseda grupari reducatoare a fost realizata prin metoda descrisa de Dubois, Gilles, Hamilton, Rebers, Smith, 1956.
Pentru aceasta se pun intr-o eprubeta 0,2 ml de proba din care dorim sa dozam zaharurile reducatoare, se adauga 0,2 ml solutie fenol 5% si 2 ml acid sulfuric concentrat, se agita energic, dupa care proba este lasata la temperatura camerei timp de 30 de minute.
Densitatea optica este transformata in termeni de concentratie cu ajutorul unei curbe etalon.
Se traseaza curba etalon prin indicarea pe abscisa a concentratiilor (μg glucoza 50mg%/0,2 ml), iar pe ordonata a D.O. la 490nm.
3.Testul de viabilitate MTT [bromura de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazoliu]
In vederea analizarii efectului extractului de Pleurotus ostreatus asupra viabilitatii celulare, s-a folosit un test de citotoxicitate, celulele intestinale Caco-2 fiind tripsinizate, spalate si insamantate pe placute cu 12 godeuri, la o densitate de 104 celule in 1 mL mediu / godeu, timp de 24 de ore, dupa care au fost tratate cu extractul de Pleurotus in concentratie de 5ug/mL, 20ug/mL si 100ug/mL la interval de 24 de ore. Metoda MTT, de monitorizare a viabilitatii celulare s-a bazat pe masurarea activitatii dehidrogenazei mitocondriale existenta in celulele viabile.
Numarul celulelor viabile este determinat indirect prin reducerea colorantului MTT ( 500 µl MTT / godeu) timp de 2 ore la 37 C. Cantitatea de MTT-formazan a fost determinata spectrofotometric (DO 595nm), dupa ce a fost dizolvata in 500 µl de izopropanol 100 %, in prealabil celulele fiind spalate cu 1mL PBS / godeu.
4.Determinari biochimice
4.1.Obtinerea lizatului celular
Pentru obtinerea lizatului celular mai intai se tripsinizeaza celulele si se face o centrifugare la 1500rpm/ 10 min/ 18oC, pentru a putea prelua celulele. Sedimentul este spalat cu 4 ml PBS, dupa care se face inca o centrifugare la aceeasi parametrii (1500rpm/ 10 min/ 18oC). Supernatantul se arunca, iar sedimentul este resuspendat in 2ml solutie de liza celulara (Tris-HCl 20 mM, pH 7.5, PMSF 0,5 mM, NaCl 0,3 M, Triton 0,2%). Pentru a obtine extractul proteic celulele sunt sonicate: 3 x 30 secunde pe baia de sonicare si 30 secunde pe gheata. Se face o centrifugare la 3000rpm/ 15 min/ 4oC pentru a inlatura debriurile celulare. Supernatantul este alicotat si conservat la -80oC pana in momentul determinarilor biochimice.
4.2.Dozarea proteica prin metoda Lowry
Metoda folosita pentru determinarea concentratiei proteice a fost metoda clasica a lui Lowry (1951). Gruparile peptidice formeaza cu ionii de cupru (Cu2+), in mediu alcalin, un complex colorat albastru care are un maxim de absorbtie la λ=660nm. Dozarea concentratiei proteice a extractelor proteice totale a fost realizata utilizand ca standard o solutie 10 mg % albumina serica bovina (BSA). Concentratiile probelor de albumina serica bovina utilizate ca standard au fost cuprinse intre 20 si 100 µg/ml.
4.3.Determinarea concentratiei glutationului redus(GSH)
Evaluarea nivelului intracelular de glutation redus ( glutamil cisteinil glicina), precum si a celui existent la nivelul fractiei mitocondriale, a fost realizata utilizand kitul de dozare de GSH de la Chemicon, care se bazeaza pe capacitatea monoclorbimanului (MCB) de a se lega la glutationul redus (GSH), acest reactiv avand o afinitate scazuta pentru alti compusi tiolici din celula si folosind ca standard o solutie de GSH 50 mM realizata in tampon fosfat salin (PBS 1x). Colorantul MCB necomplexat cu GSH nu prezinta fluorescenta, in timp ce complexul format de MCB si GSH are o fluorescenta albastra cu excitatie - 380nm si emisie - 461nm. In vederea dozarii GSH, celulele tratate cu extract de Pleurotus ostreatus au fost spalate de doua ori cu 1ml de tampon de spalare. Apoi a fost omogenizat in 0,5ml tampon de liza si s-a efectuat o centrifugare la 700 g / 2min. / 4°C. Dupa o perioada de incubare de 10 minute, pe gheata si o centrifugare la 12000 x g / 10 min. / 4°C, 90µl de lizat celular au fost omogenizati cu 10µl soluti MCB (monochlorobimane) si incubati timp de 2 ore la temperatura camerei. Dupa cele 2 ore de incubare a fost citita fluorescenta probelor la multireader GeNios Tecan ( excitatie380 nm / emisie 460nm).
4.4. Evaluarea activitatii enzimelor antioxidante(catalaza, superoxid dismutaza)
Dozarea activitatii superoxid dismutazei (SOD):
Masurarea activitatii SOD a fost realizata utilizand metoda spectrofotometrica descrisa de Paoletti (1986), care se bazeaza pe capacitatea SOD de a cataliza reactia de transformare a anionilor superoxid in oxigen molecular si peroxid de hidrogen conform reactiei:
O2.- + O2.- + 2H+ → O2 + H2O2
Procesul de oxidare a NADH a fost urmarit timp de 20 de minute, prin modificarea densitatii optice la 340nm, dupa o perioada de incubare de 5 minute la 37 ◦C la un multireader TECAN. Mediul de reactie a continut: 20µl lizat celular, 160 µl TDB ( tampon 100mM trietanolamina - 100mM dietanolamina, pH 7,4), 5µl solutie EDTA 100mM / MnCl2 50mM, pH 7, 8µl NADH 7,5 mM.. Reactia enzimatica a fost declansata prin adaugarea a 20 µl β - mercaptoetanol 100mM. Dupa cele 5 minute de incubare la 37 ◦C, citirile s-au efectuat fata de un martor care nu contine lizat celular.
O unitate de activitate SOD este definita ca acea cantitate de enzima necesara inhibarii cu 50 % a ratei de oxidare a NADH din martor.
Pentru a calcula activitatea specifica exprimata in U/mg proteina procedam astfel:
S-a reprezentat grafic variatia D.O. la 340nm (pe ordonata) in functie de timp (pe abscisa). S-a determinat portiunea de curba in care viteza creste proportional in timp. S-a calculat D.O.340nm/min de pe aceasta portiune a curbei. Activitatea enzimatica s-a calculat astfel:
AE (U/ml) = D.O.340nm/min /6.22 x 0,213ml /0,02ml x coeficientul de dilutie, unde 6.22 reprezinta coeficientul de extinctie molara a NAD(P)H la 340nm ( NADH=6.22*103 M-1cm-1); 0,213 ml reprezinta volumul total al reactiei si 0,02 ml este volumul de extract proteic.
AS (U/mg) = (AEmartor - AEproba)/AEmartor/2 / concentratia proteica (mg/ml)
Pentru acest tip de determinare s-a folosit un multireader Tecan.
Dozarea activitatii catalazei (CAT):
Masurarea activitatii CAT s-a facut comform metodei spectrofotometrice descrisa de Aebi (1974), urmarind modificarea densitatii optice la 240nm, timp de un minut. Metoda de dozare enzimatica se bazeaza pe capacitatea catalazei de a cataliza urmatoarele reactii:
2H2O2 → 2H2O + O2
ROOH + DH2 → ROH + D + H2O
Degradarea H2O2 sub actiunea catalazei existente in lizat a fost urmarita dupa adaugarea a 50 µl EPT in amestecul de reactie care continea 600 µl de tampon fosfat de potasiu, 0,1M pH 7,1 si 350 µl H2O2 0,059 M. Citirile au fost realizate fata de un martor in care nu a fost adaugat peroxidul de hidrogen.
O unitate enzimatica descompune 1μmol de H2O2 intr-un minut la 25˚C si pH 7.
AE (k / min) = 2,3/1min x log E1/E2, unde E1 este valoarea ΔDO240nm/min initiala si E2 este valoarea ΔDO240nm/min finala.
Determinarea activitatii catalazice a fost realizata utilizand spectrofotometrul Perkin Elmer Lambda 25.
4.5. Analiza actvitatii enzimatice pe gel a metaloproteinazelor 2 si 9 si superoxid dismutazei (SOD)
Zimografie metaloproteinaze
Tratamentul a fost aplicat liniei celulare Caco-2 in doza unica (doza pentru extractul din Pleurotus ostreatus este de 0,5% m/v), la intervale diferite de timp. Pentru fiecare tratament cantitatea echivalenta de extract din Pleurotus ostreatus a fost dizolvat direct in mediul de cultura. Dupa terminarea intervalului de tratament a fost prelevat mediul de cultura pentru identificarea activitatii MMP.
Fiecare tratament a fost insotit de culturi de celule control ce au fost supuse la acelasi protocol de lucru, cu exceptia faptului ca nu au fost incubate cu tratamente.
|
Aceasta metoda permite evidentierea activitatii unor enzime proteolitice separate electroforetic in geluri de poliacrilamida (PAA) ce contin substratul necesar enzimelor, in cazul nostru - gelatina(2mg/ml). Gelurile de poliacrilamida vor evidentia plaje de liza situate corespunzator masei moleculare a enzimelor testate in prezenta unor markeri de masa moleculara.
Mediile de cultura prelevate de pe celule tumorale au fost incarcate pe geluri folosind un tampon de incarcare 2X (0.5 M TRIS/HCl, 10% SDS, 0.2% bromfenol si 0.8% glicerol) si supuse migrarii electroforetice la 90V, 4h, 40C in tampon de migrare (125 mM TRIS/HCl, pH 8.3, 1.23 M Gly, 0.5% SDS)
Dupa electroforeza, gelurile sunt spalate pentru indepartarea SDS in solutie 2.5% Triton 100X, ducand astfel la renaturarea enzimelor.
Gelurile se incubeaza la 37˚C peste noapte in tampon de activare (50 mM TRIS/HCl pH 7.6, 10 mM CaCl2*2H2O, 50 mM NaCl, 0.05% Brij35) ceea ce permite degradarea substratului.
Colorarea gelurilor se realizeaza cu o solutie de Comassie Brilliant Blue R250 0.25%.
Decolorare in metanol:acid acetic:apa (40:10:50), avand ca rezultat clarificarea benzilor de liza.
Zimografie superoxid dismutaza (SOD)
Punerea in evidenta a profilului SOD (superoxid dismutazei) existent la nivelul celulelor Caco-2 tratate cu extract de Pleurotus ostreatus timp de 24, 72 si 96 de ore, a fost realizata utilizand metoda descrisa de Beauchamp si Fridovich (1971). Dupa tripsinizare si centrifugare timp de 10 minute, la 1500 rpm., celulele au fost lizate intr-un tampon 20 mM Tris / HCl, pH 7.5 ce continea 0.2 % Triton X-100, 0.5 mM PMSF. Omogenatul tisular a fost sonicat de 3 ori / 40 sec. / pe gheata, si apoi a fost centrifugat timp de 15 min. / 3000 rpm. / 4°C. Lizatele celulare astfel obtinute, a caror concentratie a fost determinata folosind metoda Lowry, au fost separate prin migrare in sistem nativ in gel de poliacrilamida 15 %, dupa metoda descrisa de Laemmli (1970), timp de 2 ore, la 90 V / 4 ˚C, folosind sistemul de electoforeza BIORAD. In fiecare godeu a fost incarcata aceeasi cantitate de proteina (40 µg), coloratia gelului pentru evidentierea activitatii SOD realizandu-se conform metodei descrisa de Beauchamp si Fridovich (1971). Imediat dupa migrarea electroforetica gelul a fost imersat timp de 20 de minute in solutie de clorura de nitroblue tetrazolium (NBT), 2,45 mM si incubat 15 minute intr-o solutie tampon 0,036 M fosfat de K, pH 7,8 continand riboflavina (2,5 x 10-5 M) si TEMED (0,0028 M), urmata de iluminarea gelului pana la aparitia benzilor.
Imaginea benzilor obtinute in urma coloratiei gelului pe transiluminator, in vizibil, a fost prelucrata cu ajutorul programului BioCaptMW. Gelul se fotografiaza si benzile obtinute se densitometreaza utilizand programul Bio1D [Vilbert Lourmat].
4.6. Evaluarea nivelului de expresie proteica a metaloproteinazelor 2 si 9 prin Western Blot
In vederea punerii in evidenta a expresiei proteice a metaloproteinazelor 2 si 9, din celulele Caco-2 tratate cu extract de Pleurotus ostreatus , timp de 24 si 72 de ore, celulele au fost tripsinizate, omogenizate intr-un tampon fosfat salin (PBS) si apoi sonicate pe gheata in vederea lizarii celulare. Concentratia proteica a probelor supuse separarii in gel de poliacrilamida 10 %, in sistem nedenaturant, a fost dozata folosind metoda descrisa de Lowry, utilizand ca standard o solutie de 10 mg % albumina serica bovina. Migrarea probelor s-a facut in tampon electroforeza 1x (0,125M Tris, 0,96M glicina, 0,5%SDS), la 90V/ 2ore/25°C.
Dupa transferul proteinelor in tampon Tris 25mM, glicina 192mM, methanol 20%, pe o membrana PVDF (difluorura de ploviniliden), peste noapte / 350mA, revelarea a fost realizata utilizand anticorpi primari: anti-marix metalloproteinase-2 produs in iepure (rabbit - IgG fraction of antiserum, SIGMA - diluat de 100 ori ) si anti-matrix metalloproteinase-9 produs in capra (goat - affinity isolated antibody, SIGMA diluat de 1000 ori) si un kit de imunodetectie Chromogenic Western Blot Immunodetection Kit (INVITROGEN) care continea anticorpul secundar anti rabbit si respectiv anti goat cuplati cu fosfataza alcalina si sistemul substrat de revelare cu cromogen (BCIP / NBT).
CAPITOLUL III: REZULTATE SI DISCUTII
I1.Testul de viabilitate MTT
In vederea analizarii efectului extractului de Pleurotus ostreatus asupra viabilitatii celulare, s-a folosit un test de citotoxicitate, celulele de adenocarcinom colorectal - Caco-2, fiind tripsinizate, spalate si insamantate pe placute cu 12 de godeuri, la o densitate de 104 celule in 1 mL mediu/godeu, timp de 24 h, dupa care au fost tratate cu extract de Pleurotus ostreatus, in concentratie de 5ug/mL si 20mg/mL si 100ug/mL, la un interval de timp de 24 ore. Extractul de Pleurotus ostreatus a avut o concentratie de substanta activa (polizaharide si polifenoli) de 70,40 μg/ml. Metoda MTT, de monitorizare a viabilitatii celulare s-a bazat pe masurarea activitatii dehidrogenazei mitocondriale existente in celulele viabile.
Rezultatele prezentate in figura 10 indica faptul ca tratamentul aplicat timp de 24 de ore cu un extract de Pleurotus ostreatus de concentratie 5ug/mL, 20ug/ml si 100ug/ml nu are efect citotoxic la nici una dintre concentratiile utilizate.
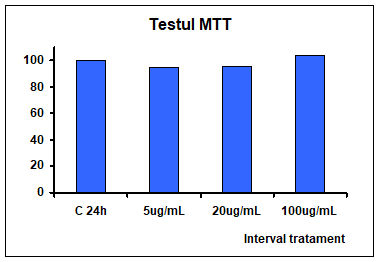
Figura 10: Test de citotoxicitate la nivelul celulelor Caco-2 tratate cu extract de Pleurotus ostreatus ug/mL si 20ug/mL si 100ug/mL timp de 24 ore
I2. Evaluarea concentratiei de gluatation redus (GSH)
Glutationul este cel mai abundent compus antioxidant existent la nivelul celulei animale, avand o mare capacitate de protectie bazata pe oxidarea gruparilor tiol din structura resturilor de cisteina. Prin oxidare de formeaza GSSG care poate fi transformat sub actiunea glutation reductazei in forma redusa (GSH) (Meister si colab, 1983).
Aceasta tripeptida prezinta o grupare tiol libera si o legatura γ glutamil, care il face rezistent la atacul proteazelor. Este un compus extrem de versatil, datorita structurii chimice, care-i permite sa actioneze atat ca un nucleofil cat si ca un reducator eficient ce reactioneaza cu agenti electrofili si oxidanti cum ar fi apa oxigenata, anionul superoxid si radicalul hidroxil. Datorita caracterului reducator, glutationul joaca un rol important intr-o serie de procese de detoxifiere. GSH furnizeaza protectie prin neutralizarea radicalului hidroxil, extrem de reactiv, care este o sursa majora de vatamare prin intermediul radicalilor liberi.
In cadrul raspunsului antioxidativ, nivelele de GSH fluctueaza in diferite conditii fiziologice, ce includ procesul de imbatranire si unele boli neoplazice, care sunt insotite de o crestere a peroxidarii lipidelor.
Variatia nivelului glutationului redus total, aparuta la nivelul celulelor Caco-2 in urma tratamentului cu extractul de Pleurotus ostreatus a fost pusa in evidenta la intervale diferite de timp, de 1 zi si 3 zile.
S-a observat o reducere a nivelului de GSH total la nivel celular [Figura 11], ceea ce demonstreaza faptul ca procesul de diminuare a glutationului poate determina inducerea stresului oxidativ ca urmare a modificarilor echilibrului redox intracelular. In figura 11 se poate observa modificarea nivelului glutationului total, indusa de tratamentul cu Pleurotus ostreatus timp de o zi si 3 zile.
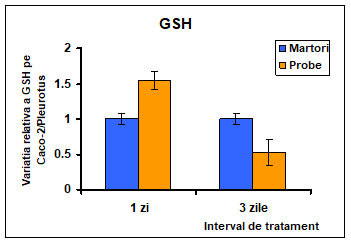
Figura 11: Variatia relativa a concentratiei de glutation redus la nivelul celulelor Caco-2 tratate cu extract de Pleurotus ostreatus timp de 1 zi si 3 zile
In conditiile aparitiei stresului oxidativ, GSSG poate fi convertit in forma redusa sau poate fi eliminat de la nivel celular.
Scaderea nivelului de GSH celular poate conduce la aparitia stresului oxidativ si la inducerea procesului apoptotic. In cazul tratamentului cu Pleurotus, se observa ca nivelul concentratiei de GSH creste semnificativ dupa o zi de tratament comparativ cu martorul si scade dupa 3 zile de tratament, ceea ce dovedeste o capacitate de contracarare a stresului produs de extractul de Pleurotus ostreatus dupa o zi de expunere.
I3. Evaluarea activitatii superoxid dismutazice si catalazice
Evaluarea stresului oxidativ aparut la nivel celular a fost realizata prin determinarea activitatilor principalelor enzime implicate in stresul oxidativ (SOD, CAT)
Superoxid dismutaza
Datorita activitatii ridicate a SOD mitocondrial, concentratia intramitocondriala a O2.- este mentinuta la un nivel scazut (Tyler, D. D. si colab, 1975). Comparativ cu peroxidul de hidrogen, care este capabil de a traversa prin difuzie membrana mitocondriala, anionul superoxid nu are capacitatea de a traversa aceasta membrana si de a ajunge la nivel citoplasmatic.
Determinarea activitatii SOD la nivelul celulelor Caco-2 dupa 24, 48 si 96 de ore de expunere la 0,5% extract polizaharidic de Pleurotus ostreatus nu a pus in evidenta modificari semnificative ale activitatii acestei enzime [Figura 12].
In Figura 12 sunt reprezentate activititatile specifice ale SOD in celule Caco-2 tratate cu extractul de Pleurotus ostreatus 5ug/mL timp de 24, 48 si 96 ore. O serie de studii au subliniat faptul ca Mn-SOD poate fi indusa la nivel celular sub influenta stresului oxidativ (Visner si colab, 1990).
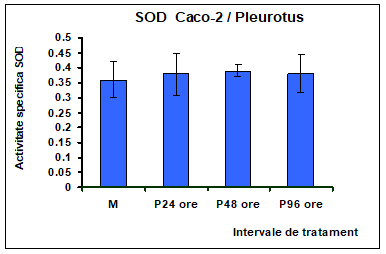
Figura 12: Activitatea specifia a enzimei superoxid la nivelul celulelor Caco-2 tratate cu extract de Pleurotus ostreatus la interval de 24 , 48 si 96 de ore
Modificarile profilului enzimatic al activitatii SOD, evidentiate prin tehnici spectrofotometrice [Figura 12] au fost confirmate si prin tehnica electroforetica.
Asa cum se poate observa in figura 13, activitatea MnSOD din probele tratate cu extractul de Pleurotus este asemanatoare cu activitatea MnSOD din martori.
In timp ce tehnica spectrofotometrica evidentieaza modificarile activitatii SOD la nivel celular, fara a face diferenta intre cele doua izoforme de SOD (MnSOD sau Cu/Zn SOD), tehnica electroforetica evidentiaza distinct activitatea fiecarei forme SOD.
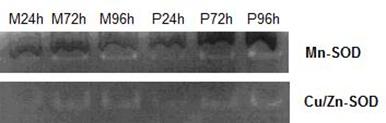
Figura 13: Profil electroforetic a activitatii SOD la nivelul celulelor Caco-2 tratate cu extract de Pleurotus ostreatus la interval de 24 , 72 si 96 de ore
a b
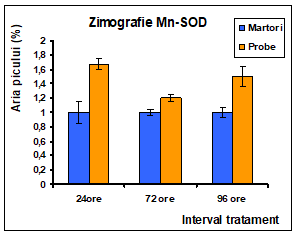
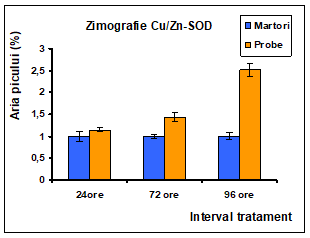
Figura 14: Densitometrarile activitatii enzimei SOD la nivelul celulelor Caco-2 tratate cu extract de Pleurotus ostreatus la interval de 24 , 72 si 96 de ore: a) Mn-SOD; b) Cu/Zn-SOD
Profilul electroforetic indica faptul ca in cele trei intervale de tratament cu Pleurotus la nivelul liniei celulare Caco-2 exista o intensificare a activitatii Cu/ZnSOD dependenta de timp in martori insotita de o reducere a activitatii Cu/ZnSOD in probe la 72 si 96 ore comparativ cu martorii, dar o crestere proportionala cu intervalele de timp.
MnSOD este localizata la nivelul matrixului mitocondrial, fiind principala enzima care neutralizeaza anionii superoxid mitocondriali [Fridovich si colaboratorii, 1998]. Luand in considerare rolul anionilor superoxid mitocondriali, in amplificarea si accelerarea raspunsului celular la stimuli apoptotici, inducerea MnSOD s-a dovedit a avea un rol important in protectia celulei de actiunea citotoxica a agentilor proapoptotici. Rezultatele obtinute in vivo, pe soareci knockout pentru activitatea MnSOD, a caror supravietuire a fost redusa [Li si colaboratorii, 1995], sustin ideea ca MnSOD este o proteina de supravietuire celulara fiind necesara mentinerii integritatii mitocondriale in celulele supuse anumitor conditii de stres.
Cresterea activitatii dupa 72 si 96 de ore dupa tratament demonstreaza generarea unei concentratii ridicate de anioni superoxid cu localizare mitocondriala.
Catalaza
In celulele Caco-2 tratate cu extract de Pleurotus la intervale de timp de 24, 48 si 96 ore se observa o stimulare a activitatii si/sau a biosintezei enzimei cu activitate catalazica dependenta de timp [Figura 15] ceea ce dovedeste dezvoltarea unui raspuns adaptativ la stresul produs de expunerea la acest extract.
Pe parcursul expunerii la extractul de Pleurotus, polizaharidele din acest extract se acumuleaza la nivelul matrixului mitocondrial, generand probabil cantitati ridicate de H2O2, ceea ce determina stimularea activitatii catalazice, asa cum s-a observat dupa 48 si 96 ore de tratament [Figura 14
La 96 de ore dupa tratament se observa o intensificare a activitatii atat catalazice cat si dismutazice.
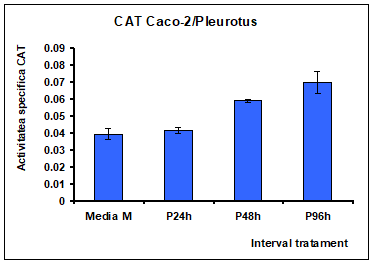
Figura 15: Activitatea specifia a catalazei la nivelul celulelor Caco-2 tratate cu extract de Pleurotus ostreatus la interval de 24 , 48 si 96 de ore
I4. Zimografie metaloproteinaze
In urma tratmentului cu 0,5% polizaharide extrase din Pleurotus ostreatus, studiile de zimografie au relevat un raspuns diferit pentru cele doua tipuri de metaloproteinaze MMP-2 si MMP-9 [figura 15]. Este interesant faptul ca MMP-2 prezinta o activitate mai intensa comparativ cu MMP-9.

Figura 16: Zimograma obtinuta in urma tratamentului cu 0.5% polizaharide din Pleurotus ostreatus: evidentierea activitatii MMP din mediul de cultura al liniei celulare Caco-2
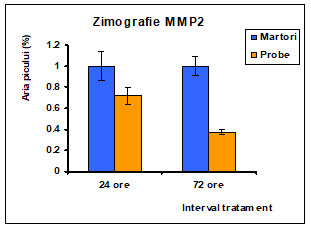
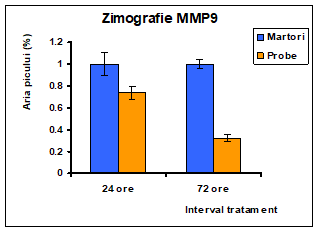
Figura 17: Densitometrarea zimogramei obtinute in urma tratamentului cu 0.5% polizaharide din Pleurotus ostreatus: evidentierea activitatii MMP din mediul de cultura al liniei celulare Caco-2
Din figura 17 se poate observa ca activitatea MMP2 este mult diminuata la nivelul celulelor tratate cu extractul de Pleurotus comparativ cu celulele netratate la ambele intervale de timp de 1 zi si 3 zile. De asemenea se poate observa o crestere a activitatii in al doilea interval de timp la celulele martor. Se poate spune in acest caz ca tratamentul cu 0,5% extract polizaharidic de Pleurotus ostreatus determina o inhibitie puternica a activitatii metaloproteinazelor MMP2.
In cazul MMP9 se observa o diminuare a activitatii enzimatice dupa 3 zile de expunere la tratamentul cu extract de Pleurotus ostreatus.
Diminuarea activitatii metaloproteinazelor in urma tratamentului denota existenta unui efect anticanceros al extractului de Pleurotus prin inhibitia capacitatii invazive a acestor celule. [Junichi Shiozawa , Masahiro Ito, 2000]
Rezultatele obtinute in cazul tratamentului cu Pleurotus sunt in concordanta cu rezultatele descrise de Junichi Shiozawa si colaborator
I5. Western Blot metaloproteinaze
Expresia celor doua tipuri de metaloproteinaze MMP2 si MMP9 a fost pusa in evidenta prin tehnica Western blot cu anticorpi specifici anti rabbit pentru MMP2 si anti goat pentru MMP9. Rezultatele obtinute prin aceasta tehnica au confirmat rezultatele obtinute prin metoda zimografica.
Tratamentul cu extractul de Pleurotus ostreatus la nivelul liniei celulare Caco-2 a determinat o scadere puternica a nivelului de expresie proteica existent in celulele martor. In figura 18 se poate observa atat in cazul MMP2 cat si MMP9 o expresie mai crescuta in probele martor dupa 3 zile de expunere in timp ce in probele tratate expresia metaloproteinazelor este inhibata in totalitate.
Inhibitia expresie proteice a metaloproteinazelor MMP2 si MMP9 [figura 18] in urma tratamentului cu extractul de Pleurotus ostreatus este cauza scaderii activitatii enzimatice observate in cazul zimografiei prezentate anterior [figura 18]. Efectul de inhibitie este semnificativ crescut dupa 3 zile de tratament.

a

b
Figura 18: Expresia proteica a metaloproteinazelor a) MMP2 si b) MMP9
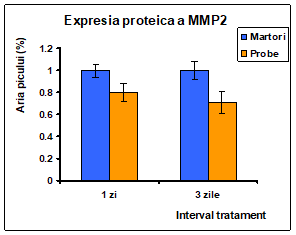
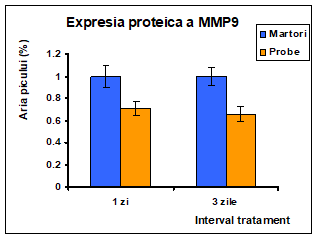
a b
Figura 19: Densitometrarea expresiei proteice a metaloproteinazelor a) MMP2 si b) MMP9
CONCLUZII
Tratamentul cu extract de Pleurotus ostreatus la nivelul liniei celulare de adenocarciom colorectal Caco-2 induce stres oxidativ prin evidentierea creșterii activitatilor superoxide dismutazice si catalazice.
Totodata rezultatele obtinute in cazul tratamentului cu Pleurotus, sugereaza faptul ca efectul anticanceros al acestui extract se bazeaza pe inducerea de stres oxidativ la nivel mitochondrial precum si pe scaderea capacitatii de invazivitate celulara prin inhibitia expresiei proteice si activitatilor enzimatice ale metaloproteinazelor MMP2 si MMP9 fara modificarea viabilitatii celulare.
BIBLIOGRAFIE
Steward BW, Kleihues P - Colorectal Cancer. In: Steward BW, Kleihues P, editors. World Cancer Report. Lyon: IARC Press; 2003. p. 198-202.
Weitz J, Koch M, Debus J, Hohler T, Galle PR, Buchler MW - Colorectal cancer. Lancet. 2005; 365(9454): 153-163.
Curca T - Cancerul tubului digestiv. Bucuresti: Editura Medicala; 2001.
Kasper DL, Braunwald E, Fauci A, Hauser S, Longo D, Jameson JL - Colorectal cancer , in Harrison's principles of internal medicine. McGraw-Hill Professional; 2005, p 1973-1983.
Jemal A, Tiwari RC, Murray T, Ghafoor A, Samuels A, Ward E, Fuer EJ, Thun MJ - Cancer Statistics, 2004. CA Cancer J Clin. 2004: 54(1): 8-29.
Grossmann EM, Johnson FE, Virgo KS, Longo WE, Fossati R - Follow-up of colorectal cancer patients after resection with curative intent-the GILDA trial. Surg Oncol. 2004; 13(2-3): 119-124.
Russel AH, Pelton J, Reheis CE, Wisbeck WM, Tong D, Dawson LE - Adenocarcinoma of the colon: an autopsy study with implications for new therapeutic strategies. Cancer. 1985; 56(6):1446-51.
Wasser SP. - Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides. Appl. Microbiol. Biotechnol.
Tzianabos AO. - Polysaccharide immunomodulators as therapeutic agents: structural aspects and biologic function. Clin. Microbiol. Rev. 2000; 13:523-33.
10. Liang J.,Melican D., Cafro L., Palace G., Fisette L. si colab. - Enhanced clearance of a multiple antibiotic resistant Staphylococcus aureus in rats treated with PGG-glucan is associated with increased leukocyte counts and increased neutrophil oxidative burst activity. Int. J. Immunopharmacol. 1998; 20:595-614.
11. Wakshull E., Brunke-Reese D., Lindermuth J., Fisette L., Nathans RS. si colab. - PGG-glucan, a soluble β(1→3)-glucan, enhances the oxidative burst response, microbicidal activity, and activates an NF-kappa B-like factor in human PMN: evidence for a glycosphingolipid beta(1→3)-glucan receptor. Immunopharmacology 1999; 41:89-107.
12. Burgaleta C., Territo MC., Quan SG., Golde DW. - Glucanactivated macrophages: functional characteristics and surface morphology. J. Reticuloendothel. Soc. 1978; 23:195-204.
13. Chihara G. - Immunopharmacology of Lentinan, a polysaccharide isolated from Lentinus edodes: it's applications as a host defense potentiator. Int. J. Orient Med. 1992 ;17:57-77.
14. Wasser SP. Reishi or Ling Zhi - (Ganoderma lucidum). Encyclop. Diet Suppl. 2005: 603-22.
15. Wasser SP., Weis AL. - Therapeutic effects of substances occurring in higher basidiomycetes mushrooms: a modern perspective. Crit. Rev. Immunol. 1999; 19:65-96.
16. Su C., Sun C., Juan SW., Hu C., Ke W., Sheu M. - Fungal mycelia as the source of chitin and polysaccharides and their applications as skin substitutes. Biomaterials 1997; 18:1169-74.
Zhang J., Tang Q., Zimmerman-Kordmann M., Reutter W., Fan H. - Activation of B lymphocytes by GLIS, a bioactive proteoglycan from Ganoderma lucidum. Life. Sci. 2002; 71:623-38.
Leite Oldair D., Fatibello-Filho Orlando, Aneli de M.Barbosa. - Determination of Catecholamines in Pharmaceutical Formulations Using a Biosensor modified with a Crude Extract of Fungi Laccase (Pleurotus ostreatus). J. Braz. Chem. Soc., vol.14, nr. 2, 2003.
19. Manzi P., Aguzzi A., Pizzoferrato L. - Nutritional value of mushrooms widely consumed in Italy. Food Chemistry 2001; 73(3), 321-325.
20. Manzi P., Aguzzi A., Vivanti V., Paci M., Pizzoferrato L. - Mushrooms as a source of functional ingredients. In Euro Food Chem X European conference on: functional foods. A new challenge for the food chemist 22-24 September, 1999; Vol.1, 86-93.
21. Zhang M., Cheung PCK., Zangh L. - Evaluation of mushroom dietary fibre (nonstarch polysaccharides) from sclerotia of Pleurotus tuber-regium (Fries) Singer as a potental antitumor agent. Journal Agricultural of Food Chemistry 2001; 49, 5059-5062.
22. Bobek P., Galbavy S. - Hypocholesterolemic and antiatherogenic effect of oyster mushroom (Pleurotus ostreatus) in rabbit. Nahrung 1999; 43(5), 339-342.
23. Bobek P., Ozdyn L., Kuniak L. - The effect of oyster (Pleurotus ostreatus) it's ethanolic extract and extraction residues on cholesterol levels in serum lipoproteins and liver of rat. Nahrung 1995; 39, 98-99.
24. Bobek P., Nosalova V., Cerna S. - Effect of pleuran (beta glucan from Pleurotus ostreatus) in diet or drinking fluid on colits rats. Nahrung 2001; 45, 360-363.
25. Cheung PCK. - Plasma and hepatic cholesterol levels and fecal neutral sterol excretion are altered in hamsters fed straw mushroom diets. Journal Nutrition 1998; 1512-1516
26. Mau JL., Chao GR., Wu KT. - Antioxidant properties of methanolic extract from several ear mushrooms. Journal Agricultural of Food Chemistry 2001; 49, 5461-5467.
27. Mau JL., Lin HC., Song SF. - Antioxidant properties of several specialty mushroom. Food Research International 2002; 35, 519-526.
28. Yang JH., Lin HC., Mau JL. - Antioxidant properties of several commercial mushroom. Food Chemistry 2002; 77, 229-235.
29. Chang R. - Functional properties of edible mushrooms. Nutr. Rev. 1996; 54: 91-93.
30. Manzi P., Pizzoferrato L. - Beta glucans in edible mushrooms. Food Chemistry 2002; 68, 315-318.
31. Kubala L., Ruzickova J., Nickova K., Sandula J., Ciz M., Lojek A. - The effect of (1→3)-β-glucans, carboxymethylglucan and schizophyllan on human leucocytes in vitro. Carbohydr. Res. 2003; : 2835-2840.
32. Tsukada C., Yokoyama H., Miyaji C., Ishimoto Y., Kawamura H., Abo T. - Immunopotentiation of intraepithelial lymphocytes in the intestine by oral administration of β-glucan. Cellular Immunol. 2003; 221: 1-5.
33. Hirasawa M., Shouji N., Neta T., Fukushima K., Takada K. - Three kinds of antibacterial substances from Lentinus edodes (Berk.) Sing. (Shiitake, an edible mushroom). Int. J. Antimicrob. Agents 1999; : 151-157.
34. Cavallero A., Empilli S., Brighenti F., Stanca AM. - (1→3, 1→4)-β-glucan barley fractions in bread making and their effects on human glycemic response. J. Cereal Sci. 2002; 36: 59-66.
35. Meier ML., Hecker KD., Newman RK., Newman CW. - Hypocholesterolemic effects of foods enriched with barley β-glucan concentrate. J. Am. Dietetic Assoc. 1995; 95: A10.
36. Zadak Z. - Výziva a imunita. Medinews 2003; 1: 1-3.
37. Yoshioka Y., Tabeta R., Saito H., Uehara N., Fukuoka F. - Carbohidr. Res. 1985; 140, 93-100.
38. Kunz S., O'Reilly T. - Biology Report No. 84/91 CIBA-GEIGY Ltd, Switzerland.
39. Lavi I., Friesem D., Geresh S., Hadar Y., Schwartz B - An aqueous polysaccharide extract from the edible mushroom Pleurotus ostreatus induces anti-proliferative and pro-apoptotic effects on HT-29 colon cancer cells. Cancer Lett. 2006.
Yu-Huan Gu, Gowsala Sivam. - Cytotoxic Effect of Oyster Mushroom Pleurotus ostreatus on Human Androgen-Independent Prostate Cancer PC-3 Cells. Jurnal of Medicinal Food 2006; Vol. 9, No. 2 : 196 -204.
41. Bobek P., Galbavy S. - Effect of pleuran (beta-glucan from Pleurotus ostreatus) on the antioxidant status of the organism and on dimethylhydrazine-induced precancerous lesions in rat colon. Br. J. Biomed. Sci. 2001; 58(3): 164-8
42. Niki E., Shimaski H., Mino M. - Antioxidantism-Free Radical and Biological Defence. Gakkai Syuppan Center 1994, Tokyo.
43. Hatano T., Edamatsu R., Mori A., Fujita Y., Yasuhara E. - Effect of interaction of tannins with co-existing substances. VI. Effects of tannins and related polyphenols on superoxide anion radical and on DPPH radical. Chemical and Pharmaceutical Bulletin 1989; 37, 2016-2021
44. Yen GC., Duh PD., Tsai CL. - Relationship between antioxidant activity and maturity of peanut hulls. Journal of Agricultural and Food Chemistry 1993; 41, 67-70.
45. Halliwell B., Gutteridge JMC. - Free Radicals in Biology and Medicine. Oxford University Press 2003; Oxford, UK.
46. Kaur C., Kapoor HC. - Anti-oxidant activity and total phenolic content of some Asian vegetables. International Journal of Food Science and Technology 2002; 37, 153-161.
47. Kahkonen MP., Hopia AI., Vuorela HJ., Raucha JP., Pihlaja K., Kujala TS., Heinonen M. - Antioxidant activity of plant extracts containing phenolic compounds. Journal of Agricultural and Food Chemistry 1999; 47, 3954-3962.
48. Cooper CE., Vollaard NBJ., Choueiri T. si colab. - Exercise, free radicals and oxidative stress. Biochem. Soc. Trans. 2002; 30 (2): 280-5.
49. Lachance PA., Nakat Z., Jeong WS. - Antioxidants: an integrative approach. Nutrition 2001; 17: 835-8
50. Golden TR., Hinerfeld DA., Melov S. - Oxidative stress and aging: beyond correlation. Aging Cell 2002; 1: 117-23.
51. Thomas MJ. - The role of free radicals and antioxidants. Nutrition 2000; 16 (7-8): 716-8
52. Sen CK. - Antioxidant and redox regulation of cellular signaling: introduction. Med. Sci. Sports Exerc. 2001; 33 (3): 368-70
53. Jenkins RR. - Free radical chemistry: relationship to exercise. Sports Med 1988; 5: 156-70
54. Cheeseman KH., Slater TF. - An introduction to free radical biochemistry. Br. Med. Bull. 1993; 49 (3): 481-93
55. Rimbach G., Hohler D., Fischer A. si colab. - Methods to assess free radicals and oxidative stress in biological systems. Arch Tierernahr 1999; 52 (3): 203-22
56. Prior RL., Cao G. - In vivo total antioxidant capacity: comparison of different analytical methods. Free Radic. Biol. Med. 1999; 27 (11-12): 1173-81.
57. Yu BP. - Cellular defenses against damage from reactive oxygen species. Physiol Rev. 1994; 74: 139-162.
58. Stoian I., Oros A., Moldoveanu E. - Apoptosis and free radicals. Biochem. Mol. Med. 1996; 59: 93- 97.
59. Younes M. - Free radicals and reactive oxygen species, in Toxicology. H. Marguardt, SG. Schafer, R. McClellan and F. Welsch (eds). Academic Press. NY. 1999; 111- 125.
60. Wiseman H., Halliwell B. - Damage to DNA by reactive oxygen species and nitrogen species: role in inflammatory disease and progression to cancer, Biochem. J. 1996 ; 313, 17 - 19.
61. Hunt CR., Sim JE., Sullivan SJ., Featherstone T., Golden W., Kapp-Herr CV., Hock RA., Gomez RA., Parsian AJ., Spitz DR. - Genomic instability and catalase gene amplification induced by chronic exposure to oxidative stress, Cancer Res. 1998; 58, 3986 - 3992.
62. Mills EM., Takeda K., Yu ZX., Ferrans V., Katagiri Y., Jiang H., Lavigne MC., Leto TL., Guroff G. - Nerve growth factor treatment prevents the increase in superoxide produced by epidermal growth factor in PC 12 cells, J. Biol. Chem. 1998; 273, 22165 - 22168.
Sas Katalin, Robotka Hermina, Toldi Jozsef, Vecsei Laszlo. - Mitochondria, metabolic disturbances, oxidative stress and the kynurenine syste, with focus on neurodegenerative disorders. Journal of the Neurological Sciences in press doi:10.1016/j.jns.2007.01.033, 2007.
Geschman Rebeca, Gilbert L. Daniel, Nze W. Sylvanus, Dwye Peter, Fenn O. Wallace. - Oxygen poisoning and X-irradiation: a mechanism in common 1954; Science 119: 623-626.
65. Burtke TM., Sandstrom PA. - Oxidative stress as a mediator of apoptosis, Immunol. Today 1994; 15, 7 -10.
66. Morel Y. - Repression of gene expression by oxidative stress, Biochem. J. 1999; 342, 481.
67. Misra HP., Fridovich I. - The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase. J. Biol. Chem. 1972; 247: 3170- 3175
68. Limoli CL., Hartmann A., Shephard L., Yang C., Boothman DA., Bartholomew J., Morgan WF. - Apoptosis reproductive failure and oxidative stress in chinese hamster ovary cells with compromised genomic integrity. Cancer Res. 1998; 58, 3712 - 3718.
69. Dean RT., Fu S., Stocker R., Davies MJ. - Biochemistry and pathology of radical-mediated protein oxidation. Biochem. J. 1997; 324: 1-18.
70. Rozalia Nitu, Delia Irina Carol, Toma N. - Radicali liberi in sisteme biologice-efectele lor citogenice.
Sies H. - Oxidative stress: Introduction. In: Oxidative Stress: Oxidants and Antioxidants, Academic Press 1991; San Diego, 15-22.
Morel Y., Barouki R. - Repression of gene expression by oxidative stress. Biochem. J. 1999; 342: 481-496.
Hockenbery DM., Oltvai ZN., Yin XM, Millman CL, Korsmeyer SJ. - Bcl-2 functions in an antioxidant pathway to prevent apoptosis. Immunol. Today 1993; 18, 44-51
74. Hasegawa T., Kaneko F., Niwa Y. - Changes in lipid peroxide levels and activity of reactive oxygen scavenging enzymes in skin, serum and liver following UVB irradiation in mice. Life Sci. 1992; 50: 1893-1903.
Junichi S., Masahiro Ito, Toshiyuki N., Masahiro N., Shigeru K. and Ichiro S Expression of Matrix Metalloproteinase-1 in Human Colorectal Carcinoma, 2000.
https://www.eukarya.ro/taxon/2554
https://hak3ru.8k.com/catalog.html
https://en.wikipedia.org/wiki/Oyster_mushroom
www.doctor.info.ro/Sisteme antioxidante cu rol protector
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2026 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Documente online pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








