| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Grupa a iii - a analitica |
Grupa a iii - a analitica
GRUPA A III - A ANALITICA
Au existat in decursul timpului mai multe tentative ale chimistilor de clasificare a elementelor chimice: in metale si nemetale, acizi si baze, in functie de valenta sau de alte proprietati. Aplicarea acestor metode facea insa ca o serie de elemente sa se regaseasca in mai multe grupe concomitent. O clasificare mai detaliata si mai utila s-a bazat la inceput pe greutatea atomica si apoi pe numarul atomic. Aceasta clasificare a condus la ceea ce cunoastem astazi sub denumirea de sistemul periodic, inclus in tabelul periodic care ilustreaza grafic legaturile dintre diferite elemente.
Scurt istoric
Clasificarea initiala a elementelor cunoscute in metale si nemetale a condus mai departe la diferentieri in functie de reactivitate. S-a observat ca unele elemente au proprietati intermediare intre metale si nemetale, acestea primind denumirea de metaloizi. In 1828, J.W. Döbereiner a remarcat ca la unele elemente exista aceeasi diferenta intre greutatea lor atomica (termenul actual utilizat este masa atomica relativa) atunci cind sunt aranjate in grupe de cite trei. De exemplu, a observat aceeasi diferenta intre greutatea atomica a elementelor clor - brom si brom - iod. Pe aceeasi baza a gasit si alte grupari asemanatoare care au devenit cunoscute sub denumirea de "triadele lui Döbereiner". John Newlands a aratat in 1864 ca aceste clasificari sunt parte integranta dintr-o schema mai generala. Newlands a grupat elementele pe linie in ordinea masei lor atomice si atunci cind a observat aparitia unor elemente cu proprietati similare la intervale regulate, a regrupat elementele si in in coloane: Newlands a observat ca proprietatile primelor sapte elemente reapar si la urmatoarele sapte, astfel incit primul si al optulea, al doilea si al noulea si asa mai departe, apartin aceluiasi grup sau familii. El a numit acest fenomen "legea octavelor". Gazele nobile care nu fusesera descoperite pina in anul 1890, si-au gasit locul in aceasta schema la sfirsitul fiecarei linii. Aceasta teorie nu a fost luata in serios la acea vreme mai mult datorita alegerii termenului muzical de "octava" de catre Newlands. Ideile lui Newlands au fost dezvoltate si reformulate mai clar de catre chimistul rus Dmitry Mendeleyev. Mendeleyev a formulat legea periodicitatii care se bazeaza pe ipoteza ca proprietatile elementelor sunt intr-o dependenta periodica in functie de masele lor atomice. El a aranjat elementele intr-un tabel, lasind spatii libere acolo unde nu existau elemente cunoscute cu masa atomica sau proprietati fizice si chimice corespunzatoare pozitiei respective. Primele opt elemente dupa hidrogen si heliu sunt litiu, beriliu, bor, carbon, nitrogen, oxigen, fluor si neon (neonul inca nu fusese descoperit la vremea aceea). Aceste elemente au fost grupate de catre Mendeleyev pentru a forma prima linie sau perioada din tabelul periodic. Celelalte elemente cunoscute au fost aranjate sub aceasta prima linie in ordinea masei lor atomice astfel incit sa rezulte un tabel in care elementele de pe coloane prezinta proprietati similare. Mendeleyev a aranjat de asemenea si elementele pe care le cunoastem astazi sub denumirea de metale tranzitorii in perioade mai lungi astfel incit sa nu se regaseasca in tabel in regiunea ocupata de nemetale. Decizia lui Mendeleyev de a lasa anumite locuri libere in tabel a fost confirmata ulterior prin descoperirea de elemente ale caror proprietati fusesera astfel anticipate. De exemplu, el a prognozat descoperirea unui element pe care l-a numit eka-aluminiu si ale carui proprietati le-a intuit printr-un studiu al tendintelor si similitudinilor dintre elementele din tabelul sau. Patru ani mai tirziu a fost descoperit galiu ale carui proprietati corespundeau pe deplin cu cele prognozate de catre Mendeleyev. Tabelul periodic al elementelor este instrumentul cel mai valoros in studiul chimiei anorganice. A ajutat la estimarea masei atomice relative reale a elementelor si la descoperirea de noi elemente. Un studiu mai riguros al sistemului periodic bazat pe masa atomica scoate insa in evidenta si o serie de anomalii; de exemplu, argonul si potasiul, iodul si telluriumul, cobaltul si nichelul, judecind dupa proprietatile lor, ar trebui sa fie plasate incorect in functie de masele lor atomice. Aceasta anomalie a ramas o lunga perioada de timp neexplicata, dar acum se cunoaste ca masa atomica a unui element are o importanta mai mare decit masa atomica relativa. Aceste anomalii dispar atunci cind elementele sunt aranjate in functie de numarul atomic.
Gruparea elementelor in tabelul periodic
Tabelul periodic al elementelor este aranjat astfel incit sa scoata in evidenta similitudinea dintre anumite elemente. Elementele dintr-o anumita zona a tabelului au proprietati asemanatoare in timp ce elementele situate la o distanta semnificativa au un comportament diferit. Intre aceste extreme exista o variatie gradata a proprietatilor fizice si chimice ca rezultat al masei atomice relative si configuratiei electronice a elementelor care intervin in aceasta zona intermediara.
Perioade
Elementele dintr-o perioada au acelasi numar de straturi electronice in atom, numar care coincide si cu numarul stratului exterior. In cadrul aceleasi perioade elementele sunt aranjate in ordinea crescatoare a numerelor atomice. In aceeasi perioada fiecare element contine un electron in plus pe ultimul strat comparativ cu elementul anterior. Aceasta conduce la o crestere a masei nucleului si sarcinii elementelor de la stinga spre dreapta in cadrul fiecarei perioade, fara a avea insa si o crestere a numarului de straturi de electroni.
Rezulta in acest fel o crestere a fortei de atractie exercitata de catre nucleu asupra electronilor din ultimul strat numit si strat de valenta. O alta consecinta este si contractarea stratului de valenta de la stinga spre dreapta, cu electronii din acest strat orbitind mai aproape de nucleu (scade raza atomica). Acest fenomen reflecta o tendinta de crestere a atractiei atomului pentru electroni pe masura ce ne deplasam de la stinga spre dreapta in cadrul aceleasi perioade. Metalele alcaline si alcalino-pamintoase care sunt situate la capatul din stinga al perioadelor prezinta o slaba atractie pentru electronii din stratul exterior de valenta, electroni pe care ii cedeaza usor formind astfel ioni pozitivi. Spunem ca aceste elemente sunt electropozitive, spre deosebire de elementele situate la dreapta perioadelor care sunt electronegative. Halogenii, situati la extremitatea din dreapta a perioadelor, sunt elemente puternic electronegative si, posedind o afinitate mare pentru electroni, formeaza usor ioni negativi cu metalele sau cu hidrogenul prin atragerea unui electron in stratul de valenta.
Grupe
Deplasindu-ne de sus in jos in coloanele (grupele) tabelului periodic, fiecare element va avea un strat de electroni in plus fata de cel de deasupra lui. Chiar daca sarcina nucleului creste pe aceasta directie, straturile suplimentare si distanta din ce in ce mai mare a nucleului fata de electronii de pe ultimul strat face ca acesti electroni sa fie mai putin legati. Una dintre cauze o constituie influenta straturilor interioare de electroni care au un efect de ecranare, reducind astfel forta de atractie exercitata asupra electronilor de valenta, ceea ce conduce la formarea de cationi. Influenta combinata a acestor factori conduce la o tendinta puternica a elementelor metalice din coltul din stinga jos al tabelului periodic (metalele alcaline grele) de a forma cationi, in timp ce elementele nemetalice din coltul din dreapta sus (halogenii usori) formeaza anioni.
In prezentul referat vom studia Grupa a III-a principala
Grupa a III-a principala contine elementele:
- Bor
- Aluminiu
- Galiu
- Indiu
- Taliu
- Ununtrium
1.Bor
Caracterizare generala
Borul fost descoperit de Humphrey Davey, J. L. Guy-Lussac si L. Y. Thernard in anul 1808; fiind primul element al grupei a XIII-a, are configuratie electronica 1s2 2s2 2p1 si seamana foarte mult cu siliciul in baza regulii similitudinii pe diagonala. Borul nemetal are conductibilitate electrica de tip semiconductor. Oxizii borului sunt oxizi acizi cu proprietati refractare, iar carbunele de bor are o stabilitate chimica foarte mare, fiind dur si refractar, formeaza numai combinatii covalente (XB = 2,04) in care este trivalent si nu monovalent cum ar fi daca se ia in considerare configuratia sa electronica. Ionul monovalent al borului B+ nu se poate forma deoarece s-ar consuma o energie de ionizare mare, ce nu poate fi acoperita de energia de retea sau hidratarea ionilor. Trivalenta borului e o consecinta a hibridizarii sp, cand energia legaturii formate cu cei trei orbitali hibrizi sp cu unghiuri intre ei de 1200C o depaseste pe cea a formarii covalentei. Borul are numar atomic 5, masa 10,82, are doi izotopi stabili B10 (19%) si B11 (81%) si se gaseste in natura sub forma de combinatii, ca si in plante tehnice cum ar fi bumbacul.
Borul in stare naturala
Se obtine prin doua metode industriale:
- reducerea anhidridei borice cu magneziu sau sodiu;
- reducerea clorului de bor in curent de hidrogen, folosindu-se arcul electric intre 1200-14000C
In stare pura se afla sub forma de cristale negre, cenusii si exista in doua modificatii aleotropice: cristalizat (Á = 2,54) si amorf (Á = 2,45) Borul este indiferent fata de apa si aer, la incalzire manifesta o activitate chimica inalta. Reactioneaza cu clorul la 4000C, cu bromul la 7000C si la peste 9000C cu azotul, iar combinandu-se cu carbonul rezulta o substanta mai tare decat diamantul; se foloseste in fabricarea otelurilor speciale (ferobor) a diferitelor aliaje cu wolfram, cupru si crom. La trecerea de la aluminiu la galiu, razele atomice cresc foarte putin comparativ cu cresterea observata in trecrea de la bor la aluminiu, in timp ce potentialul primar de ionizare explica raspandirea in natura a borului. Se caracterizeaza prin deficienta de electroni la atomul central; tendinta de a-si completa octetul de electroni sau de a utiliza orbitali p vacanti se poate face astfel:
|
- formarea unei duble legaturi p-p intre atomi si o pereche de electroni neparticipanti
- formarea legaturilor de tricentre: B2H6, Al2Cl6, Al2CH3
- complexare cu donori de electroni (legaturile de trei electroni sunt mai slabe decat cele de doi electroni)
Cu molecule sau anioni se fac complecsi in care borul are numarul de coordinatie 4, borul nu face cationi trivalenti, astfel nu se stiu saruri ale borului cu oxiacizii: sulfati si azotati. Fosfatul de bor (BPO4) nu este o sare, ci un oxid mixt covalent cu structura cristalina identica cu a cristobalitei, arsenatul de bor (BAsO4) cristalizeaza in reteaua cuart.
Raspandire in natura
Borul este putin raspandit in scoarta pamantului (0,014%), cel mai cunoscut mineral fiind turmalina (boroaluminosilicat complex). Dintre boratii minerali din natura amintim boraxul (Na2B4O7 . 10 H2O), kernitul (Na2B4O7 . 4 H2O), borocalcitul (CaB4O7 . 4 H2O) si colemanitul (CaB3O4(OH)3 . 3 H2O); acidul boric B(OH)3 se formeaza in scoarta prin descompunerea silicatilor cu apa calda, fiind exploatat in industrie.
Cristale de bor in manunchiuri
Metode de obtinere
Dupa starea lui structurala, borul cristalin in stare pura se obtine greu datorita reactivitatii mari, dar borul amorf, negru se obtine prin reducerea metalotermica a boratilor: Na2B3O7 + 2 HCl + 5 H2O = 4 H3BO3 + 2 NaCl; 2 H3BO3 se descompune in B2O3 si 3 H2O, in final B2O3 se descompune in 2 B + 3 MgO si astfel se obtine bor de puritate 95-98%.
|
Proprietati generale |
|
|
Nume, Simbol, Numar atomic |
Bor, B, 11 |
|
Grupa, Perioada, Bloc |
3, 2, p |
|
Masa atomica |
10,81uam |
|
Configuratie electronica |
[He] 2s22p1 |
|
e- pe nivel de energie |
2, 2,1 |
|
Proprietati fizice |
|
|
Stare de agregare |
Solid |
|
Densitate |
2,34g/cm³ |
|
Punct de topire |
2300oC |
|
Punct de fierbere |
2550oC |
|
Proprietati atomice |
|
|
Electronegativitate |
2,0 |
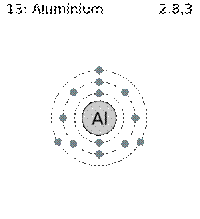
2. Aluminiu
Este si supranumit metalul secolului XXI
A fost descoperit de Hans Christian Oersted in
anul 1808, cuvantul "aluminiu" isi are originea in latinescul "alumen". Se
obtine din bauxita si este foarte raspandit in special in industria aeronautica
si a cutiilor pentru bauturi.
Caracteristici:
Simbol chimic: Al
Numar atomic: 13
Masa atomica: 26.98 g/mol
Valenta: III
Densitate, (la 20°C): 2,698 g/cm³ , (putin inferioara titanului)
Electronegativitate (pe scala Pauling): 1.6
Punct de topire: 660 °C
Punct de fierbere: 2519 °C
Stare: solida (metal)
Culoare: alb
Alte caracteristici: maleabil, ductil, nu prezinta proprietati magnetice.
|
Aluminiu |
|
|
Modelul atomic |
|
|
Simbol |
Al |
|
Numar atomic |
13 |
|
Masa atomica |
26.98 g/mol |
|
Densitate |
2,698 g/cm3 |
|
Punct de topire |
660°C |
|
Punct de fierbere |
2519°C |
|
Alte proprietati |
metal, solid, alb |
Raspandire in natura: Al este cel mai raspandit metal in natura; el alcatuieste 7,4% din scoarta pamantului. Al nu exista in stare nativa. Dintre mineralele mai importante sunt: micele, feldspatii respectiv si produsele de alterare ale acestora: caolinul si argila, corindonul si varietatile lui, bauxita apoi criobitul.
Preparare: fabricarea Al comporta doua etape:
a) fabricarea oxidului de Al
b) obtinerea Al din
alumina
a) Al , mai ales acela destinat constructiilor de avioane nu trebuie sa contina nici fier nici siliciu. De aceea cand bauxitele contin cantitati mai mari de fier si de siliciu, ele trebuie supuse unor tratamente prealabile de purificare.
Procedeul Bayer este unul dintre cele mai raspandite procedee pentru fabricarea aluminei din bauxite sarace in fier si siliciu. In acest procedeu, bauxita, in prealabil calcinata si macinata, este tratata cu hidroxid de sodiu, in autoclave, la 4 - 6 at si 160 - 180 C. Oxidul de Al din bauxita trece in solutie sub forma de aluminat de sodiu Na[Al(OH)4]. Amestecul se filtreaza, separandu-se solutia de aluminat de sodiu de hidroxizii de fier si de combinatiile siliciului cu aluminatul de sodiu.
In solutia cu
aluminat de sodiu se introduce fie un curent de bioxid di carbon, cand
precipita hidroxidul de Al;
2Na[Al(OH)4] + CO2 = 2Al(OH)3 + Na2CO3 + H2O
fie cantitati mici de Al(OH)3 care amorseaza desc aluminatului
avand rol de germen de cristalizare pentru separarea hidroxidului de Al:
Na[Al(OH)4] = Al(OH)3 + NaOH
Hidroxidul de aluminiu
obtinut se calcineaza in cuptoare rotative la 12000 grade Celsius
cand trece in oxid de Al:
2Al(OH)3 = Al2O3 + 3H2O
Noroaiele rosii
ramase de la separarea hidroxidului de Al contin in afara de
oxizi de fier si siliciu, oxid de titan si oxid de vanadiu, a
caror extragere este o problema luata in cercetare.
Un continut mai mare de siliciu in bauxita este daunator, deoarece siliciul trece in Al2O3, de unde poate patrunde in Al metalic.
b) Oxidul de aluminiu nu poate fi redus cu carbune deoarece s-ar forma carbura de aluminiu, Al4C3. Cum insa alumina are un punct de topire foarte ridicat (20500C) in topitura se adauga drept fondant criolit, care scade temperatura de topire la 9800C. Se lucreaza la intensitati de curent de peste 50000A.
Celula electrolitica este formata dintr-o cuva de otel captusita cu blocuri de grafit suspendati in topitura. Prin trecerea curentului electric, Al se aduna in jurul catodului la fundul celulei, de unde este scos periodic, iar O este pus in libertate la anod, unde se uneste cu carbonul electrodului formand oxizi de carbon. Anodul fiind consumat, trebuie inlocuit din timp in timp. Al obtinut este impur si trebuie rafinat. Pentru obtinerea aluminiu foarte pur, cu 99,90 - 99,99% Al se foloseste rafinarea electrolitica.
Proprietati fizice: aluminiu este un metal alb - argintiu, care cristalizeaza in sistemul cubic cu fete centrate. Este un metal usor mai putin dur decat cuprul. Aluminiul este un foarte bun conducator de caldura si electricitate. Conductibilitatea electrica si cea termica sunt aproximativ pe jumatate cat la cupru; este foarte plastic; poate fi laminat, batut in foi foarte subtiri sau transformat in sarma fina.
Proprietati chimice: aluminiul este un element activ din punct de vedere chimic. Desi are caracter puternic electropozitiv la temperatura obisnuita aluminiul pur devine stabil in aer, deoarece este aparat de pelicula subtire de oxid de aluminiu format la suprafata lui. Tot asa de stabil este fata de apa. Formarea peliculei de oxid de aluminiu care protejeaza metalele de actiunea aerului si umezelii poate fi impiedicata prin analgamarea suprafetei aluminiului. De aceea, o bucata de tabla de aluminiu analgamata prin frecarea suprafetei cu o solutie concentrata de clorura mercurica sau pulbere de oxid de mercur sau direct cu mercur, expusa la aer, se acopera cu eflorescente albe datorita formarii hidroxidului de aluminiu.
Incalzit pana
la 7000C, aluminiul in pulbere arde in aer cu lumina stralucitoare,
formand oxid de aluminiu. Cantitatea de caldura degajata in aceasta
reactie este apreciabila.
4Al+3O2=2Al2O3
Din cauza afinitatii mari a aluminiului pentru O, el il scoate din
oxizii metalici mai putin activi.
De exemplu, daca un amestec format din pulbere de aluminiu si
oxid de fier este aprins, datorita reactiei care are loc:
2Al
+ Fe2O3 = Al2O3 + 2Fe
Este extrem de energica
iar caldura degajata ridica temperatura produselor pana la
peste 20000C. La aceasta temperatura fierul se topeste iar
oxidul de aluminiu se ridica la suprafata. Reactia sta
la baza procedeului aluminotermaplicat la extragerea unor metale din oxizii lor
cum si pentru obtinerea temperaturii inalte necesare sudurii
fierului. hidroxidului de
AL :
3. Galiu
Galiul este un metal moale, ductil, de culoare cenusie, folosit la fabricarea unor termometre care masoara temperaturi inalte sau (ca aliaj) la fabricarea tranzistoarelor, la construirea oglinzilor optice. A fost descoperit de Paul Emile Lecoq de Boisbaudran in 1875. Originea numelui: din cuvantul latinesc Gallia (vechiul nume al Frantei). Se foloseste la producerea semiconductoarelor. Se obtine din: bauxita, geramnita, carbine.
4. Indiu
'INDIU s.n. Element chimic, metal maleabil, alb-argintiu, care se gaseste in cantitati mici in blenda si care este folosit la acoperirea suprafetelor metalice, in unele aliaje. Cuvantul isi are originea din fr. indium.
5. Taliu
6. Ununtrium
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2026 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Proiecte pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||