
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Izoenzime - sisteme (complexe) multienzimatice |
Izoenzime - sisteme (complexe) multienzimatice
Cercetarile din ultimele decenii au evidentiat ca in cazul unor cai metabolice toate enzimele care catalizeaza reactii individuale (sau numai o parte din ele) sunt asociate in forma de 'complexe multienzimatice'. In aceste complexe enzimele sunt fixate prin legaturi slabe, intr-o ordine corespunzatoare intrarii lor in actiune, pe o proteina, 'centrala' care poate fi chiar una dintre enzime (Fig. 2.). Proteina centrala dispune de un 'brat' al carui rol este urmatorul: fixeaza substratul S1 si il duce la enzima E1 care il transforma in P1; cum P1 este in acest caz S2, bratul il preia si il duce la E2 care il transforma in P2. La nivelul fiecarei enzime bratul indeplineste rol similar asigurand formarea produsului unic al tuturor enzimelor complexului. Avantajul este ca bratul duce de fiecare data S la E corespunzatoare potrivindu-l cu mare exactitate pe centrul activ, ceea ce asigura pe ansamblu o viteza mai mare decat cea corespunzatoare actiunii enzimelor neasociate.
Complexe multienzimatice bine cunoscute sunt 'acid gras sintetaza' (vezi biosinteza acizilor grasi) si 'complexul piruvat dehidrogenaza' (vezi degradarea oxidativa a glucozei) a caror alcatuire si mod de actiune sunt mai complicate.
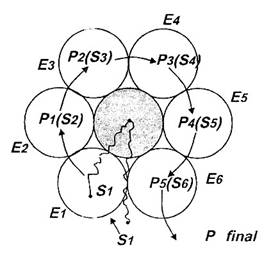
Fig. 2 - Reprezentare intuitiva a structurii si modului de functionare
a unui complex multienzimatic cu sase enzime
IZOENZIME
O parte dintre enzimele care au si structura cuaternara se prezinta sub mai multe forme moleculare. Pentru o enzima data, formele moleculare sub care ea apare se numesc izoenzime. Toate izoenzimele unei enzime catalizeaza aceeasi reactie; difera doar viteza pe care fiecare o imprima reactiei unice.
Structural, izoenzimele unei enzime difera prin raportul in care sunt asociate lanturile polipeptidice de baza (subunitatile, monomerii), care, in acest caz sunt de cel putin doua tipuri. In cazul lactatdehidrogenazei (LDH) cele doua lanturi de baza sunt H (de la heart=inima) si M (de la muscle=muschi). Cele cinci izoenzime ale LDH sunt tetrameri cu urmatoarele asocieri:
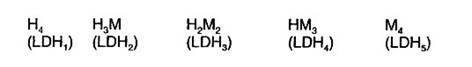
Intre lanturile H si M exista foarte mici diferente din punctul de vedere al structurii primare in timp ce structurile secundara si tertiara sunt atat de apropiate incat asocierile in oricare din variantele de mai sus se fac cu aceiasi usurinta (evident, aceste asocieri se datoreaza formarii de legaturi ionice, hidrofobe, de hidrogen etc).
Cea mai mare parte a proprietatilor fizico-chimice ale izoenzimelor unei enzime date sunt foarte apropiate. Diferente semnificative apar cand unul din lanturile de baza difera de celalalt printr-un aminoacid dicarboxilic suplimentar sau aminoacid diaminic suplimentar. Se exemplifica tot prin LDH ale carei izoenzime se diferentiaza prin sarcina electrica ca urmare a unei asemenea diferente de structura primara a celor doua lanturi de baza. Aceasta insusire a stat la baza separarii electroforetice a izoenzimelor LDH; in prezent dozarea pe aceasta cale a izoenzimelor LDH serice se practica curent in scop diagnostic (se va vedea in continuarea acestui capitol).
Lanturile polipeptidice de tip H si M ale izoenzimelor LDH, pe plan mai general lanturile polipeptidice de baza din izoenzime, sunt codificate de gene diferite; in conditiile asocierii lor cu egala usurinta in oricare din cele cinci forme izoenzimatice, intr-o specie celulara proportia relativa a izoenzimelor este determinata numai de intensitatea biosintezei celor doua lanturi. La randul ei, intensitatea biosintezei lanturilor H si M este specifica fiecarui tip de celule. Se reaminteste in acest sens ca izoenzimele LDH catalizeaza reactia:
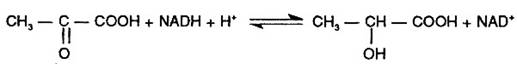
In sensul de la stanga la dreapta aceasta reactie incheie glicoliza in conditii anaerobe (vezi 'Glicoliza' in capitolul 'Metabolismul glucidelor'). De aceea izoenzimele LDH cu capacitate ridicata de transformare a piruvatului in lactat sunt necesare, de exemplu in muschi (care in efort catabolizeaza glucoza anaerob). Aceste izoenzime sunt M4 si M3H. Muschii sintetizeaza deci mai intens lanturile M decat cele H. Inima, tesut cu catabolism aerob al glucozei, sintetizeaza intens lantul H, izoenzimele H4 si H3M avand o capacitate foarte redusa de transformare a piruvatului in lactat.
Creatinfosfokinaza sau creatinkinaza (notata CPK sau CK) are trei izoenzime. Lanturile de baza care se asociaza in acest caz sunt M (tot de la muscle) si B (de la brain=creier); fiecare izoenzima este un dimer, respectiv M2, MB si B2 si aceste izoenzime se afla in ser si pot fi separate prin electroforeza.
In tesuturi, izoenzimele indeplinesc importante roluri reglatorii fiind sigur implicate si in morfogeneza si diferentierea celulara.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








