
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Cinetica enzimatica - exprimarea vitezei reactiilor enzimatice. activitatea enzimelor |
Cinetica enzimatica - exprimarea vitezei reactiilor enzimatice. activitatea enzimelor
Cinetica enzimatica studiaza viteza reactiilor catalizate de enzime in functie de variatia raportului concentratiilor enzimei si substratului (aEs, aSs) si a influentelor unor factori fizico-chimici cum sunt: temperatura, pH-ul, inhibitorii etc.
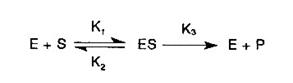
Conceptia unanim admisa in enzimologie ca formarea din substrat a produsului de reactie implica obligatoriu existenta complexului enzima-substrat (ES) redata prin ecuatia:
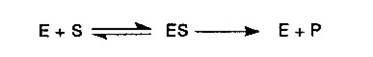
a fost statuata in primul rand in legatura cu cinetica reactiilor catalizate de enzime; de aceea, in interpretarea fiecaruia dintre aspectele cuprinse in acest subcapitol punctul de plecare il reprezinta chiar aceasta ecuatie.
1. EXPRIMAREA VITEZEI REACTIILOR ENZIMATICE. ACTIVITATEA ENZIMELOR
Utilizarea curenta in cinetica enzimatica a acestor termeni face necesara definirea lor. Viteza de reactie se exprima prin cantitatea de substrat transformata in produs de reactie (exprimata in miligrame, mai rar in grame) intr-o unitate de timp (secunda, minut).
Pentru enzimele purificate, carora li se cunoaste masa moleculara se poate stabili numarul de molecule de substrat transformate de catre o molecula de enzima intr-o secunda, valoare ce reprezinta 'activitatea moleculara' a enzimei. Aceasta marime, sinonima cu eficienta catalitica, este importanta pentru ca permite atat comparatii intre diversele enzime cat si a enzimelor in raport cu catalizatorii chimici. Pe de alta parte, pentru enzimele a caror activitate moleculara este stabilita, pe baza masurarii cantitatii de substrat transformat, de exemplu de catre un omogenat tisular, se poate calcula concentratia enzimei (numarul de molecule) din acel omogenat.
In practica biochimica curenta, inclusiv in cadrul determinarilor enzimatice in scop de diagnostic (in special in ser), intereseaza mai putin activitatea absoluta, fiind insa importante variatiile de activitate; in acest caz este suficient sa existe o anumita unitate arbitrara de activitate care sa serveasca drept referinta. Se utilizeaza urmatoarele unitati:
unitatea internationala, UI; o unitate internationala reprezinta cantitatea de enzima care asigura conversia unui umol de substrat/min in conditii standardizate de pH, temperatura, prezenta cofactorilor (care sunt stabiliti pentru fiecare enzima).
Katalul (Kat); un Kat reprezinta acea cantitate de enzima care asigura transformarea unui mol de substrat/sec (cu multiplu kilokat si submultipli mkat si kat).
Pentru unele enzime se utilizeaza si alte unitati. Astfel pentru oxidoreductazele cu coenzime NAD+ (NADH + H+) sau (NADPH + H+) activitatea se exprima prin cresterea sau scaderea extinctiei la 340 nm formele reduse ale enzimelor absorbind aceasta radiatie, in timp ce formele oxidate nu o absorb; o unitate enzimatica pentru aceste hidrogenaze-dehidrogenaze reprezinta cresterea sau scaderea cu 0,001 a extinctiei la 340 nm intr-un minut (cuva de 1 cm).
Pentru fosfatazele din ser se utilizeaza unitatea Bodansky care reprezinta cantitatea de enzima ce formeaza, prin hidroliza esterilor fosforici, un mg de fosfat anorganic (in conditii standardizate de pH, temperatura).
2. VITEZA INITIALA A REACTIILOR ENZIMATICE
Daca unui substrat aflat in solutie i se adauga o cantitate de enzima care catalizeaza transformarea acelui substrat se constata ca formarea in timp a produsului P are loc dupa o curba ca cea din Fig. 10. Ea are o portiune rectilinie (cu panta constanta), apoi se inclina si in final se aplatizeaza. Este necesar ca in masuratorile de cinetica sa se ia valoarea notata v0, numita viteza initiala si care reprezinta viteza reactiei pe portiunea rectilinie. Datorita concentratiei mari a substratului corespunzatoare acestei portiuni, ES se transforma numai in E + P (nu si in E + S). In practica se determina viteza reactiei in primele secunde (sau minute pentru reactii lente) si aceasta se considera v0
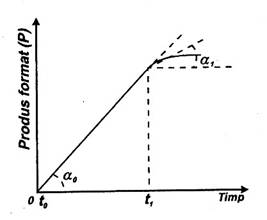
Fig. 10. Determinarea vitezei initiale (v0) a unei reactii enzimatice.
3. INFLUENTA PH-ULUI SI TEMPERATURII
ASUPRA ACTIVITATII ENZIMELOR
Enzimele produse de celule pentru cataliza reactiilor care au loc in interiorul lor sau in afara (cazul enzimelor plasmatice, digestive) sunt adaptate conditiilor de pH, temperatura si altor factori caracteristici locului de actiune.
Daca in organismul uman temperatura la care se desfasoara toate reactiile enzimatice este in mod curent constanta (370C), atunci cand se fac studii de cinetica in vitro, temperatura poate fi variata in limite destul de largi.
Activitatea orcarei enzime variaza cu temperatura dupa o curba ca cea din Fig. 11.
Cresterea vitezei reactiei catalizate odata cu cresterea temperaturii este interpretata prin prisma 'energiei de activare', asa cum s-a prezentat anterior. Pentru fiecare enzima se poate stabili (in conditiile mentinerii constante a celorlalti parametri) un 'coeficient terminal reactiei' notat Q10 care reprezinta cresterea vitezei reactiei pentru o crestere cu 100C a temperaturii.
Valoarea coeficientului termic pentru reactiile enzimatice este cuprinsa obisnuit intre 1 si 2 fiind mai mica decat pentru reactiile chimice necatalizate (Q10 intre 2 si 4). Relatia este valabila numai pana la o anumita temperatura numita temperatura optima, topt pentru care viteza atinge valoarea maxima. Peste topt viteza reactiei scade brusc datorita denaturarii termice a apoenzimei (constand mai ales in ruperea legaturilor de hidrogen), fiind afectat si centrul activ. Topt pentru enzimele din organismul uman este intre 40-500C. Exista enzime, in alte sisteme vii, a caror topt este mai ridicata (la plante 50-600C, chiar 80-1000C la enzime din microorganisme care traiesc in ape termale).
Cand se determina activitatile unor enzime in scop diagnostic (de exemplu activitatea enzimelor plasmatice), este obligatoriu ca aceasta sa se faca la o temperatura fixa, in cazul celor mai multe dintre ele 370C.
Influenta temperaturii asupra activitatii enzimelor este foarte importanta in criobiologie; un caz il constituie conservarea la temperaturi scazute a organelor in vederea transplantului.
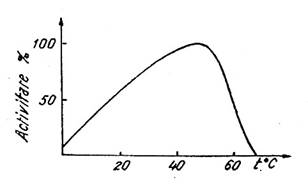
Fig. 11. Variatia activitatii enzimelor in functie de temperatura.
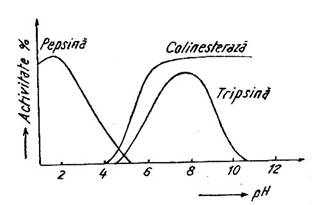
Fig. 12. Variatia activitatii unor enzime in functie de pH.
Viteza reactiilor enzimatice este influentata, de asemenea, de pH. Pentru enzimele din organismul uman pH-ul optim de actiune este chiar pH-ul normal al mediului in care ele isi indeplinesc functia catalitica (cazul pepsinei si tripsinei din Fig. 12.). Cum in majoritatea tesuturilor din organism pH-ul este in jur de 7 si enzimele au actiune optima in apropierea acestei valori.
Diminuarea vitezei reactiei enzimatice la valori de pH mai mici sau mai mari decat cel optim se realizeaza in mod specific pentru fiecare enzima. intre multiplele actiuni ale ionilor H+ si OH- asupra enzimelor se mentioneaza in primul rand efectul lor denaturant; spre deosebire de efectul denaturant al temperaturii, in acest caz se rup mai ales legaturile de tip electrovalent. La enzimele in al caror centru activ se afla grupari ionizabile, acide sau bazice, acesta interactioneaza direct cu ionii H+ si OH-, rezultatul fiind cresterea sau scaderea gradului lor de disociere; ionii H+ si OH- actioneaza in acest caz ca adevarati inhibitori (vezi mai departe inhibitia activitatii enzimelor).
Un exemplu de actiune a pH-ului asupra enzimei il constituie inactivarea la nivelul stomacului (pH 1-2) a amilazei salivare (pH optim 6,6-6,8) care este antrenata cu alimentele din cavitatea bucala.
4. INFLUENTA CONCENTRATIEI ENZIMEI
Eficienta catalitica deosebita a enzimelor este responsabila de faptul ca in reactiile enzimatice ce au loc in vivo, concentratia substratului este mult superioara concentratiei enzimei; exista totusi unele situatii cand regula nu se respecta, concentratia enzimei putand fi chiar mai mare decat cea a substratului. in vitro este foarte usor sa se faca un asemenea experiment, luand mai multe eprubete care contin aceeasi cantitate de substrat dar cantitati din ce in ce mai mari de enzima. Daca se determina v0 pentru fiecare proba si apoi se reprezinta grafic v0 in functie de aEs se obtine o dreapta ca cea din Fig. 13.
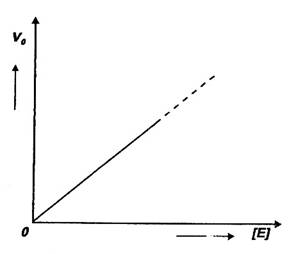
Fig. 11.13. Variatia vitezei unei reactii enzimatice in functie de
concentratia enzimei.
Matematic, aceasta linearitate se exprima prin relatia:
![]()
unde K este o constanta caracteristica pentru fiecare sistem enzima-substrat.
Cresterea lineara a vitezei se explica prin formarea complexului ES in dependenta doar de aEs, in aceste conditii complexul transformandu-se integral in produs de reactie.
In aceasta reprezentare, la o concentratie a enzimei egala cu zero, v0=0, sugerand ca reactia nu se desfasoara deloc in lipsa enzimei. Totusi reprezentarea este corecta pentru ca in practica enzimatica curenta v0 in lipsa E se scade din v0 in prezenta ei (se face un asa numit 'blanc' reprezentand tocmai valoarea lui v0 in lipsa lui E care se scade din valoarea v0 a fiecarei probe).
Proportionalitatea
intre viteza v0 si aEs are importante aplicatii practice: de
exemplu, este posibil sa se estimeze concentratia relativa a unei enzime in
omogenate celulare fara a fi necesar sa se efectueze o purificare prealabila a
acesteia. Pe de o parte, ![]() , iar pe de alta parte
, iar pe de alta parte ![]() (unde
(unde ![]() = concentratia
produsului reactiei, t = timpul de desfasurare al reactiei); deci:
= concentratia
produsului reactiei, t = timpul de desfasurare al reactiei); deci:
![]()
Daca
timpul pentru studierea reactiei este mereu acelasi (deci constant) si produsul
![]() = constant (notat K1); in aceste conditii,
concentratia in enzima este direct proportionala cu cantitatea de produs format
aEs = aPs/K1.
= constant (notat K1); in aceste conditii,
concentratia in enzima este direct proportionala cu cantitatea de produs format
aEs = aPs/K1.
Asemenea masuratori de concentratii relative a enzimelor se efectueaza sistematic in laboratoarele de analize medicale (mai ales asupra sangelui) deoarece variatiile sunt corelate cu diferite stari patologice, (vezi subcapitolul 'Enzimele in diagnosticul clinic').
|
5. INFLUENTA CONCENTRATIEI SUBSTRATULUI.
ECUATIA MICHAELIS-MENTEN
Concentratia majoritatii enzimelor celulare este constanta in timp; fac exceptie enzimele numite 'inductibile' (vezi 'Reglarea activitatii enzimelor') precum si enzimele plasmatice nefunctionale a caror concentratie creste sau scade in anumite stari patologice (vezi 'Relatia enzime - patologie'). In schimb, concentratia substratelor celor mai multe enzime variaza destul de mult dupa starea metabolica a tesutului si numerosi alti factori. De aceea dependenta vitezei de reactie de concentratia substratului constituie aspectul cel mai important al cineticii enzimatice. In acest caz, reprezentarea grafica a lui v0 in functie de aSs (aEs, temperatura si pH-ul fiind constante) conduce la o curba cu aspect de hiperbola (Fig. 14). Exista si exceptii, enzime pentru care in loc de hiperbola se obtine o curba sigmoidala (vezi 'Enzimele alosterice').
Din analiza curbei reiese ca v0 creste proportional cu cresterea aSs numai pentru valori mici ale acesteia; apoi cresterea se face tot mai lent pentru ca dincolo de punctul 8, oricat de mult ar creste aSs, viteza reactiei ramane constanta; valoarea constanta a vitezei este si valoarea maxima, notata Vmax.
Explicatia alurei curbei precum si o ecuatie in care v0 se exprima in functie de aSs, Vmax si o constanta KM, se datoreaza lui Michaelis si Menten.
In deducerea ecuatiei se pleaca de la:
 (1)
(1)
In completare la cele mentionate anterior in legatura cu aceasta ecuatie generala se precizeaza ca transformarea ES E + P este de regula ireversibila din doua motive: pe de o parte, este etapa mai lenta, pe de alta parte, P devine, in cadrul caii metabolice specifice, substrat pentru reactia urmatoare si deci se consuma rapid (exista totusi reactii enzimatice in care reformarea lui ES din E si P nu poate fi neglijata).
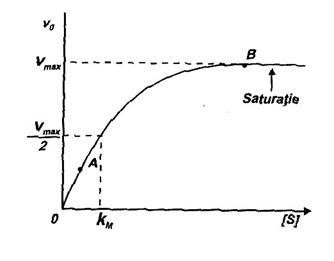
Fig. 14. Variatia vitezei reactiei enzimatice
in functie de concentratia substratului.
Deoarece viteza reactiei catalizata enzimatic se exprima prin cantitatea de P format intr-o unitate de timp, iar aPs este proportionala cu aESs, se poate scrie
![]() (2)
(2)
Cantitatea de ES disponibila pentru transformarea in E si P este insa dependenta, pe de o parte, de viteza cu care se formeaza, iar, pe de alta parte, de viteza de disociere in E si S; aceste viteze sunt redate prin:
- viteza de
formare a lui ![]() (3)
(3)
unde aEs reprezinta concentratia enzimei libere (disponibila in momentul dat pentru formarea ES);
- viteza de
disociere a lui ![]() (4)
(4)
Daca reactia face parte dintr-o cale metabolica aESs ramane practic constanta ('steady state', stare stationara) si variaza numai aSs si aPs. Conditia matematica pentru aceasta este ca viteza de formare a lui ES sa fie egala cu suma vitezelor de transformare in E si P si refacere a lui E + S, deci:
![]() (5)
(5)
sau: 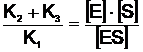 (6)
(6)
Raportul constantelor este tot o constanta, notata KM, deci:
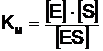 (7)
(7)
care poate fi scrisa si sub forma:
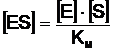 (8)
(8)
Deci pentru calculul pe baza ecuatiei (7) a lui KM, care are o deosebita importanta in enzimologie, este necesara masurarea directa a lui aEs si aESs. Aceste determinari sunt deseori dificile; de aceea se urmareste obtinerea unei ecuatii in care KM sa fie corelat cu parametri mai usor masurabili. In acest scop aEs se exprima prin:
![]() (9)
(9)
unde aETs este concentratia totala a enzimei in mediu.
Substituind pe aEs din (9) in (8) se obtine:
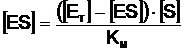 (10)
(10)
care prin rezolvare conduce la:
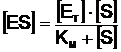 (11)
(11)
Substituind aceasta valoare a lui ES in (2), se obtine:
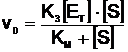
Cum s-a aratat, cand concentratia substratului este mare (caz frecvent in vivo), viteza reactiei este Vmax ceea ce presupune participarea in totalitate a enzimei la reactie, deci:
Vmax = K3aETs (13)
Substituind in (12), se obtine:
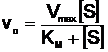 (14)
(14)
Aceasta este ecuatia Michaelis-Menten sau ecuatia de viteza a reactiilor enzimatice cu un singur substrat. Ea reda deci variatia lui v0 in functie de variatia lui aSs; in ecuatie mai apar constanta KM si Vmax (care exprima indirect concentratia enzimei).
Concordanta ecuatiei cu alura curbei din Fig. 14 este exceptionala; pentru verificare se dau doua situatii:
a. Cand S are concentratia foarte mica (corespunzator portiunii O - A pe curba), valoarea lui la numitor poate fi neglijata si ecuatia (14) devine:
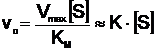 (15)
(15)
adica v0 este direct proportionala cu aSs;
b. Cand S are concentratia foarte mare in raport cu KM (corespunzator punctului B pe curba), valoarea acesteia din urma poate fi neglijata, deci:
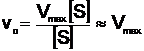 (16)
(16)
adica v0 atinge valoarea maxima.
6. DETERMINAREA EXPERIMENTALA A KM;
SEMNIFICATIA ACESTEI CONSTANTE.
CONSTANTA CATALITICA, Kcat
Fiecare enzima se caracterizeaza printr-o valoare particulara a KM; aceasta valoare se determina in principiu astfel: se prepara o serie de 6-10 probe (intr-o solutie tampon potrivita) introducandu-se in toate aceeasi cantitate de enzima dar realizandu-se un gradient crescator al substratului. Reactia, declansata in momentul amestecarii enzimei cu substratul, este lasata sa se desfasoare un anumit timp (secunde, minute, dupa caz) apoi este intrerupta prin adaosul unui inhibitor potrivit. Se masoara in fiecare proba cantitatea de produs format; cu aceste date se calculeaza valorile v0 care se reprezinta grafic in functie de aSs crescator. Se obtine curba hiperbolica caracteristica (Fig. 14). Portiunea dreapta paralela cu abscisa (corespunzatoare saturarii E cu S) se prelungeste pana la intersectia cu ordonata; intersectia reprezinta Vmax. Se ia valoarea Vmax/2, se duce o dreapta paralela cu abscisa pana la intersectia cu curba si de aici se duce o dreapta paralela cu ordonata pana la intersectia cu abscisa, care este chiar KM.
Daca in ecuatia Michaelis-Menten se substituie v0 cu V^Jl se obtine succesiv:
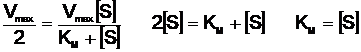 (17)
(17)
Se trage concluzia: KM reprezinta acea concentratie a substratului pentru care viteza reactiei este jumatate din Vmax; in consecinta valorile lui KM se dau in moli/litru.
Semnificatia lui KM reiese daca se apeleaza la formula (6): KM = (K2 + K3) / K1; considerand K3 << K1 se obtine KM = K2 / K1 si deci 'KM reda capacitatea de disociere a lui ES in E + S'; in alti termeni, ea reda taria legaturii intre E si S in complexul ES. Valorile lui KM pentru diverse enzime sunt cuprinse intre 10-1 - 10-6 moli/litru. Se conchide:
- valorile mici ale KM corespund unei legaturi slabe intre E si S;
- valorile mari ale KM corespund unei legaturi puternice intre E si S.
In cinetica enzimatica se utilizeaza si o alla constanta, rotafaK^ care se defineste prm raportul:
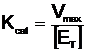 (18)
(18)
Ea reda numarul de transformari substrat produs pe care fiecare centru activ le catalizeaza intr-o unitate de timp (turnover). Cunoscand valorile si semnificatiile lui KM si Kcat se poate calcula Kcat/KM care reda eficienta catalitica a enzimei (Tabelul 2).
Tabelul 2
Valorile KM , Kcat si Kcat/KM ale catorva enzime in raport cu substratele
|
Enzima |
Substratul |
KM(M) |
Kcat(s-1) |
Kcat/KM |
|
Acetilcolinesteraza |
Acetilcolina |
9,5x10-5 |
1,4x104 |
1,5x108 |
|
Anhidraza carbonica |
CO2 |
1,2x10-2 |
1,0x106 |
8,3x107 |
|
Anhidraza carbonica |
HCO-3 |
2,6x10-2 |
4,0x105 |
1,5x107 |
|
Catalaza |
H2O2 |
2,5x10-2 |
1,0x107 |
4,0x108 |
|
Chimotripsina |
Esterul etilic al N-acetil-glicinei |
4,4x10-1 |
5,1x10-2 |
1,2x10-1 |
|
Fumaraza |
Fumarat |
5,0x10-6 |
8,0x102 |
1,6x108 |
|
Ureaza |
Uree |
2,5x10-2 |
1,0x104 |
4,0x105 |
7. ECUATIA LINEWEAVER-BURK
Matematic, ecuatia Michaelis-Menten poate fi transformata in moduri variate. O varianta, datorata lui Lineweaver si Burk, este forma reciproca:
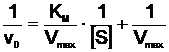 (19)
(19)
Variabilele fiind aSs si v0, ecuajia este de forma generala y=ax+b; reprezentand grafic 1 / v0 in functie de 1/aSs se obtine o dreapta (Fig. 15). Intersectia dreptei cu ordonata corespunde valorii 1/Vmax, iar panta dreptei este data de KM/Vmax. Daca se prelungeste dreapta pana la intersectia cu abscisa, se obtine valoarea -1/KM. Din punctul de vedere al determinarii experimentale a lui KM si Vmax reprezentarea lui 1/v0 in functie de 1/aSs este avantajoasa, numarul de probe necesare pentru obtinerea dreptei (si deci a lui Vmax si KM) fiind mult mai mic in comparatie cu numarul de probe necesare obtinerii hiperbolei. Pe de alta parte, ecuatia lui Lineweaver si Burk este extrem de utila in studii de inhibitie a activitatii enzimelor prin compusi chimici.
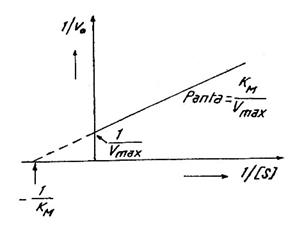
Fig. 15. Reprezentarea grafica a ecuatiei Lineweaver-Burk.
INHIBITIA ACTIVITATII ENZIMELOR
Activitatea multor enzime este inhibata de compusi chimici diversi; in sistemele vii asemenea compusi pot fi de origine endogena (de exemplu diferiti metabolici) sau de origine exogena (cum sunt agentii toxici sau unele medicamente).
Inhibitia enzimelor poate fi reversibila si ireversibila, aceasta din urma numindu-se si inactivare. In ambele cazuri inhibitorul se leaga de enzima, dar in timp ce in inhibitia ireversibila legatura enzima-inhibitor este puternica (covalenta), in inhibitia reversibila legatura este slaba.
Un exemplu de inhibitie ireversibila este oferit de actiunea iodacetamidei asupra enzimelor care au in centrul activ o grupare - SH; are loc reactia:
Enz - CHa - SH + I - CH2 - CONH2 Enz - CH2 - S - CH2 - -CONH2 + HI
Complexul Enz - CH2 - S - CH2 - CONH2 este complet inactiv (nu poate fixa substratul).
Tot gruparile SH din centrele active pot fi blocate si cu acidul paraclormercuribenzoic in timp ce gruparile hidroxil din centrele active (cum este cazul tripsinei) sunt blocate de inhibitorul di-izopropilfluorofosfat
Se cunosc doua variante majore de inhibitie reversibila:
a) Inhibitia competitiva, produsa de inhibitori care se leaga tot la nivelul centrului activ al enzimei, dar prin legaturi slabe. In cazul prezentei simultane in mediu (sau in celule) a substratului si inhibitorului, intre acestia are loc o competitie pentru fixarea pe enzima. La o capacitate egala de legare la nivelul centrului activ a substratului si inhibitorului, enzima va fixa acesti competitori in raport cu concentratiile lor. Inhibitorii competitivi sunt compusi cu structura apropiata de cea a substratului. Evenimentele care au loc pot fi reprezentate simplificat:
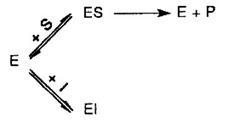
In acest tip de inhibitie, partea din enzima aflata sub forma complexului EI poate fi recuperata daca in mediu apare un exces de substrat (datorita reversibilitatii E +I EI).
Precizarea ca un anumit compus este inhibitor competitiv pentru o enzima data se face in mod simplu; se traseaza dreapta 1/v0 in functie de 1/aSs pentru prezenta in mediu a lui E si S si apoi aceeasi dreapta pentru prezenta in mediu a E, S si I. In ultimul caz se remarca o panta crescuta a dreptei, intersectia cu ordonata nefiind modificata. Valorile intersectiei prelungirii dreptei cu abscisa si panta dreptei sunt modificate cu coeficientul 1 + aIs/KI, unde KI are semnificatie asemanatoare lui KM dar pentru reactia lui E cu I (Fig. 16).
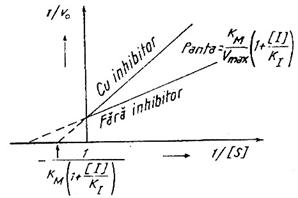
Fig. 16. Reprezentarea grafica a ecuatiei Lineweaver-Burk
in cazul inhibitiei competitive.
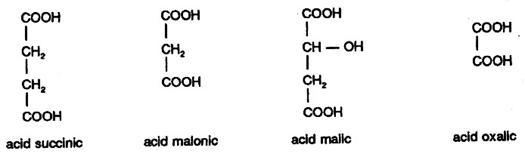
Printre numeroasele inhibitii competitive cunoscute sunt si urmatoarele: Succinat dehidrogenaza, enzima ce catalizeaza transformarea acidului succinic in acid fumaric, este inhibata de acizii dicarboxilici malonic, malic si chiar oxalic.
Un numar de medicamente larg utilizate isi datoreaza efectele faptului ca sunt inhibitori competitivi. De exemplu, sulfanilamida, cea mai simpla sulfamida, este asemanatoare structural cu acidul paraaminobenzoic pe care 3 poate inlocui in cursul sintezei acidului folie de catre bacterii (vezi vitamine si coenzime); cum acidul folie este indispensabil bacteriilor, acestea mor (la om nu se intampla acest lucru deoarece el ia din hrana acidul folie).
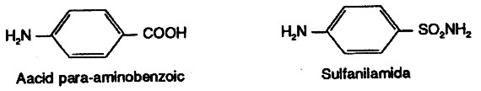
In chimioterapia cancerului se utilizeaza analogi structurali ai bazelor purinice si pirimidinice; ei inhiba sinteza de acizi nucleici impiedicand diviziunea celulara care este mult mai rapida la tumori.
b) Inhibitia necompetitiva; in acest caz inhibitorul, a carui structura poate sa difere destul de mult de structura substratului, se leaga prin legaturi slabe in alt loc decat centrul activ al enzimei. Afinitatea pentru substrat a enzimei pare a nu fi modificata. Exista insa posibilitatea ca o parte din ES cat si EI sa formeze complex ESI; transformarea lui S din acest complex in P este scazuta in raport cu transformarea lui S din ES, deci atat v0 cat si Vmax sunt mai mici. Inhibitia necompetitiva depinde numai de concentratia inhibitorului (si de afinitatea enzimei pentru el) deoarece substratul in exces nu il poate deplasa pe acesta.
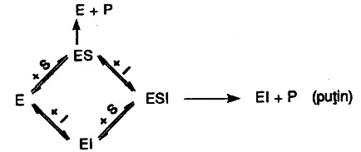
Daca se studiaza cinetica unei asemenea reactii, reprezentarea 1/v0 in functie de 1/aSs conduce le o dreapta a carei prelungire intersecteaza abscisa in acelasi punct cu dreapta obtinuta fara inhibitor (deci valoarea KM nu este modificata); in schimb, sunt modificate intersectia cu ordonata si panta (Fig.17).
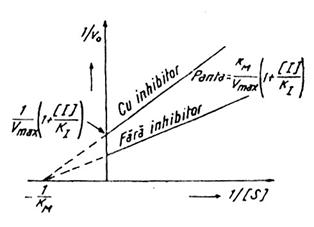
Fig. 17. Reprezentarea grafica a ecuatia Lineweaver-Burk
in cazul inhibitiei necompetitive.
Exemple sunt unele enzime care contin grupari SH libere in alte pozitii decat centrul activ. Aceste grupari pot fixa prin legaturi slabe ioni ai unor metale grele cum sunt Ag+ si Hg+ care diminua sau chiar anuleaza capacitatea enzimelor de a transforma substratele in produsi. Asa se explica efectul otravitor al multor metale grele.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Documente online pe aceeasi tema
| |||
|
| |||
|
|||
|
|
|||








