
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Solutii ideale si solutii reale |
Solutii ideale si solutii reale
Aplicatii
Cati moli existǎ in 2 litrii solutie 3M?
Cati moli existǎ in 600 mL solutie 0,4 M?
Se realizeazǎ solutiile
a. 3 mol NaOH in 4 L solutie.
b. 0,5 mol NaCl in 250 mL solutie.
c. 0,2 mol FeCl3 in 10 L solutie.
Care sunt molaritǎtile?
Cate grame AgNO3 sunt necesare pentru prepararea 250 mL solutie 0,5M? Se dau masele atomice: Ag=108, N=14, O=16.
Amestecuri de gaze
Caracteristicile gazelor p, V, T. Presiunea (p), volumul(V) si temperatura absolutǎ (T) sunt parametrii ce trebuie precizati in aplicatii practice la orice gaz.
Gazele pot da solutii indiferent de gaz dacǎ nu cumva acestea reactioneazǎ chimic. Concentratia acestora se exprimǎ adesea sub formǎ de presiuni partiale.
Presiunea, p si implicit presiunile partiale se poate exprima diferit:
In Pascali (prescurtat Pa) 1 Pa = 1 N/m2
Ca inǎltimea unei coloane de lichid de exemplu mercur (mm Hg)
In bari 1 bar = 105 Pa
In atmosfere fizice (atm) 1 atm = 1,013 bar = 760 mm Hg.
Intre cele trei mǎrimi caracteristice gazelor permanente, la temperaturi ridicate, se respectǎ legea gazului ideal:
pV = nRT
unde R este constanta gazului ideal iar n, numǎrul de moli.
Presiuni partiale si volume partiale. Presiunea partialǎ a unui gaz se defineste ca presiunea pe care ar avea-o gazul dacǎ ar ocupa singur intreaga incintǎ.
In conformitate cu legea lui Dalton pentru amestecuri de gaze:
p = Σpi
unde p este presiunea totalǎ iar pi este presiunea partialǎ a unui gaz i.
Legea gazului ideal se poate aplica separat pe fiecare component al amesteului de gaze:
piV = niRT respectiv pVi = niRT unde pi respectiv Vi sunt presiunea partialǎ respectiv volumul partial al gazului i. Exprimand pe baza ecuatiilor precedente rapoartele:
pi/p = ni/n respectiv Vi/V = ni/n
se observǎ cǎ apar fractiile molare: Xi = ni/n. Se mai observǎ raportul Vi/V care se poate transforma in procent de volum, o altǎ formǎ de exprimare a compozitiei amestecurilor de gaze. Asadar presiunea partialǎ s epoate exprima:,
pi = Xip
Dacǎ notǎm %V procentul de volum se poate scrie %V = 100Vi/V sau
%Vi = 100Xi
Relatii importante pentru aplicatii practice ale compozitei amestecurilor de gaze. Sǎ considerǎm douǎ exemple:
Compozitia atmosferei pe constituentii principali este in %v/v urmǎtoarea:
N2: 79,04 %; O2: 20,93%; CO2: 0,03%. Care sunt fractile molare si presiunile partiale in conditii normale?
Presiunile partiale ale unui amestec de gaze compus din metan, oxigen, monoxid de carbon si apǎ sunt: pCH4=180 mmHg; pO2=270 mmHg; pCO=40 mmHg; pH2O=80 mmHg. Care este procentul de volum al metanului?
Solutii ideale si solutii reale.
In general la dizolvarea unei substante se produce o variatie de volum si o variatie de entalpie. Acestea se datoreaza interactiunilor dintre moleculele substantei si ale solventului.
Se considera prin definitie, o solutie ideala, solutia la formarea careia nu se degaja si nu se absoarbe energie (ΔH = 0), deci caldura de dizolvare este zero. De asemenea itr-o o solutie ideala nu are loc nici o variatie de volum. Aceasta se intampla cand intre moleculele solventului si ale substantei se stabilesc legaturi de aceeasi natura si intensitate ca si intre moleculele fiecarui component separat.
Dizolvarea este determinata, ca si alte procese fizico-chimice, de un factor entalpic (adicǎ unul insotit de degajare sau absorbtie de cǎldurǎ), ΔH si unul entropic, TΔS: ΔH + T ΔS fiind chiar variatia de energie.
Formarea solutiei ideale este determinata exclusiv de factorul entropic, adica de tendinta creea o mai mare dezordine si imprastiere a substantei in solvent. Aceste solutii sunt insa foarte rare.
Solutiile foarte diluate (la "dilutie infinita") se comporta la limita ca solutii ideale. Legile solutiilor ideale sunt legi limita spre care tind solutiile reale la dilutii suficient de mari.
Legile solutiilor ideale - Raoult (1887)
|
Presiunea de vapori
S-a constatat ca presiunea de vapori a solutiilor este mai mica decat a dizolvantului pur. Scaderea presiunii de vapori a solutiilor se datoreaza interactiunilor dintre moleculele substantei dizolvate si ale solventului. Astfel, moleculele solventului "libere" sa realizeze echilibrul de vapori (sa parasesca suprafata solutiei) sunt mai putine, deci presiunea lor de echilibru este mai mica.
Legea lui Raoult arata ca scaderea presiunii de vapori a solutiilor fata de a solventului este direct proportionala cu fractia molara a substantei dizolvate:
p0 - p = x2. p0 p0 - presiunea de vapori a solventului
p - presiunea de vapori a solutiei
Δp = Χ2. p0 unde Χ2 = n2/(n1+n2) este fractia molarǎ a componentului 2 din solutia respectivǎ.
Din aceasta relatie, se poate determina masa moleculara a substantei dizolvate, cunoscand constantele fizice ale solventului si determinand Δp.
Se poate reprezenta grafic variatia presiunii de vapori cu temperatura, pentru solventul pur (apa) si solutie:
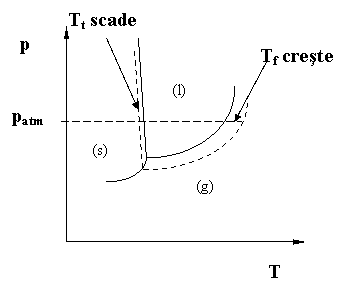
Fig. 1. Reprezentarea variatiei temperaturilor de topire (congelare) si fierbere -condensare pentru solventul pur (linia continua) resspectiv pentru solutie (linia punctatǎ). In dreptul presiunii atmosferice (patm) apare valoarea Tf respectiv Tt.
Din grafic rezulta ca scaderea presiunii de vapori a solutiilor fata de a solventului pur are doua consecinte: cresterea punctului de fierbere al solutiilor (ebulioscopia) si scaderea punctului de congelare a solutiilor (crioscopia). Atat cresterea punctului de fierbere cat si scaderea punctului de congelare sunt proportionale cu concentratia molala, b2 a solutiei:
Δtf = E.b2 = E . ms.1000/Ms.md ms - masa substantei
md - masa solventului
Δtc = K.b2 = K . ms.1000/Ms.md
E - constanta ebulioscopica - cresterea molala a punctului de fierbere.
Adicǎ pentru b=1; Δtf = E
K - constanta crioscopica - scaderea molala a punctului de congelare
b = 1; Δtc = K
Contanta ebulioscopica si crioscopica sunt caracteristici numai ale solventului si nu depind de natura substantei dizolvate.
Aceste doua relatii reprezinta doua metode experimentale importante pentru determinarea maselor moleculare ale substantelor, deoarece marimile Δtf si Δtc sunt usor de determinat experimental.
Presiunea osmotica a solutiilor.
Solutiile prezinta un fenomen interesant si important prin aplicatiile sale, si anume osmoza.Cand doua solutii de concentratii diferite, sau o solutie si dizolvantul pur, sunt separate printr-o membrana semipermeabila care lasa sa treaca numai moleculele solventului, se observa tendinta solventului de a trece prin membrana avand tendinta de a dilua solutia. Fenomenul se poate demnstra simplu cu un dispozitiv numit osmometru. Membrana semipermeabila poate fi o membrana animala (de ex. basica de porc), sau anorganica (Cu2[Fe(CN)6] intr-un vas de portelan poros).
 In palnie se
pune o solutie de zahar si se introduce totul intr-un pahar cu
apa. La inceput, nivelul solutiei de zahar din palnie si al
apei din pahar este acelas.Dupa un timp, lichidul se urca in
tubul palniei la o inaltime "h", la care presiunea hidrostatica
a coloanei de lichid devine egala cu presiunea osmotica a solutiei
(presiunea cu care apa prunde in palnie prin membrana semipermeabila. Deci
inaltimea "h" este o masura a presiunii osmotice. Daca
osmometrul este legat cu un manometru, se poate citi direct presiunea
osmotica
In palnie se
pune o solutie de zahar si se introduce totul intr-un pahar cu
apa. La inceput, nivelul solutiei de zahar din palnie si al
apei din pahar este acelas.Dupa un timp, lichidul se urca in
tubul palniei la o inaltime "h", la care presiunea hidrostatica
a coloanei de lichid devine egala cu presiunea osmotica a solutiei
(presiunea cu care apa prunde in palnie prin membrana semipermeabila. Deci
inaltimea "h" este o masura a presiunii osmotice. Daca
osmometrul este legat cu un manometru, se poate citi direct presiunea
osmotica
Mecanismul osmozei poate fi inteles daca se tine seama de tendinta substantei dizolvate de a se repartiza uniform in intregul volum de solvent disponibil, sau de tendinta oricarei solutii de a se dilua. Acesta se poate compara cu expansiunea unui gaz in intreg spatiul care-i sta la dispozitie. Din acest punct de vedere, solutiile diluate de neelectroliti se comporta asemanator cu gazele ideale.
Se poate defini presiunea osmotica a substantei dizolvate ca fiind egala cu presiunea pe care ar avea-o acea substanta daca s-ar afla in stare gazoasa la aceeasi temperatura si in acelas volum in care se gaseste solutia.
Legile presiunii osmotice - van't Hoff.
Pentru solutii diluate, presiunea osmotica urmeaza aceleasi legi ca si gazele ideale. Astfel, legea generala a gazelor devine, pentru solutii:
π V = nRT dar n/V = c (concentratia molala);
deci:
π = cRT
Solutii izotonice sunt solutiile care au aceeas presiune osmotica.
Fenomenele osmotice sunt extrem de importante in celulele vii : protoplasma celulelor este o membrana semipermeabila pentru anumite substante. Plasma sanguina este o solutie izotonica cu lichidul din interiorul celulelor rosii. Serul fiziologic (solutie 0,86% NaCl) este izotonic cu plasma sanguina.
Solutii de electroliti. Disociatia electrolitica.
Solutiile ideale sunt cele care se conformeaza legilor lui Raoult si van't Hoff.
S-au constata insa abateri importante si sistematice de la legole solutiilor ideale, la solutiile de acizi, baze si saruri denumite solutii reale. Astfel valorile Δp, Δtf, Δtc si π masurate pentru aceste solutii, sunt sistematic mai mari decat valorile calculate dupa legile solutiilor ideale. Valorile reale si cele calculate se afla intr-un raport constant, notat cu "i". Astfel vom avea:
i = Δpr/ Δp = Δtfr/ Δtf = Δtcr/ Δtc = πr/ π
coeficientul "i" se numeste factorul lui van't Hoff sau coeficient izotonic.
Aplicand corectia cu factorul lui van't Hoff, legile solutiilor ideale se pot aplica si celorlalte solutii:
Δpr = i . Δp = i.p0.x2
Δtfr = i. Δtf = i.E .b
Δtcr = i . Δtc = i. K .b
Πr = i . π = i . c.RT
S-a constatat experimental ca factorul "i" creste cu dilutia, tinzand, la dilutie infinita, spre valori numere intregi:
i = 2 pentru NaCl, KCl, KNO3, etc (formate din 2 ioni)
i = 3 pentru Na2SO4, MgCl2, etc (formate din 3 ioni)
i = 4 pentru AlCl3, FeCl3, etc (formate din 4 ioni)
La dilutii mai reduse, adica la concentratii mai mari, valorile lui "i" sunt inferioare celor de mai sus dar tind cu dilutia spre valori intregi.
Aceste abateri se pot explica numai prin existenta in solutiile acizilor, bazelor si sǎrurilor, a unui numar mai mare de particule decat numarul de molecule initiale dizolvate.
Teoria disociatiei electrolitice - Svante Arrhenius (1887)
Conform acestei teorii, moleculele acizilor, bazelor si sarurilor prin dizolvare in apa se disociaza in ioni:
NaCl → Na+ + Cl-
La substantele cu legaturi ionice, ionii nu se formeaza in momentul dizolvarii, ci preexista in reteaua cristalina, iar dizolvarea in apa are ca efect doar separarea acestor ioni care vor circula liber in solutie.
Substantele cu molecule polare, se pot insa disocia in ioni prin dizolvare in apa, datorita moleculelor polare ale apei si constantei dielectrice mari. Solutiile acestor substante conduc curentul electric, de aceea au fost numite electroliti. Acestia sunt conductori electrici de ordinul II deoarece transportul curentului se face prin ioni, avand loc si un transport de masa.
Disociatia electrolitica este un proces de echilibru, care depinde de concentratia solutiei si de temperatura. In general, cu cat dilutia este mai mare, cu atat numul moleculelor disociate este mai mare, si invers.
Prin masurarea conductibilitatii electrice a unui mare numar de electroliti in solutie apoasa, s-a constatat ca acestia pot fi impartiti in doua categorii:
electroliti tari - la care conductibilitatea este ridicata si variaza putin cu concentratia. In aceasta categorie intra sarurile, acizii tari (HCl, HNO3, H2SO4, etc) si bazele tari (NaOH, KOH, etc).
electroliti slabi - care au conductibilitate redusa in solutii concentrate, dar creste foarte mult cu dilutia. Exemple: acizii slabi: CH3COOH, H2S, H2CO3, acizii organici; baze slabe: NH4OH, bazele organice (aminele).
Aceasta clasificare nu este riguroasa, exista si termeni de tranzitie.
In realitate electrolitii tari sunt substantele cu legaturi ionice, a caror ioni preexista in reteaua cristalina, deci in solutie ar trebui sa fie practic total disociati.
Electrolitii slabi sunt de obicei substante cu molecule polare (retele moleculare) care disociaza in ioni numai in momentul dizolvarii. Teoria disociatiei electrolitice se aplica riguros numai electrolitilor slabi.
Coeficientul izotonic "i" se poate defini ca raportul dintre numarul total de particule din solutie si numarul de molecule dizolvate.
Se defineste gradul de disociere "α"raportul dintre numul de molecule disociate si numul total de molecule dizolvate.
Daca intr-o solutie sunt dizolvate N molecule, dintre acestea N sunt disociate in cate "ni" ioni si raman (1- )N molecule nedisociate. Numarul ionilor formati este ni.N. Astfel se poate exprima coeficientul "i":
i = ni.N + (1- ) N / N = (ni-1) + 1 de unde:
α = i - 1/ ni - 1 ni - numarul de ioni in care disociaza o molecula
Gradul de disociere creste cu dilutia si cu temperatura, in cazul electrolitilor slabi si mijlocii. Se observǎ cǎ dacǎ α = 1, adicǎ disociatia este totalǎ i = ni.
La electrolitii tari, gradul de disociere ar trebui sa fie egal cu 1 [100%], deoarece substanta este ionica. In realitate, mai ales in solutii mai concentrate, se gaseste < 1. Aceasta datorita interactiunilor care au loc in solutie intre ionii de semn contrar, mai ales la concentratii mai mari, cand unii dintre ioni pot intra in sfera de actiune a altora, si solutia se comporta ca si cand disocierea nu ar fi totala. Gradul de disociere determinat in aceste conditii se numeste grad de disociere aparent, si este mai mic decat 1 [<100%]. Teoria electrolitilor tari este insa mult mai complexa si apartine lui Debye - Huckel.
Reactia de disociere pentru electrolitii slabi este o reactie de echilibru intre ioni si moleculele nedisociate:
![]() CA C+ + A-
CA C+ + A-
Acestei reactii i se poate aplica legea actiunii maselor
Kd = [C+ ] [A- ] / [CA]
Kd - este constanta de disociere
Se poate deduce relatia dintre constanta de disocier si gradul de disociere, considerand concentratia solutiei "c" , iar gradul de disociere . Concentratia ionilor
[C+] , respectiv [A-] , va fi α. c, iar concentratia moleculelor nedisociate, [CA] va fi (1- ).c . Inlocuind in relatia constantei de disociere, obtinem:
Kd = α2.c/(1- α) - legea dilutiei lui Ostwald
Disociatia apei. Notiunea de pH.
Apa in stare pura conduce foarte putin curentul electric, deci este foarte putin disociata.
![]() H2O H+ + OH-
H2O H+ + OH-
sau
![]() 2H2O H3O+ + OH-
2H2O H3O+ + OH-
Ionul H3O+ este ionul de hidrogen hidratat si se numeste hidroniu sau hidroxoniu. In realitate in apa nu exista ioni de hidrogen liberi ci numai sub forma hidratata.
Constanta de disociere a apei va fi:
K = [ H+] [OH-] / [H2O]
Gradul de disociere al apei fiind foarte mic, practic concentratia moleculelor de apa nedisociate este constanta si poate fi inglobata in valoarea constantei de echilibru:
K . [H2O] = Kw = [ H+] [OH-] = 10-14
Kw poarta numele de produs ionic al apei si este o costanta, avand valoarea de 10-14 la temperatura de 18°C, in apa pura. De aici rezulta ca, in apa pura:
[ H+] = [OH-] = 10-7
Pentru a exprima mai usor concentratia ionilor de hidrogen din solutii, s-a definit notiunea de pH sau exponent de hidrogen: logaritmul zecimal, cu semn schimbat, al concentratiei ionilor de hidrogen:
pH = -log [ H+]
pH-ul poate deci lua valori de la 0 la 14 - scala de pH. Cand concentratia ionilor de hidrogen intr-o solutie creste, concentratia ionilor OH- scade, si invers, produsul ionic al apei ramanand constant.
In apa pura vom avea: pH = -log 10-7 = 7 - pH neutru
solutii acide neutru solutii bazice
pH-ul se determina experimental de obicei cu ajutorul indicatorilor de pH. Acestia sunt substante organice care isi schimba culoarea in functie de pH, fapt datorat unei modificari structurale. Exemple: fenolftaleina (incolor in mediu acid, rosu - violet in mediu bazic), metiloranjul (rosu - portocaliu in mediu acid, galben in mediu bazic), turnesolul (rosu - albastru), etc. Exista si amestecuri de indicatori impregnati pe benzi de hartie, pe domenii de pH, sau indicatorul universal, pentru intreaga scala de pH. Indicatorii sunt utilizati si in titrarile acido - bazice, pentru determinarea punctului de echivalenta (a sfarsitului titrarii).
Determinarea precisa a pH-ului se face prin metode electrochimice (metoda potentiometrica), utilizand electrozi speciali indicatori de pH (electrodul de sticla, electrodul de chihidrona).
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Lucrari pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








