
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Determinarea energiei de activare Arrhenius - reactia tiosulfatul de sodiu cu acidul sulfuric |
Determinarea energiei de activare Arrhenius - reactia tiosulfatul de sodiu cu acidul sulfuric
Determinarea energiei de activare
Scopul lucrarii.
Se va determina energia de activare Arrhenius pentru reactia dintre tiosulfatul de sodiu si acidul sulfuric.
Introducere.
Influenta temperaturii asupra vitezei de reactie este descrisa de relatia lui Arrhenius, care cu un numar mic de exceptii (relatiile: "anti-Arrhenius"), are valabilitate generala:
![]() (1)
(1)
S-au notat cu: A, factorul de frecventa care depinde de numarul de ciocniri dintre molecule; R, constanta universala a gazelor ideale, R = 8,314 J/mol.K (in S.I.) sau 1,987 cal/mol.K (in sistemul tolerat); T, temperatura absoluta; Ea, energia de activare este surplusul de energie, peste valoarea medie a moleculelor active, care participa la reactia chimica.
Pentru reactia dintre tiosulfatul de sodiu si acidul sulfuric:
![]() (2)
(2)
viteza de reactie este:
vR = 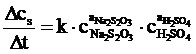
![]() (3)
(3)
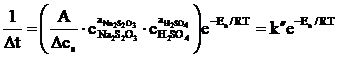 (4)
(4)
![]() este constanta aparenta a vitezei de reactie.
este constanta aparenta a vitezei de reactie.
Prin logaritmare rezulta
![]() (5)
(5)
care reprezinta ecuatia unei drepte cu panta Ea / R si ordonata la
origine ![]() .
.
Aparatura si substante.
Biurete, eprubete, termometru, bec de gaz si sita de azbest. Solutii de tiosulfat de sodiu, Na2S2O3 si de acid sulfuric, H2SO4.
Modul de lucru
In 5 eprubete numerotate de la 1 la 4 se introduc cate 5 ml solutie N2S2O3, masurati cu biureta.
In alte 4 eprubete numerotate de la 5 la 8 se introduc cate 5 ml solutie H2SO4, masurati cu biureta.
Cele 8 eprubete se introduc intr-un pahar Berzelius care contine apa si in care se gaseste un termometru.
Se masoara temperatura apei T1.
Se toarna continutul eprubetei 5 (care contine acid sulfuric) peste eprubeta 1 (care contine tiosulfat de sodiu), se agita si se masoara timpul t scurs de la amestecarea solutiilor pana cand solutia incepe sa se tulbure.
Paharul care contine eprubetele se incalzeste pe un bec de gaz la temperatura T2 = T1 + 10oC.
|
Cand se atinge aceasta temperatura se procedeaza la fel ca in primul caz, amestecand continutul eprubetelor 2 si 6 si notand t.
Pe rand se masoara t pentru urmatoarele reactii procedand la fel cu perechile de eprubete 3-7 si 4-8.
Observatii: - In fiecare experiment, timpul final de reactie se considera cand solutia incepe sa se tulbure, deci la aparitia opalescentei.
Timpul de reactie se masoara cu precizie.
Rezultate si calcule. Se intocmeste urmatorul tabel cu datele experimentale
obtinute.
|
Nr. Eprubetei |
Temperatura, T |
t s |
ln (t) |
1/T K-1 |
|
|
oC |
K |
||||
|
|
|
|
|
|
|
Se reprezinta grafic lnt = f(1/T), tinand seama de informatiile privind intocmirea unui grafic
Din panta dreptei se calculeaza energia de activare.
Interpretarea rezultatelor. Se verifica dependenta vitezei de reactie de temperatura, conform reactiei lui Arhenius. Se constata daca valoarea energiei de activare corespunde unei reactii chimice activate termic, adica este de ordinul zecilor de mii de calorii.
Tema de casa
La temperatura de 7000C, constanta de vitezaa descompunerii termice a toluenului este k= 10-4s-, iar factorul preexponential A= 2 1013s-1. Se cere: a) calculul energiei de activare a procesului;b) valoarea constantei de viteza la temperatura de 6500C; c) la ce temperatura constanta de viteza se dubleaza.
Constanta de viteza a unei reactii de ordinul 2 la 1270C este 0,5 mol-1s-1, iar energia ei de activare este de 10kcal. Cu cat trebuie sa creasca temperatura pentru ca constanta de viteza sa creasca de 10 ori?
Pentru reactia de descompunere a acidului iodhidric in faza gazoasa, se cunosc: k536k= 3,517 10-7l/mol s si k781k= 3,954 10-2l/mol s. Calculati energia de activare a procesului.
Sa se calculeze de cate ori se mareste constanta de viteza la ridicarea temperaturii de la 20 la 300C, daca energia de activare este E = 30000cal/mol. Ce marire se obtine pentru o ridicare a temperaturii de la 20 la 1200C?. Se considera factorul preexponential independent de temperatura.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








