
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Sulful - procese naturale de transformare a compusilor sulfului, influenta activitatii umane asupra cresterii concentratiei bioxidului de sulf in atmosfera |
Sulful - procese naturale de transformare a compusilor sulfului, influenta activitatii umane asupra cresterii concentratiei bioxidului de sulf in atmosfera
Sulful
Abundenta: Pamant 1,8-2,9%; Crusta-260 ppm; Ocean-905ppm; Atmosfera-0,6ppb.
Dupa valoarea concentratiei sulfului in pamant se intelege ca cel mai mult sulf este continut in mantaua interna si nucleu.
1. Procese naturale de transformare a compusilor sulfului
Exista o puternica analogie intre sulf si azot in ceea ce priveste modul in care microorganismele influenteaza ciclurile lor biogeochimice. Fiecare element tinde sa fie prezent in organismele vii, sub forma redusa; azotul (N-3) reprezentat prin grupul amino (NH2-) si sulful (S-2) reprezentat prin grupul hidrosulfidic (SH-). Sulful este un constituent secundar important al aminoacizilor si a proteinelor. Capacitatea acestui sulf de a forma legaturi S-S permite legatura incrucisata in proteine prin asa numitele legaturi disulfidice. Pot fi legaturi intermoleculare al proteinelor adiacente si astfel se dezvolta structuri la scara larga (parul si unghiile) si legaturi intramoleculare specifice proteinelor (de exemplu enzimelor). Cand compusii organici ai sulfului sunt descompusi de catre bacterii produsul initial de sulf format este, H2S (ec. 1)
R-SH H2S+RH (1)
hidrosulfura compus
organica organic
Compusii fitoplanctonului marin se descompun cu formarea sulfurii dimetil (CH3)2S. Sulfura dimetil este compusul major de sulf produs biogenic eliberat din oceane. Hidrogenul sulfurat (H2S) este compusul cel mai important terestru si al mediilor sarate-mlastinoase. Sulfura dimetil ca si hidrogenul sulfurat sunt rapid oxidate cu formarea bioxidului de sulf si apoi ca sulfat (ec.2):
+O2 +O2
H2S (S) SO2 SO3 SO42- (2):
Unele microorganisme in mal produc sulf elementar.
Oxidarea formelor reduse de sulf de catre oxigen (ec. 2) poate sa apara fiecare prin actiunea microorganismelor in sol, sedimente si in coloana de apa sau fara control biologic, in atmosfera.
Reactia incompleta pentru reducerea sulfatului (ec.3) este energetic nefavorabila:
SO42- + 9H+ + 8e- HS- + 4H2O (3)
Aceasta reactie realizata de microorganisme si combinarea ei cu reactia incompleta de oxidare a carbohidratilor este total negativa din punct de vedere al energiei libere, conducand la reducerea sulfatului (ec. 4):
SO42- + H+ + 2CH2O HS- + 2H2O + 2CO2 (4)
Sulfatul actioneaza ca si acceptor de electroni si oxidarea carbohidratilor este produsa. Energia eliberata este obtinuta cand oxigenul actioneaza ca si acceptor de electroni in respiratia aeroba (ec. 5):
CH2O + O2 CO2 + H2O (5):
Nitratul poate de asemenea sa actioneze ca si acceptor de electroni (ec. 6):
2CH2O + NO3- + 2H+ 2CO2 + H2O + NH4+ (6)
Reactia (6) elibereaza de trei ori mai multa energie decat reducerea sulfatului (ec.4) dar reducerea sulfatului produce energie mult mai mica decat este obtinuta prin reactia de fermentatie cu producerea metanului (ec. 7):
2CH2O CH4 + CO2 (7)
Cea mai mare cantitate de energie care se obtine prin respiratie aeroba se afla in carbohidrati. Cand stocul de oxigen (O2) devine insuficient conditiile devin anaerobe si reducerea nitratilor devine mult mai favorabila.
Formarea hidrogenului sulfurat (H2S) este o trasatura caracteristica a sedimentelor marine datorita nivelelor ridicate de sulfati din apa marii. In sol unde nivelele de nitrat sunt adesea mai inalte decat nivelele de sulfat, amoniacul este produs in conditii anaerobe. Cand concentratiile sulfatului sunt foarte scazute bacteriile metan devin foarte dominante.
|
Hidrogenului sulfurat (H2S) este produs ca si gaz in atmosfera unde este oxidat (ec. 8) sau poate reactiona cu ionii metalici in sedimente sau in solutii apoase formand sulfuri insolubile.
2Fe(OH)3 + 3H2S 2FeS (troilit)+ S + 6H2O (8)
FeS + S FeS2 (pirita)
Culoarea neagra a multor sedimente se datoreaza prezentei sulfurilor de fier precum si a materiei organice. Asocierea sulfurilor, in special a piritei, cu depozite sedimentare (calcare negre si carbuni) bogate in materie organica pot conduce la medii acide cand acestea sunt in contact cu atmosfera Pamantului. De asemenea medii acide pot fi generate prin arderea sulfurilor sau prin activitate miniera. Pot fi expuse prin arderea sau minerit:
FeS2 + O2 + H2O FeSO4 + H2SO4 (9)
Din reactia (9) prezenta acidului sulfuric (H2SO4) creeaza o solutie acida ce traverseaza roci, soluri, ape, care favorizeaza solubilitatea multor metale si levigarea lor, ceea ce duce la cresterea elementelor toxice in solutiile apoase ce favorizeaza concentratii a metalelor in plante.
2. Influenta activitatii umane asupra cresterii concentratiei bioxidului de sulf in atmosfera
Bioxidul de sulf (SO2) este introdus in atmosfera pe cale naturala, prin activitate vulcanica si din surse generate prin activitatea umana. Cantitatea de SO2 produsa de catre surse antropogenice in 1990 a fost estimata a fi de 156 milioane tone comparativ cu 52 milioane tone din surse naturale. In emisfera nordica bioxidul de sulf (SO2) antropogenic totalizeaza 140 milioane tone in timp ce sursele naturale totalizeaza numai 30 milioane tone, (P. O'Neill, 1993). Aceasta diferenta intre emisfera nordica si sudica reflecta proportiile mai ridicate a maselor de pamant si datorita tarilor dezvoltate care utilizeaza cantitati mari de combustibili fosili.
Bioxidul de sulf in atmosfera este oxidat prin variate mecanisme care includ interactiunea cu gaz-gaz, numita oxidare omogena (nu exista diferente de faze) (ec. 10):
O2 NO H2O
HO- + SO2 HSO3- HSO5- HSO4- + NO2 H2SO4 + HNO3 10)
Reactiile apar in solutie in prezenta sau in absenta agentilor catalizatori (numite oxidare eterogena daca exista faze diferite intre reactanti (ec.11a si b):
SO2 (aq) + O3 (g) SO3 (aq) + O2 (g) H2SO4 (11a)
SO2 (aq) + H2O2 (aq) SO3 (aq) + H2O H2SO4 (11b)
Ca si catalizator, cel mai eficace pare sa fie manganul.
Succesiunea reactiei (10) implica un numar de radicali liberi (HO-, HSO3-, HSO5-, HSO4-) toate fiind specii care contin o sarcina negativa. Radicalii liberi pot fi formati in atmosfera printr-un numar mare de reactii, de obicei reactii de fotoliza, in care o legatura covalenta este rupta prin absorbtia radiatiilor solare. O parte din razele ultraviolete a spectrului solar este portiunea implicata (ec. 12):
U.V.
O3 O2 + O 2HO- (12)
↓ 310 nm atom radical
ozon de hidroxil
oxigen liber
excitat
In functie de cantitatea de umezeala din atmosfera, 20-80% din bioxidul de sulf emis in aer este oxidat la sulfat si numai cantitati urma sunt indepartate de catre depunerile uscate (Fig. 6.8). Sulfatul are o viteza de depunere relativ unica si cel mai mult este indepartat prin depunere umeda (Fig 6.8). Bioxidul de sulf si sulfatul amestecate au in medie timp de stationare de la doua la sase zile in atmosfera, timp in care poate strabate 4000 km de la sursa. Depunerea uscata implica fixarea compusilor sulfului mai mult pe suprafete umede cum ar fi pe vegetatie, constructii umede, sol si corpuri de apa. Depunerea umeda implica indepartarea de catre ploaie sau zapada si este numita "precipitatie maturator". Materialul intrat in nori este eliminat prin precipitatii, iar materialul de sub nori este indepartat prin spalare.
Mecanismul actual de dispersie al SO2 este foarte complicat si depinde de mai multi factori: conditiile climatice, geografice, cosuri inalte. Cosurile inalte duc la dispersarea SO2 la sute de km inaintea dispersarii. Cosurile foarte mici, ale caselor, sunt nesemnificative in dispersarea compusilor sulfului. Valorile medii variaza intre diferite arii ale unei tari si in diferite perioade. Variatia zilnica este mai mare de 50 de ori decat variatia anuala. Variatiile scurte sunt datorate mai mult schimbarilor conditiilor meteorologice.
Concentratia mai mare de SO2 este in orasele mari si mult mai redusa in ariile rurale (unde poate fi doar 10-20% din valorile centrelor urbane). Extinderea ploilor acide creste pentru ca utilizarea cosurilor inalte cauzeaza dispersarea oxizilor de sulf si de azot.
Ploaia normala are un pH de 5,6 cand este in echilibru cu CO2 din atmosfera. Daca pH-ul scade sub 5,6 ploaia devine acida. Sensibilitatea ecosistemului la ploaia acida depinde de cantitatea de acid depozitat, de capacitatea rocilor, a solurilor si a apei de a neutraliza aciditatea si de rezistenta organismelor vii la unele schimbari. Efectul ploilor acide, a emisiilor de SO2 sunt foarte variate. Nivele de SO2 peste 500 mgm-3 afecteaza sanatatea oamenilor care sufera de astm si bronsita. Cresterea aciditatii apelor conduce la cresterea dizolvarii metalelor.
Sulful este un compus nutritiv esential pentru agricultura intensiva. Arborii padurilor au nevoie de cantitati mici de sulf, ca si compusi, in special ai celulozei, existand unele arii in care sulful a fost raportat ca factor de crestere pentru copaci. Padurile sunt mult mai sensibile la poluarea prin ploi acide pentru ca acestea cresc pe soluri sarace din care sunt indepartate metalele esentiale (magneziu si potasiu) si creste mobilitatea metalelor toxice cum ar fi Al, Pb, Zn, Cu.
Cresterea nivelelor de metale toxice in soluri va duce la cresterea nivelelor (concentratiilor) de metale toxice in rauri si lacuri care au efect asupra reducerii populatiilor de peste. Molustele si crustaceele sunt mult mai sensibile decat pestii, rar supravietuiesc la pH sub 6.
Constructiile de piatra contin carbonati de calciu si magneziu si sunt atacate de ploile acide cu formarea sulfatilor solubili:
CaCO3(s) + H2SO4(aq) Ca2+(aq) + SO42-(aq) + H2O + CO2(g)
Prezenta oxizilor de fier alaturi de componentii constructiilor din piatra (calcar, marmura - CaCO3) duce la dizolvarea acestora in apele acide:
Fe2O3(s) + 3H2SO4(aq) 2Fe3+(aq) + 3SO42-(aq) + 3H2O(l)
Bioxidul de sulf (SO2) reactioneaza mult mai incet in conditii uscate dar rezultatul este acelasi. Prezenta in atmosfera a SO2, NOx si ploile acide conduc la cresterea coroziunii structurilor metalice (poduri), motoarelor vehiculelor.
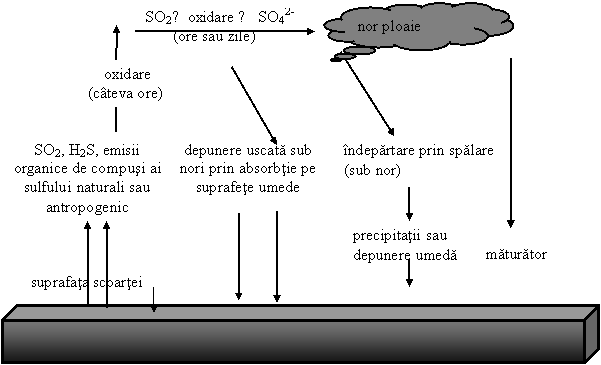
Fig. 6.8 Mecanismul prin care SO2 si produsii sai oxidati sunt indepartati din atmosfera, (O`Neill, P. 1993).
3. Ciclul sulfului
Ciclul sulfului la suprafata Pamantului a crescut o data cu inceputul revolutiei industriale prin cererea de combustibili, metale si fertilizatori. Se poate vorbi de mai multe fluxuri in ciclul sulfului, (Fig.6.9).
Activitatea de extractie a metalelor, arderea combustibililor fosili favorizeaza producerea unor cantitati mari de oxizi de sulf care sunt eliberati in atmosfera. Efectele antropogenice au condus la cresterea starii de oxidare pentru sulf, in timp ce ciclul natural biologic al sulfului are componenti in care starile oxidate sunt reduse. Pentru ciclul sulfului importante sunt rezervoarele din crusta.
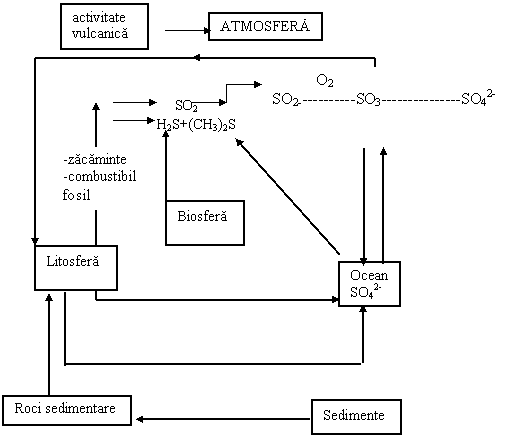
Fig.6.9. Ciclul sulfului
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Analize pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








