
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Fizica
|
|
Qdidactic » didactica & scoala » fizica Termodinamica - clasificarea proceselor termodinamice, transformarile gazului ideal |
Termodinamica - clasificarea proceselor termodinamice, transformarile gazului ideal
Termodinamica
Def Se numeste fenomen termic orice fenomen fizic legat de miscarea permanenta,cpmplet dezordonata si dependenta de temperatura,care se manifesta la nivel molecular(agitatia termica).
Termodinamica studiaza din punct de vedere energetic proprietatile generale ale substantelor si legile care guverneaza miscarea termica, fara a se tine seama de natura miscarilor si interactiilor moleculare.
Metodele termodinamicii nu au la baza niciun model de reprezentare atomo-moleculara a substantei si din acest motiv termodinamica este o stiinta fenomenologica.
In cadrul termodinamicii se stabilesc relatii intre marimi direct observabile, adica intre marimi masurabile in experiente macroscopice, cum ar fi volumul, presiunea, temperatura, concentratia solutiilor, intensitatea campului electric si magnetic, etc.
Termodinamica opereaza cu o serie de notiuni si marimi, cu ajutorul carora se defineste orice proces sau fenomen termic. Una dintre acestea este notiunea de sistem termodinamic.
Sistemele termodinamice pot fi:
- izolate daca sistemul termodinamic nu sufera nicio interactiune cu mediul inconjurator;
- neizolate,daca interactioneaza cu mediul exterior
- inchise, daca exista interactiuni cu mediul inconjurator, dar nu exista schimb de substanta intre sistem si mediul inconjurator;
- deschise, daca sistemul schimba si substanta cu mediul inconjurator.
Starea
unui sistem termodinamic poate
fi complet caracterizata printr-un numar finit de parametrii,
numiti parametrii de stare.
Parametrii de stare reprezinta
valorile instantanee ale marimilor fizice ce caracterizeaza atat
sistemul considerat cat si interactiunile dintre sistem si
mediul inconjurator.
Parametrii de stare ai unui sistem pot fi:
- intensivi -care pot avea valori diferite in puncte diferite ale sistemului(presiunea,temperature,densitate)
- extensivi -care pot caracteriza sistemul termodinamic ca ansamblu si nu se pot defini intr-un punct dat(masa,volumul,cantitatea de substanta,energia interna)
- de pozitie(volumul)
- de forta(presiunea)
Agitatia termica-este miscarea permanenta si dezordonata a particulelor oricarui corp si e mai intensa la temperature mari
Caracteristici
1)este spontana, adica are loc de la sine,nu este produsa de o cauza externa
2)nu inceteaza niciodata
3)creste in intensitate cu cresterea temperaturii
Difuzia-este raspandirea spontana a particulelor unui corp printer particulele altui corp.Acesta este determinate de agitatia termica si este mai intense la temperature mari.
Obs- difuzia se intensifica odata cu cresterea temperaturii.
Experimental,se constata ca:
a)difuzia se realizeaza mai rapid cand creste temperature
b)gazelle difuzeaza mai rapid decat lichidele,iar acestea mai rapid decat solidele
c)substantele cu molecule mai mici difuzeaza mai repede decat cele cu molecule mai mari.
Caldura (Q)-este forma de transfer a energiei intre corpuri aflate in contact termic datoritadiferentei de temperature.Unitatea de masura in sistemul international este Joule
Capacitatea calorica (c) -reprezinta caldura necesara unui corp pentru a-si mari sau micsora temperature cu un grad
C=Q/ΔT ; Q- CALDURA
ΔT-VARIATIA TEMPERATURII
[C] =1J/K
Caldura specifica(c)-reprezinta caldura necesara unitatii de masa dintr-un corp pentru a-si marii sau micsora temperature cu un grad
c=Q/m ΔT ; Q-caldura
m-masa corpului
ΔT- variatia temperaturii
[c] =1J/kg K
Legatura dintre capacitatea calorica si caldura specifica: C = m c
Caldura molara (Cμ)-reprezinta caldura necesara unui mol de substanta pt a-si mari sau a-si micsora temperature cu un grad.
Cμ=Q/υ ΔT ; υ- CANTITATEA DE SUBSTANTA
[ Cμ] =J/mol K ; Cμ=c μ
Temperatura- are ca unitate de masura Kelvin(K).Alta unitate de masura a temperaturii este gradul Celsius.Valoarea numerica a temperaturii absolute exprimata in Kelvin(notata cu T) este 273,15mai mare decat valoarea numerica a temperaturii exprimata in grade Celsius
T= t + 273,15
O variatie a temperaturii are aceiasi valoare in grade Celsius sau in Kelvin.
Molul reprezinta cantitatea de substanta a unui sistem care contine atatea entitati elementare cati atomi sunt in 0,012 kg de carbon 12. Simbolul pentru aceasta unitate de masura este 'mol' (nu se schimba la plural). Termenul mol este atribuit chimistului german Wilhelm Ostwald, cunoscut pentru lucrarile sale in domeniul catalizei, echilibrului chimic si al vitezei de reactie.
|
Cantitatea de substanta care se masoara in moli (valoarea uni mol =6,0221415(10).-1023)
Masa moleculara-reprezinta masa unei molecule.
[m ] =kg
Masa moleculara relativa arata de cate ori este mai mare masa unei molecule decat unitatea atomica de masa.
m = ; [m ] =1 (marime adimensionala)
m =m u
Cantitatea de substanta(υ)
-este o marime fizica fundamentala in sistemul international
-nu se confunda cu masa care reprezinta o masura a inertiei corpului
[ν] =mol
Masa molara (μ)-miu
μ = m/ υ ; μ=masa molara
m= masa sistemului
υ= cantitatea de substanta
Ecuatia unitatii de masura
[μ] =[m] /[ υ] =1 kg/mol
Volumul molar (V ) -reprezinta volumu unui mol de substanta
V = V/ υ ;V =volumu molar
V= volumul sistemului
υ =cantitatea de substanta
Ecuatia unitatii de masura
[ V ] = [V] /[υ] =1 m /mol
Obs- la lichide si la solide volumul molar depinde de natura substantei si foarte putin de temperature si presiune.
Pentru gaze volumul molar nu depinde de substanta ,dar depinde de temperature si presiune.
ρ = μ/V
Numarul lui Avogadro (N )
Def:Constanta lui Avogadro exprima numarul de entitati elementare dintr-un mol de substanta.
N =N/υ ;N=nunarul de entitati elementare din sistem
Ecuatia unitatii de masura
[N ] =molecule/mol= mol
Numarul volumic(n) -reprezinta numarul de entitati elementare din unitatea de volum
n=N/V
[n] =m
Lucrul mecanic- este o marime fizica definita ca produsul dintre componenta fortei care actioneaza asupra unui corp in directia deplasarii punctului ei de aplicatie si marimea acestei deplasari.
L= F d ; [L] =1J (joule)
Lucrul mecanic efectuat asupra mediului exterior este pozitiv ,lucrul mecanic efectuat supra sistemului termodinamic este nagativ.
L >0 daca ΔV>0
L <0 daca ΔV<0
L =0 daca ΔV=0
Efectuarea unui lucru mecanic asupra unui (respectiv, de catre un) sistem fizic duce la modificarea energiei sistemului cu o cantitate egala cu lucrul mecanic efectuat asupra sistemului (respectiv, de catre sistem). Unitatea de masura pentru lucru mecanic in Sistemul International este Joule-ul, avand simbolul J.
Pentru o forta constanta ![]() care
isi deplaseaza punctul de aplicatie dupa un segment de
dreapta
care
isi deplaseaza punctul de aplicatie dupa un segment de
dreapta ![]() , lucrul mecanic efectuat L este egal cu produsul scalar:
, lucrul mecanic efectuat L este egal cu produsul scalar:
![]()
unde α este unghiul dintre directia fortei si directia de deplasare. Lucrul mecanic este pozitiv daca punctul de aplicatie se deplaseaza in acelasi sens cu forta (α<90°), negativ daca punctul de aplicatie se deplaseaza in sens invers fortei (α>90°) si nul daca punctul de aplicatie este fix sau se deplaseaza perpendicular pe directia fortei (α=90°).
In cazul general, lucrul mecanic este definit ca o integrala curbilinie:
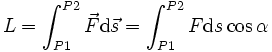
unde ![]() este
vectorul de pozitie al punctului de aplicatie al fortei, iar P1 si P2 sunt pozitiile initiala si finala
ale deplasarii.
este
vectorul de pozitie al punctului de aplicatie al fortei, iar P1 si P2 sunt pozitiile initiala si finala
ale deplasarii.
Energia interna (U)
U = E + E
- este suma dintre energia cinetica a moleculelor datorata agitatiei termice si energia potentiala a moleculelor datorata interactiunii dintre moleculele care alcatuiec gazul.
Randamentul motoarelor termice-este eficienta transformarii caldurii in lucru mechanic si este exprimata prin randamentul motorului termic.In mod analog randamentului mecanic,cel termic reprezinta raportul dintre lucrul mecanic efectuat de system si caldura absorbita de la sursa calda.
Randamentul unui motor termic este intodeauna subunitar.
Clasificarea proceselor termodinamice
Procesele termodinamice consta in trecerea a unui sistem termodinamic dintr-o stare in alta.
Clasificarea
proceselor termodinamice se poate face din mai multe puncte de vedere.
a. Dupa marimea variatiei
relative a parametrilor de stare avem:
- procese diferentiale, pentru care variatia relativa a parametrilor de stare este foarte mica;
- procese finite, cand cel putin un parametru de stare sufera o variatie relativ mare.
b. Din punctul de vedere al naturii starilor intermediare:
- procese cvasistatice(de echilibru), in care starile intermediare pot fi considerate suficient de apropiate de starile de echilibru, in tot cursul procesului;
- procese nestatice, pentru care starile intermediare ale sistemului nu pot fi complet caracterizate din punct de vedere al termodinamicii.
proces cvasistatic-trecerea sstemului termodinamic la alta are loc prin stari intermediare de echilibru
.procescvasistatic-daca starile intermediare nu sunt de echilibru procesul termodinamic este necvasistatic.
Un
sistem termodinamic scos din
starea de echilibru, revine la starea initiala dupa un timp τ numit timp de relaxare.
Exista un timp de relaxare specific pentru fiecare parametru de stare.
Timpul de relaxare τ pentru sistemul
termodinamic reprezinta tipul de relaxare specific cel mai mare.
Daca intr-un sistem termodinamic procesele au loc cu viteze mai mici decat
viteza de relaxare ![]() ,
in orice etapa a procesului, parametrii de stare au valori care corespund
starii respective de echilibru si deci procesul este un proces
cvasistatic.
,
in orice etapa a procesului, parametrii de stare au valori care corespund
starii respective de echilibru si deci procesul este un proces
cvasistatic.
Procesele reale sunt nestatice, iar procesele cvasistatice sunt numai o
aproximatie a proceselor reale.
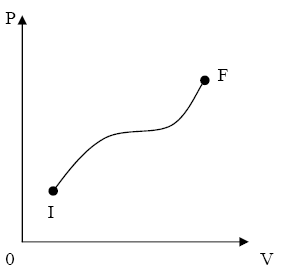
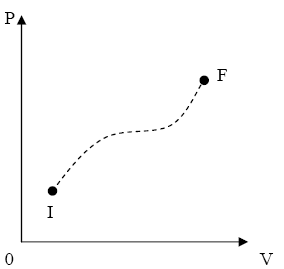
Procesele cvasistatice pot fi reprezentate pe o diagrama de exemplu p-V cu
ajutorul unei curbe continue intre starea initiala si starea
finala (fig.1), iar procesele nestatice nu pot fi reprezentate printr-o
curba (fig.2), deoarece in starile intermediare de neechilibru
parametrii de stare nu au o valoare unica pentru intregul sistem.
c. Din punct de vedere al trecerii sistemului din starea initiala I in starea finala F si invers avem:
- procese termodinamice reversibile, daca trecerea sistemului din starea I in starea F poate fi parcursa si invers exact pe acelasi drum.
Pentru realizarea unui astfel de proces, conditiile exterioare trebuie sa se modifice extrem de lent, astfel incat sistemul sa aiba timp sa se adapteze progresiv la noile variatii la care este supus treptat;
- procese termodinamice ireversibile in care prin trecerea din starea F in starea I nu se ating toate punctele curbei obtinute la trecerea din starea I in starea F.
In realitate nu exista procese reversibile. Procesul poate fi considerat reversibil daca starile intermediare in trecerea de la F la I sunt suficient de apropiate de starile intermediare obtinute prin trecerea de la I la F.
d. Dupa legatura dintre starea initiala si starea finala se disting:
- procese ciclice cand starea finala a sistemului coincide cu cea initiala;
- procese neciciclice (deschise), cand starea finala a sistemului difera de cea initiala.
e. dupa parametrii ce raman constanti in timpul unui proces termodinamic avem:
- procese izobare (P=constant)-in care presiunea ramane constanta
- procese izocore (V=constant)in care volumul ramane constant
- procese izoterme (T=constant)-in care temperature ramane constanta
- procese adiabatice (fara schimb de caldura cu exteriorul)-in care entropia ramane constanta
Transformarile gazului ideal
Nr crt. |
Denumirea |
Definitia |
Legea |
1) |
Transformarea generala |
υ =constant |
P V constant |
2) |
Transformarea izoterma |
υ=constant,T- Constant |
P V =constant |
3) |
Transformarea izobara |
υ=constant P= constant |
V T constant |
4) |
Transformarea izocora |
υ=constant V=constant |
P T constant |
Primul principiu al termodinamicii
Primul principiu al termodinamicii constituie o aplicare a legii conservarii energiei la procesele in care intervine miscarea termica a materiei, adica miscarea dezordonata a unui numar mare de particule (atomi, molecule etc.).
ΔU=Q-L -reprezinta ecuatia principiului 1 al termodinamicii
ΔU-variatia energiei interne
Q-caldura
L-lucrul mecanic
Legea Boyle-Mariotte este legea transformarii izoterme(t=constant) a unei cantitati constante(v=constant)de gaz ideal.
Se numeste proces izoterm orice process al unui sistem termodinamic inchis(v=constant) in care temperature ramane constanta.
Legea Gay-Lussac-este legea transformarii izobare p=constant a unei cantitati constante v=constant de gaz ideal.
Se numeste transformare izobara a unui sistem termodinamic inchis (v=constant) in care presiunea este mentinuta constanta.
Transformari de stare de agregare
Topirea si solidificarea
Topirea reprezinta fenomenul de trecere a unei substante din stare solida in stare lichida.
Solidificarea reprezinta fenomenul de trecere a unei substante din stare lichida in stare solida.
Experimental se constata ca:
a)topirea are loc cu absorbtie de caldura din exterior,iar solidificarea cu cedare de caldura in exterior.
b)in timpul topirii substantelor cristaline temperaturaramane constanta,la o valoare numita temperature de topire
c)substantele amorfe nu au o temperature precisa de topire:prin incalzire ele se inmoaie treptat si devin din ce in ce mai fluide,pe masura ce temperature lor creste.
Vaporizarea si condensarea
Vaporizarea este fenomenul de trecere a unei substante din stare lichida in stare de vapori.
Condensarea este fenomenul de trecere a unei substante din stare de vapori in stare lichida.
Experimental se constata ca:
a)vaporizarea are loc cu absorbtie de caldura din exterior,iar condensarea cu cedare de caldura in exterior
b)in timpul vaporizarii temperaturaramane constanta, la o valoare numita temperature de vaporizare
Principiul al doilea al termodinamicii
Principiul al doilea al termodinamicii precizeaza conditiile in care are loc transformarea energiei termice in energie mecanica. El are un caracter calitativ, arata sensul in care se produc spontan transformarile, fara sa se refere la cantitatile de energie schimbate. El este o particularizare a principiului general al schimburilor de energie, conform caruia transformarile spontane de energie se realizeaza de la potentialul mai inalt spre potentialul mai scazut.
Formularea Thomson:-al doilea principiu al termodinamicii afirma tocmai imposibilitatea transformarii integrale a caldurii in lucru mechanic in transformari ciclice monoterme reversibile.
Formularea Clausius-atunci cand sunt puse in contact termic doua corpuri cu temperaturidiferite,caldura trece de la sine,de la corpul mai cald la cel mai rece.
Principiul al treilea al termodinamicii
Al treilea principiu al termodinamicii a fost formulat mai intai de catre Walther Nernst in 1906 si a fost denumit 'teorema lui Nernst', iar apoi a fost reformulat de catre Planck. Principiul al treilea nu contine functii de stare, dar el face ca functiile de stare sa poata fi determinate numeric, si deci, sa poata fi utilizate in practica. Principiul al III-lea al termodinamicii se refera la modul cum se comporta entropia unui sistem in vecinatatea temperaturii de zero absolut:
'Cand temperatura absoluta a unui sistem tinde catre zero, entropia sa tinde catre o constanta universala, finita, care, pentru sistemele pure condensate, poate fi egala cu zero'.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Documente online pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








