| Aeronautica | Comunicatii | Drept | Informatica | Nutritie | Sociologie |
| Tehnica mecanica |
Tehnica mecanica
|
|
Qdidactic » stiinta & tehnica » tehnica mecanica Bazele teoretice ale coroziunii metalelor |
Bazele teoretice ale coroziunii metalelor
BAZELE TEORETICE ALE COROZIUNII METALELOR
1. Coroziunea chimica
1.1. Coroziunea chimica in gaze uscate
1.2. Coroziunea chimica in lichide rele conducatoare de electricitate
2. Coroziunea electrochimica
2.1. Mecanismul coroziunii electrochimice
2.2. Elementul galvanic
2.3. Tensiunea absoluta de electrod la echilibru
1. Coroziunea chimica se produce datorita afinitatii dintre materialele metalice sau nemetalice si unele:
gaze uscate: oxigen, hidrogen, hidrogen sulfurat, acid clorhidric gazos, oxid de carbon, dioxid de carbon; (coroziune chimica uscata);
lichide rele conducatoare de electricitate: ex. alcool, benzina, benzol.
1.1.Coroziunea chimica in gaze uscate - este fenomenul cel mai des intalnit si se datoreaza oxigenului care are actiunea cea mai daunatoare asupra metalelor - oxidarea.
Coroziunea metalelor si aliajelor in medii gazoase la temperaturi inalte consta in formarea unor pelicule de coroziune a caror grosime depinde de temperatura si de durata expunerii.
Rezistenta metalelor in diferite medii agresive depinde de proprietatile protectoare ale peliculelor formate.
Etapele mecanismului procesului de oxidare a unui material metalic:
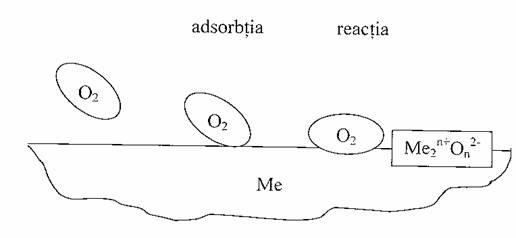
Pelicula de oxid formata prezinta proprietati protectoare cu atat mai mari cu cat porozitatea ei este mai mica si aderenta la suprafata metalului mai mare. O pelicula stabila si aderenta franeaza intr-o oarecare masura procesul de oxidare.
Coeficientul de expansiune pentru oxidul compact este dat de raportul Pilling-Bedworth.
Raportul PILLING - BEDWORTH
K = ![]()
Unde: Voxid - volumul oxidului;
Vmetal - volumul metalului din care s-a format oxidul.
Functie de valoarea lui K, pelicula formata poate fi:
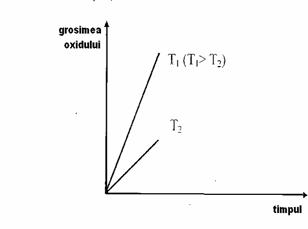
a) k < 1 - pelicula este poroasa, plina de fisuri si neprotectoare. Cresterea grosimii x a peliculei este neliniara, data de relatia:
x = k1 τ + k1'
unde: x - grosimea peliculei;
k1 , k1' - constante;
τ - timpul.
Pelicula prezinta tendinte de exfoliere si procesul de oxidare continua pana la distrugerea metalului.
Exemplu: coroziunea magneziului.
VARIATIA GROSIMII OXIDULUI IN TIMP
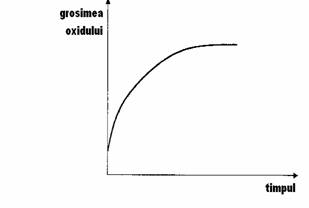
b) 1< k < 1,5 - pelicula este compacta cu bune proprietati protectoare. Cresterea grosimii peliculei x este parabolica, fiind data de relatia:
x2 = k2 τ + k2'
unde: x - grosimea peliculei;
k2 , k2' - constante;
τ - timpul
Exemplu: coroziunea cuprului la 1000s C
VARIATIA GROSIMII OXIDULUI IN TIMP
c) k > 1,5 - pelicula formata este compacta, dar cu puternice tensiuni interne, care provoaca exfolierea peliculei respective.
Exemplu: coroziunea otelului in timpul laminarii la 900sC- 1200sC cand se formeaza tunder (un complex de oxizi). Tunderul se exfoliaza, permitand continuarea oxidarii otelului.
ETAPELE FORMARII TUNDERULUI
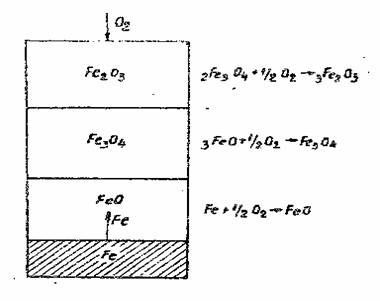
Functie de culoare se stabilesc 3 tipuri de rugina:
a) rugina alba - Fe(OH)2 - se formeaza dupa reactia:
Fe + 2H2O Fe(OH)2 + H2
|
Si care se observa foarte rar, deoarece trece in rugina bruna prin oxidare.
b) rugina bruna - se formeaza dupa reactia:
4Fe(OH)2 +O2 4FeOH.OH +2H2O
c) rugina neagra numita si magnetita, din cauza proprietatilor magnetice - formata din oxid feros si feric:
2FeOH.OH + Fe(OH)2 Fe3O4 + 2H2O
Magnetita este considerata forma cea mai stabila a oxizilor de fier, formand la suprafata metalului un strat cu caracter protector si aderent.
Concluzie: fenomenul de oxidare este un proces exoterm, care tinde sa transforme metalul in oxizii sai. Valoarea caldurii de oxidare este o masura a tendintei metalului de a se oxida. In functie de valoarea ei, se poate realiza o ierarhizare a metalelor:
Au < Hg <Ag < Cu < Pb < Sn < Ni < Fe < Cr < Zn < Al < Mg < Co
1.2. Coroziunea chimica in lichide rele conducatoare de electricitate
In acest caz, materialul continua sa se dizolve in lichid pana ce:
materialul se consuma;
lichidul devine saturat.
Exemple:
Atacul unui metal lichid asupra altui metal. Plumbul topit mentinut in creuzete de otel pentru a fi rafinat, ataca otelul in special la nivelul limitei grauntilor cristalini. Un atac prelungit, duce la aparitia fisurilor in creuzet.
Dizolvarea selectiva a unui element dintr-un material metalic: ex. dezincarea alamelor care contin mai mult de 15% zinc, consta in dizolvarea atat a cuprului cat si a zincului in solutii apoase la temperaturi ridicate. Zincul ramane in solutie, iar cuprul se depune pe alama inca neatacata formand un strat poros.
Coroziunea grafitica a fontelor cenusii este de fapt dizolvarea in apa a ionilor de fier situati in jurul lamelelor de grafit. Aceasta dizolvare selectiva constituie amorse de fisurare in cazul conductelor de fonta cenusie.
Dizolvarea polimerilor in diferiti solventi; de ex. polistirenul se dizolva in benzen, care are o structura similara; polietilena se dizolva in solventi care au o structura asemanatoare.
Atacul captuselii refractare acide a cuptoarelor de elaborare a otelurilor de catre zgura bazica topita. Acest fenomen denumit si "fluxarea ceramicii" (atacul cu flux a ceramicii) conduce la necesitatea repararii sau chiar a inlocuirii captuselii refractare.
CONCLUZII
Coroziunea chimica in medii lichide se caracterizeaza prin:
ionii mici se dizolva mai rapid decat structurile mai complicate;
dizolvarea are loc mai rapid daca materialul solid si solventul au structuri similare;
cresterea temperaturii determina cresterea vitezei de disociere si in consecinta rezulta o dizolvare mai rapida.
2. Coroziunea electrochimica
2.1. Mecanismul coroziunii electrochimice
Coroziunea electrochimica reprezinta atacul distructiv exercitat asupra metalelor sau aliajelor de catre mediul coroziv prin intermediul unor reactii electrochimice care implica un transfer de ioni si electroni la interfata conductor electronic/conductor ionic sub influenta unei diferente de potential electric ce exista intre faze.
Distrugerea metalului prin coroziune electrochimica presupune desfasurarea simultana pe aceeasi suprafata metalica a doua reactii de electrod cu viteze egale si de sens contrar.
La materialele metalice aflate intr-un mediu agresiv pot apare urmatoarele comportari:
a) coroziunea materialului metalic;
b) imunitatea materialului metalic;
c) pasivitatea materialului metalic;
d) acoperirea materialului metalic cu un compus mineral.
2.2. Elementul galvanic este constituit din: anod, catod, conductor (contact), punte de sare.
CELULA GALVANICA
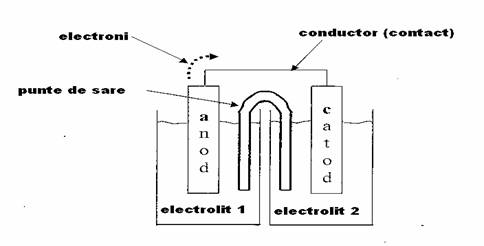
Prin conventie, celula galvanica este reprezentata astfel:
M1/M1 n+// M2 n+/M2
Prin linia simpla se marcheaza limita de separare lichid-solid, iar prin linia dubla se marcheaza puntea de sare. Acelasi element galvanic permite: coroziunea electrochimica si depunerea electrolitica.
Anodul doneaza electroni circuitului si ioni electrolitului, corodandu-se.
Catodul primeste electroni din circuit prin intermediul unei reactii de catod sau chimice. Ionii care se combina cu electronii formeaza un subprodus la catod.
Conductorul (contactul) permite conectarea electrica a anodului si catodului, permitand electronilor trecerea de la anod la catod.
Electrolitul este un lichid aflat in contact cu anodul si catodul. El asigura deplasarea ionilor de pe suprafataa anodului spre catod. Uneori se folosesc doi electroliti uniti printr-o punte de sare, care permite numai contactul electric prin intermediul ionilor, dar impiedica amestecarea elor doi electroliti.
Puntea de sare este un tub in forma de U rasturnat incarcat de obicei cu o solutie saturata de KCl (clorura de potasiu), prevazut cu placi poroase la capete, ionii de K+ si de Cl- au mobilitati aproape egale.
Intr-un element galvanic se pot produce:
reactia anodica
reactia catodica:
o la electrodepunere
o la coroziune.
Reactia anodica (de oxidare) in urma careia ionul metalic paraseste reteaua cristalina trecand in mediul coroziv sub forma de ioni hidratati si lasa in masa metalica cantitatea echivalenta de electroni.
Reactia anodica:
M M n+ + n e-
Datorita ionilor care il parasesc, anodul se corodeaza.
Reactia catodica la electrodepunere este o reactie de reducere care este inversa reactiei anodice:
M n+ + n e- M
Ionii metalici formati prin reactia anodica sau adaugati intentionat in electrolit se combina cu electronii la catod. Astfel, metalul respectiv se depune si acopera suprafata catodului.
Reactia catodica la coroziune, cu mici exceptii nu duce la depunerea metalului pe catod, ci la obtinerea unui subprodus gazos, lichid sau solid la catod, care poate forma asa numitul electrod de :
hidrogen, oxigen, apa.
Electrodul de hidrogen se formeaza cand in electrolit lipseste oxigenul, ca de ex. in cazul HCl sau a apei linistite conform reactiei:
2H+ + 2e- → H2 ↑
Electrodul de oxigen se formeaza cand electrolitul este apa aerata, care contine oxigen, conform reactiei:
O2 + 2H2O + 4e- → 4OH-
Electrodul de apa se formeaza cand electrolitul contine acizi oxidanti, conform reactiei:
O2 + 4H+ +4e- → 2H2O
2.3. Tensiunea absoluta de electrod la echilibru
Se considera un electrod format dintr-o placa metalica M introdusa intr-un electrolit, care este o solutie a unei sari a acelui metal. Prin extensie, ansamblul M/Mn+ este denumit un electrod simplu.
De ex. o placa de Cu in contact cu o solutie de sare cuprica este un electrod la echilibru. La echilibru se obtine un dublu strat electrochimic asimilabil intr-o prima aproximare cu un condensator incarcat. Grosimea acestui strat este de ordinul nanometrilor (1 nm = 10-9 m).
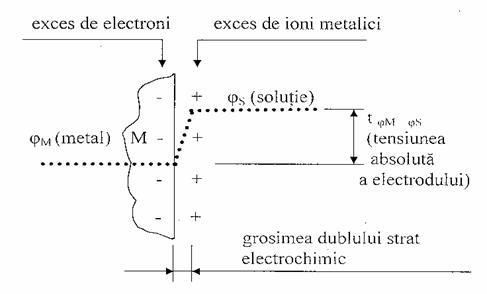
Tensiunea absoluta a electrodului:
tjM-jS jM jS
jM - potentialul metalului;
jS - potentialul solutiei.
![]()
Echilibrul este descris de relatia:![]()
M ![]()
Unde: I0 - intensitatea fluxului de electroni a celor doi curenti electrici opusi si egali la echilibru.
S-a constatat ca este imposibil de a calcula sau determina tensiunea absoluta de electrod, dar se poate masura tensiunea relativa de electrod.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Lucrari pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||