
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Instalatii de prelucrare electrochimica cu depasivizarea hidrodinamica |
Instalatii de prelucrare electrochimica cu depasivizarea hidrodinamica
Instalatii de prelucrare electrochimica cu depasivizarea hidrodinamica
La acest procedeu depasivizarea se face prin circulatia fortata a electrolitului, urmarindu-se erodarea unei cantitati cat mai mari de material de la anod-piesa.
Generarea suprafetelor prelucrate se face de obicei prin copiere, electrodul catod avand o forma bine determinate in functie de suprafata de prelucrat , electrolitul folosit si parametrii regimului de lucru.
Se utilizeaza densitati foarte mari de current
intre 0,5 si 12 A/![]() si o curgere turbulenta cu viteza ridicata (6-60 m/s) ,a
electrolitului pe intreaga suprafata de prelucrare.
si o curgere turbulenta cu viteza ridicata (6-60 m/s) ,a
electrolitului pe intreaga suprafata de prelucrare.
Electrolitii folositi sunt de regula solutii apoase ale unor compusi anorganici puternic corozivi, putand fi activi sau pasivati, anexa 2.
Instalatiile de prelucrat electrochimic pot sa lucreze cu un electrod-scula sau cu mai multi electrozi-scula la executia pieselor profilate complex.
In anexa 3 este prezentata schema de principiu unei instalatii de prelucrare electrochimica cu depasivizare hidrodinamica cu ce lucreaza ce electrozi scula multipli ES1- ES4 utilizata la prelucrarea paletelor de turbine -5.
Miscarile de avans - de profilare ale fiecarui electrod-scula sunt realizate cu ajutorul motoarelor hidraulice liniare MH ce primesc comenzile de la sistemul de actionare hidraulica s.a.H.-6, ce este comandat de sistemul electronic cuplat cu un calculator C(3).
|

Ambele forme sint lipsite de tensiuni angulare, dar difera prin tensiunile conformationale. Astfel, in timp ce forma scaun este practic lipsita de tensiuni conformationale avind toate legaturile intercalate, forma baie are unele legaturi eclipsate (C1-C2 cu C3-C4 si C1-C6 cu C4-C5) si altele intercalate (C1-C2 cu C5-C6, C1-C6 cu C2-C3, C3-C4 cu C5-C6, C4-C5 cu C2-C3). Din acest motiv molecula este in ansamblu mai bogata in energie - cu 24,6 kJ/mol - si deci mai putin stabila. Forma baie prezinta ca urmare fenomenul de pseudorotatie si este o forma flexibila, spre deosebire de forma scaun care este rigida. Tinind cont de faptul ca diferentele de energie dintre diversele conformatii ale ciclohexanului nu sint foarte mari, la temperatura obisnuita exista un echilibru conformational intre forma scaun - baie si respectiv forma scaun inversata, care in cazul ciclohexanului nesubstituit este echivalenta cu prima:
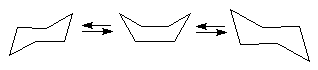
Datorita stabilitatii mult mai mari a formei scaun, ciclohexanul si marea majoritate a derivatilor sai se gasesc in aceasta conformatie la temperatura obisnuita. Calculul termodinamic simplu indica faptul ca la circa 10 molecule in conformatie scaun exista doar una in conformatie baie .
Dintre cele 12 legaturi C-H in conformatia scaun, sase care pot fi considerate aproximativ paralele cu axa de simetrie se denumesc axiale, iar celelalte care sint perpendiculare acestei axe se denumesc ecuatoriale:

Atomii de hidrogen in pozitie ecuatoriala sau axiala se afla unii fata de altii in ciclohexanul nesubstituit la o distanta de 0,25 nm. Deci atomii de hidrogen din pozitiile 1,3 diaxiale sint relativ apropiati in spatiu cea ce da nastere unor tensiuni van der Vaals (interactiuni 1,3 diaxiale). Micsorarea acestei tensiuni se poate realiza printr-o oarecare aplatizare a ciclului cu marirea concomitenta a unghiului de valenta la 112O, ceea ce duce la indepartarea atomilor de hidrogen din pozitia 1,3 diaxiala dar in acelasi timp la o marire a tensiunii angulare si conformationale. Se ajunge de fapt la o situatie de echilibru in care energia globala de tensiune este minima. In cazul derivatilor monosubstituiti ai ciclohexanului, interactiunile 1,3 diaxiale vor fi mai puternice, motiv pentru care substituentii prefera pozitia ecuatoriala. Trecerea conformerului axial in cel ecuatorial se face prin inversia ciclului.
3. Izomeria optic a
Acest tip de izomerie este determinat la compusii organici de asimetria lor moleculara. Sint considerate asimetrice acele molecule care nu se pot suprapune peste imaginea lor in oglinda (sint nesuperpozabile). Prezenta acestei particularitati structurale la un compus organic oarecare este pusa in evidenta prin studiul comportarii sale in lumina polarizata: substantele care prezinta asimetrie moleculara rotesc planul de polarizare a luminii polarizate. Din acest motiv ele sint numite optic active si prezinta izomerie optica. Orice substanta optic activa apare intotdeauna sub forma unei perechi (cel putin) de structuri numite antipozi optici sau enantiomeri (din limba greaca: enantios - opus, meros - parte). Deoarece compozitia si proprietatile fizico-chimice sint riguros identice pentru ambii termeni ai unei perechi de enantiomeri, deosebirea dintre ei se stabileste tot din comportarea fata de lumina polarizata. Enantiomerul care roteste planul de polarizare spre dreapta sau in directia acelor unui ceasornic este denumit dextrogir si notat cu semnul ( ); cel care roteste planul de polarizare spre stinga sau in sens opus acelor unui ceasornic este denumit levogir si notat cu semnul (-). Din valoarea unghiului de rotatie, a, se calculeaza pentru substantele optic active o constanta a , numita rotatie specifica si care in cazul solutiilor este: a tD 100 a l c








