
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Modelarea structurala la scala sub - nanometrica a sticlelor silicatice |
Modelarea structurala la scala sub - nanometrica a sticlelor silicatice
MODELAREA STRUCTURALA LA SCALA SUB - NANOMETRICA A STICLELOR SILICATICE
1. Introducere
Structura sistemelor oxidice vitroase poate fi evaluata la diverse niveluri structurale, in functie de gradul de complexitate considerat.
Astfel, primul nivel structural poate fi considerat cel atomic. In acest caz, structura este reprezentata de atomi (ioni) ai caror natura si numar depind de compozitia chimica a sticlelor. De exemplu, pentru sticlele din sistemele alcalino-silicatice M2O - SiO2, avand compozitia oxidica molara descrisa de formula xM2O.ySiO2, la primul nivel structural, pentru sticle structura se compune din cationi alcalini M, atomi (cationi) de siliciu si atomi (anioni) de oxigen.
Distributia unitatilor constitutive va fi urmatoarea: numar de ioni alcalini / numar de atomi de oxigen = 2x / (2x + 1y); numar de atomi de siliciu / nr. de atomi de oxigen = y(2x + 1y). Din punct de vedere dimensional, valorile proprii ionilor alcalini variaza intre 0,12 nm, diametrul Li+, si 0,338 nm, diametrul Cs+. Pentru Si valorile se plaseaza in intervalul 0,082 - 0,234 nm, valori asociate diametrului pentru ionul de Si4+, respectiv atomul de Si. In sfarsit, pe acelasi considerent, diametrul pentru oxigen este cuprins intre 0,280 nm si 0,120 nm.
Din pacate, caracterizarea sistemelor vitroase la acest nivel nu poate furniza o baza de plecare pentru a gasi eventualele corelatii intre proprietati si particularitatile structurale ale sticlelor.
Prin interactiuni fizico-chimice, atomii si ionii se grupeaza formand poliedrele de coordinare ale cationilor in raport atomii de oxigen. Entitatile structurale care sunt caracteristice acestui nivel prezinta tipo-dimensiuni diferite. Pentru sticlele din sistemul M2O - SiO2 (M = Li, Na, K, Rb, Cs) aceste entitati structurale reprezinta tetraedre de tip SiO4 si poliedre de coordinare de tipul MOm, unde m este numarul de oxigeni caracteristic numarului de coordinare NC (M/O) al ionului alcalin in raport cu oxigenul. Deoarece atomii de Si pot fi legati de diferite tipuri de oxigeni (puntati, Op, sau/si nepuntati, Onp) exista 5 entitati structurale Qn s Si(Op)n(Onp)4-n, n = (0, 1, 2, 3, 4). In acest mod formal, entitatile structurale de tip Qn pot fi considerate tipice pentru sticlele avand anumite compozitii oxidice. In tabelul 1 se prezinta astfel de echivalente pentru sticlele din sistemele alcalino-silicatice.
Entitatile structurale sub-nanometrice se afla in echilibru termodinamic, determinat de temperatura si caracterizat de constanta de echilibru.
Diversi cercetatori au abordat studiul echilibrului chimic al topiturilor vitrogene cu scopul de a determina structura acestora si de a le evalua proprietatile. Modelele de calcul ale distributiei entitatilor structurale, elaborate de specialisti conform diverselor teorii, nu au condus la formarea unei imagini structurale unice. Uneori si rezultatele numerice au fost contradictorii.
Cele mai cunoscute modele presupun existenta unei distributii de polimeri (silicatici, boratici, fosfatici etc.) si propun relatii de calcul ale acestora, iar altele considera interactiunile acid-baza intre componentii topiturilor respective si permit stabilirea unor distributii posibile de entitati structurale, definite corespunzator modelului respectiv [1].
Printre metodele experimentale, metoda MAS-RMN, este o tehnica relativ nou de rezonanta magnetica nucleara prin rotatia probei la unghiul magic de rotatie de 54,74 (Magic Angle Spin = MAS) cand se poate separa semnalul pentru atomi legati de numar diferiti de Op si Onp si chiar apar semnale diferite pentru numere de coordinare diferite.
Aceasta metoda ofera nu numai informatii calitative, referitoare la entitatile dintr-o sticla, avand o compozitie data, ci si informatii cantitative. Acestea se refera la ponderile cu care diferitele entitati structurale (cel mai adesea specii tetraedrice) intervin in structura sticlei.
Datorita informatiilor cantitative pe care le ofera, RMN este o metoda foarte utilizata pentru studiul teoretic al structurii sticlelor, permitand totodata sa se poata face comparatii cu informatiile obtinute prin calcul prin modele teoretice
In lucrare se prezinta aplicatii pentru sistemele vitroase alcalino-silicatice ale unui model termodinamic elaborat sub forma generala de Dron [2].
Tabelul 1. Echivalenta chimica intre compozitia oxidica a sticlei si tipul de tetraedru Qn.
|
Formula molara a sticlei xM2O.ySiO2 |
x |
y |
R = 2 + x/y |
Op = 8 - R |
Onp = 2R - 4 |
Qn |
|
SiO2 |
|
|
|
|
|
Q4 |
|
M2O.2SiO2 |
|
|
|
|
|
Q3 |
|
M2O.SiO2 |
|
|
|
|
|
Q2 |
|
3M2O.2SiO2 |
|
|
|
|
|
Q1 |
|
2M2O.SiO2 |
|
|
|
|
|
Q0 |
2. Baza teoretica
In sticla de SiO2, in tetraedrele de SiO4 legaturile Si - O sunt echivalente, d(Si - O) = 0,161 0,162 nm.
Aditia la sistem a oxizilor alcalini conduce la formarea entitatilor structurale de tip Qn. In aceste tetraedre distantele d(Si - Op) si d(Si - Onp) nu mai sunt echivalente. Disproportionarea legaturilor Si - O in tetraedru determina d(Si - Op) > 0,161 nm, respectiv, d(Si - Onp) < 0,161 nm. Valorile efective ale acestor distante internucleare depind de numarul de oxigeni puntati, (n), respectiv de numarul de oxigeni nepuntati, (4-n), conform compozitiei oxidice a sticlei.
Evaluari ale distantelor internucleare pentru sticlele alcalino-silicatice s-au efectuat atat din masuratori experimentale (difractie de raze X, de neutroni, EXAFS etc.), cat si pe baza unor abordari teoretice (Metoda Simularii Dinamice, Monte Carlo etc.)
In tabelul 2 se prezinta intervalele de variatie pentru valorile d(Si - Op), d(Si - Onp) si d(M O) furnizate de diversi autori, in sticlele alcalino-silicatice.
Totodata, se prezinta si intervalele in care se plaseaza valorile cele mai plauzibile pentru numerele de coordinare ale ionului M+ in raport cu oxigenul. Cele mai uzuale poliedre de coordinare sunt tetraedrul, bipiramida triunghiulara (simetrica sau nu) si octaedrul.
Tabelul 2. Distante internucleare cation - oxigen, d(M - O) si numerele de coordinare ale cationului alcalin in raport cu oxigenul NC (M/O)
|
Sticle din sistemul M2O - SiO2 |
d(Si - Op) [nm] |
d(Si - Onp) [nm] |
d(M Onp) [nm] |
NC (M/O) |
Bibliografie |
||||
|
Li2O - SiO2 |
|
|
|
|
|
||||
|
Na2O - SiO2 |
|
|
|
|
|
||||
|
K2O - SiO2 |
|
|
|
|
|
||||
|
Rb2O - SiO2 |
|
|
|
|
|
||||
|
Cs2O - SiO2
|
|
|
|
|
|
Considerand entitatile structurale Qn si MOm ca fiind inscrise unor sfere, diametrul acestora poate fi evaluat orientativ ca reprezentand dublul unor distante internucleare. Valorile efective pentru distantele internucleare prezentate in tabelul 2 certifica faptul ca, la acest nivel structural, scala caracteristica sticlelor alcalino-silicatice este sub-nanometrica (sub 1 nm).
Interatiunile in sistemele silico-alcaline sunt de tip acid-baza si odata cu saturarea cu metal a tetraedrului SiO4, are loc o scadere a diferentei de bazicitate dintre reactanti, in ordinea SiO2 disilicat metasilicat ortosilicat.
Plecand de la aceste considerente, ca reactia dintre SiO2 si M2O este o reactie acid-baza, Dron propune un model care permite calcularea distributiei entitatilor structurale pe baza interactiilor acid-baza, adica pe valorile constantelor de echilibru [2]. El considera SiO2 un acid, iar oxidul modificator o baza, definit in termen Lewis. Astfel, grupul Si-O-Si este un acceptor de dublet de electroni (acid Lewis), iar O2- un donor de dublet de electroni (baza Lewis).
Dron propune ca valoarea constantei de echilibru sa depinda de numarul si tipul de oxigeni puntati sau nepuntati care se leaga in tetraedrul SiO4. In sistemul M2O - SiO2, sunt posibile mai multe reactii caracterizate de constante de echilibru care pot fi privite ca fiind combinatia a patru reactii partiale de baza:
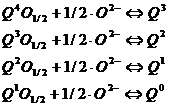
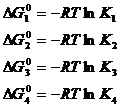 (1)
(1)
unde Ki sunt constantele de echilibru in directie opusa, DG0i este energia libera de reactie Gibbs, R - constanta generala a gazelor si T - temperatura in grade K.
Modelul lui Dron este interesant pentru ca permite calcularea distributiei entitatilor structurale pe baza interactiilor acid-baza, dar aplicarea lui este greoaie deoarece presupune cunoasterea constantelor de echilibru, ceea ce este foarte dificil.
Conform regulii lui Stevels, care precizeaza ca Onp = 2R - 4 si Op = 8 - 2R, unde R = O/Si (conform formulei sticlei), speciile Q4 Q0 caracterizeaza in sistemul silicatic binar considerat, urmatorii compusi chimici: SiO2, 2SiO2.M2O; SiO2.M2O; 2SiO2.3M2O; SiO2.2M2O.
Constantele K1, K2, K3 si K4 sunt constantele de echilibru ale reactiilor de principiu si ale reactiilor reale prezentate in tabelul 3.
Tabelul 3. Constantele de echilibru in sistemele silico-alcaline.
|
Nr. |
Reactia de principiu |
Reactia reala |
Energia libera Gibbs |
|
|
Q4 O1/2 + 1/2 O2- Q3 |
2SiO2 + M2O 2SiO2.M2O |
DG10 = - RT ln K1 |
|
|
Q3 O1/2 + 1/2 O2- Q2 |
SiO2 + M2O SiO2.M2O |
DG20 = - RT ln K2 |
|
|
Q2 O1/2 + 1/2 O2- Q1 |
2SiO2 + 3M2O 2SiO2.3M2O |
DG30 = - RT ln K3 |
|
|
Q1 O1/2 + 1/2 O2- Q0 |
SiO2 + 2M2O SiO2.2M2O |
DG40 = - RT ln K4 |
Se obtin 6 necunoscute (cele 5 tipuri de entitati structurale Qn, n = 0 4, plus concentratia de Q2- din bilantul de oxigen) plasate intr-un sistem neliniar de 6 ecuatii care se poate rezolva prin metode numerice pentru o compozitie data si cunoscand constantele K1, K2, K3 si K4. Pentru calculul acestor constante trebuie cunoscuta energia libera Gibbs, in stare standard.
3. Rezultate si discutii
Pentru determinarea constantelor Ki, au fost selectate reactiile de formare ale diferitilor silicati in sistemele M2CO3 - SiO2 (M = Li, Na, K, Rb si Cs), pentru care au fost preluate din literatura date referitoare la energia libera Gibbs, DGi0 [8].
Intrucat nu se dispune de date termodinamice pentru toti silicatii de interes, pentru energia libera Gibbs de formare, s-a utilizat o dependenta functionala de forma [9-13]:
![]() (2)
(2)
in care pB reprezinta ponderea bazicitatii compusului chimic rezultat in urma unei reactii de tipul celor prezentate in tabelul 3.
In acest scop s-a stabilit functia de variatie lg K = f (pB), din care se calculeaza valorile K corespunzatoare compusilor pentru care nu exista date despre DG0. Valorile termodinamice au fost preluate din [14,15].
Au fost astfel obtinute valorile constantelor Ki. Pentru exemplificare, in tabelul 4 sunt prezentate valorile constantelor K'i = 1/Ki (K'i este constanta reactiei inverse de la dreapta la stinga din tabelul 3) obtinute pentru compozitia disilicatului alcalin, M2O.2SiO2 (M = Li, Na, K, Rb si Cs) [1].
Tabelul 4. Valorile constantelor K'i = 1/Ki pentru disilicatii alcalini la diferite temperaturi.
|
Temperatura |
Li2O.2SiO2 |
Na2O.2SiO2 |
K2O.2SiO2 |
Rb2O.2SiO2 |
Cs2O.2SiO2 |
|
1800 K |
|
|
|
|
|
|
1600 K |
|
|
|
|
|
|
1500 K |
|
|
|
|
|
|
1400 K |
|
|
|
|
|
In toate sistemele binare silicatice, pe baza valorilor obtinute si considerand K1 = 1, s-au calculat celelalte constante prin metoda rapoartelor. Rezultatele sunt prezentate in tabelul 5.
Tabelul 5. Valorile constantelor K1 K4, in sistemele alcalino-silicatice M2O - SiO2, la 1800 K.
|
Sistemul oxidic |
MS2 (K1) |
MS (K2) |
M3S2 (K3) |
M2S (K4) |
|
Li2O-SiO2 |
|
|
|
|
|
Na2O-SiO2 |
|
|
|
|
|
K2O-SiO2 |
|
|
|
|
|
Rb2O-SiO2 |
|
|
|
|
|
Cs2O-SiO2 |
|
|
|
|
Cunoscand valorile constantelor de reactie, K1 K4 determinate, se rezolva sistemul neliniar de 6 ecuatii cu 6 necunoscute cu ajutorul unui program special rulat pe calculator, rezultand astfel distributiile entitatilor structurale Q0Q4 pentru sistemele silico-alcaline considerate, la 1800 K.
In figurile 1-5 se prezinta distributia entitatilor structurale in sistemele alcalino-silicatice M2O - SiO2 ( M = Na, K, Rb, Cs) la 1800 K, in functie de fractia molara a oxidului alcalin respectiv. Trebuie precizat ca domeniul de existenta al sticlelor este pana la fractia mol. M2O = 0,5.
Nu a fost prezentata distributia entitatilor structurale in sistemul Li2O - SiO2 intrucat are o evolutie aparte, care la stadiu actual de cunoastere este pusa pe seama unei comportari a Li2O ca partial formator de retea, datorita caracterului mai covalent al legaturii Li - O fata de ceilalti ioni alcalini.
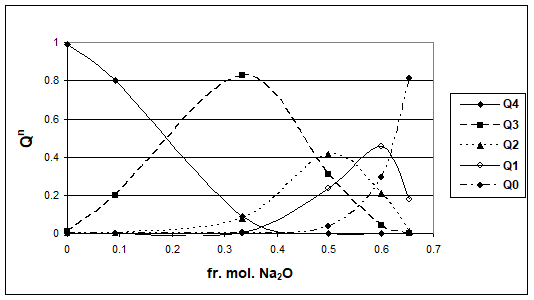
Figura 2. Distributia entitatilor Qn, in functie de fr. mol. Na2O, la 1800K
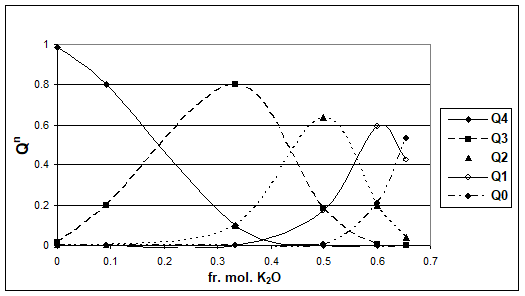
Figura 3. Distributia entitatilor Qn, in functie de fr. mol. K2O, la 1800K
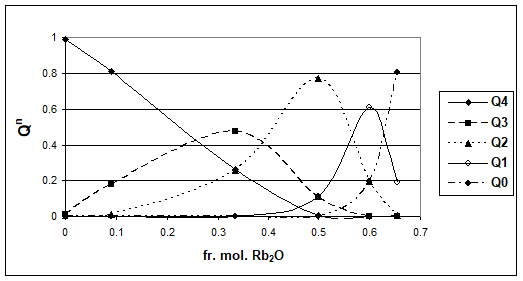
Figura 4. Distributia entitatilor Qn, in functie de fr. mol. Rb2O, la 1800K
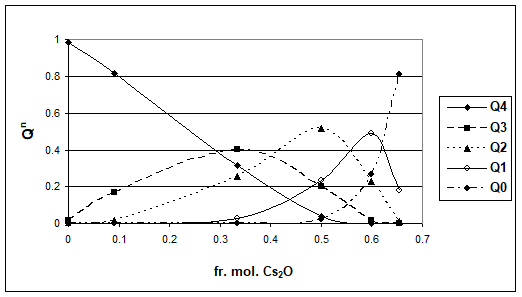
Figura 5. Distributia entitatilor Qn in functie de fr. mol. Cs2O, la 1800K
In tabelul 6 au fost grupate distributiile entitatilor structurale Qn, pentru compozitia disilicatul alcalin (M2O.2SiO2), la 1800 K.
Tabelul 6. Valorile calculate pentru entitatile structurale Qn pentru disilicatul alcalin M2O.2SiO2
|
Sistemul oxidic |
Q4 |
Q3 |
Q2 |
Q1 |
Q0 |
|
Na2O-SiO2 |
|
|
|
|
|
|
K2O-SiO2 |
|
|
|
|
|
|
Rb2O-SiO2 |
|
|
|
|
|
|
Cs2O-SiO2 |
|
|
|
|
|
Pe baza rezultatelor prezentate se poate constata ca natura ionului alcalin influenteaza ponderea entitatilor structurale Qn. Se poate observa o comportare asemanatoare a sistemelor Na2O - SiO2 si K2O - SiO2, respectiv a sistemelor Rb2O - SiO2si Cs2O - SiO2.
Valorile Q3 sunt maxime pentru toate sistemele studiate, corespunzand la 33% mol. R2O, ceea ce corespunde si tabelului 1. Totusi, se regasesc si Q2 si Q4, in proportii mai mici dar importante, datorita caracterului mai dezordonat al sistemelor vitroase fata de sistemele cristaline cu aceeasi compozitie.
|
Metoda MAS-RMN permite determinarea ponderilor entitatilor structurale prezente in sticle si, pe baza acestei proceduri, multi cercetatori au facut determinari de distributii de entitati structurale. In tabelul 7 sunt prezentate valorile distributiei speciilor Qn pentru compozitia disilicatului de sodiu, respectiv, potasiu [16,17]. |
Tabelul 7. Distributia speciilor Qn, determinata de diversi autori prin MAS-RMN pentru compozitia disilicatului de sodiu, respectiv, potasiu
|
Sistemul Na2O - SiO2 |
Autori |
Q4 [%] |
Q3 [%] |
Q2 [%] |
Q1[%] |
|
Malkawa & Co. [16] |
|
|
|
|
|
|
Emerson & Co. [17] |
|
|
|
|
|
|
Sistemul K2O - SiO2 |
Autori |
Q4 [%] |
Q3 [%] |
Q2 [%] |
Q1 [%] |
|
Malkawa & Co. [16] |
|
|
|
|
|
|
Emerson & Co. [17] |
|
|
|
|
Se poate observa ca pentru aceleasi compozitii diversi autori au obtinut valori usor diferite, ceea ce se explica prin faptul ca distributia speciilor Qn este influentata, pe langa compozitia oxidica a sistemului, si de istoria termica si istoria topirii. Totusi, se poate observa o buna apropiere intre valorile din tabelul 6 (calculate) si cele raportate in literatura, din tabelul 7.
Grupul condus de Vedishcheva si Shakhmatkin, a folosit modelul solutiilor asociate impreuna cu datele termodinamice ale compusilor cristalini corespunzatori, pentru a calcula concentratia diferitelor specii Si(n) (unde n este numarul de atomi de oxigen puntati) [18]. Se poate usor constata ca Si(n) s Qn (n = 0 4). In figura 6 este prezentata distributiile speciilor Si(n) s Qn, in topituri silico-sodice, fiind comparate cu cele determinate experimental de colectivul condus de Maekawa [16].
Se poate lesne observa o buna apropiere intre aceste distributii si cele prezentate in figura 2.
![]()
![]()
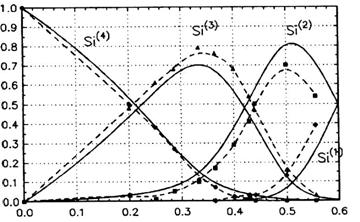
Figura 6. Distributia speciilor Si(n) in topituri silico-sodice in functie de fractia mol. Na2O: linie plina - calcul; linie intrerupta - date experimentale din [16].
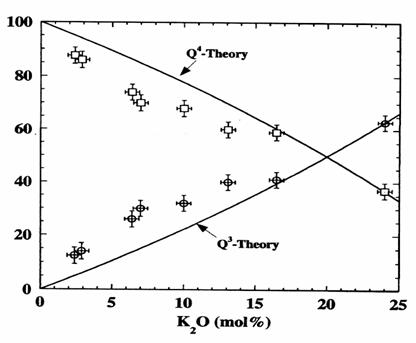
Sen si colaboratorii [19] au studiat sistemul K2O-SiO2, in zone bogate in SiO2, pentru sticle elaborate la temperaturi cuprinse intre 1550 C si 1800 C. Masuratorile prin MAS-RMN a distributiei entitatilor Qn precum si rezultatele obtinute teoretic sunt prezentate in figura 6.
Se poate observa o foarte buna concordanta intre valorile obtinute de Sun si cele prezentate in figura 3, in zona compozitionala 0 - 25% mol. K2O.
![]() Acest lucru arata ca premizele utilizate
in calcul precum si metodologia folosita sunt corecte si
genereaza distributii foarte apropiate de cele masurate
experimental.
Acest lucru arata ca premizele utilizate
in calcul precum si metodologia folosita sunt corecte si
genereaza distributii foarte apropiate de cele masurate
experimental.
Figura 6. Distributia entitatilor Q4 (patrate) si Q3 (cercuri) in functie de % mol. K2O, in sistemul K2O-SiO2 determinate prin MAS-RMN si calculate teoretic.
4. Concluzii
- La un nivel structural subnanometric, pentru sticlele din sistemul M2O - SiO2 (M = Li, Na, K, Rb, Cs)) exista 5 entitati structurale caracteristice Qn s Si(Op)n(Onp)4-n, n = (0, 1, 2, 3, 4), unde Op si Onp sunt atomii de oxigen puntati si, respectiv, nepuntati;
- In sistemele alcalino-silicatice M2O-SiO2 (M = Li, Na, K, Rb, Cs) au fost stabilite pe baze termodinamice valorile constantelor Ki, corespunzand reactiilor acid-baza care conduc la formarea entitatilor structurale de tipul Qn. Au fost obtinute valorile concentratiilor entitatilor structurale Qn, (n = 0 pentru sistemele considerare la 1800 K;
- S-au realizat curbele de distributie a entitatilor structurale Qn in functie de fractia molara a M2O;
- S-a constatat ca distributiile speciilor Qn calculate se prezinta asemanator pentru sistemele cu Na2O si K2O, respectiv Rb2O si Cs2O,
- S-a constatat o foarte buna concordanta intre distributiile unor autori si cele calculate si prezentate in aceasta lucrare. Acest lucru arata ca premizele utilizate in calcul precum si metodologia folosita sunt corecte si genereaza distributii foarte apropiate de cele masurate experimental.
5. Bibliografie
O.Dumitrescu, Thermodynamics of acid-base interactions applied to vitreous oxide systems, Thesis, Scientific supervisor D.Radu, University Politehnica of Bucharest, Romania, 2008.
- R.Dron, Acid-base Reactions in Molten Silicates J. Non-Cryst. Solids, 1982, 53 3), 267.
N.Kitamura, K.Fukumi, H.Mizoguchi, M.Makihara, A.Higichi, N.Ohno, and T.Fukunaga, High pressure densification of litium silicate glasses, J.Non-Cryst. Solids, 2000, 274, 244.
E.Muller, K.Heide and E.D.Zanotto, Molecular structure and nucleation in silicate glasses, J.Non-Cryst. Solids, 1993, 155, 56.
B.Hatalova and M.Liska, The bimodality in the SiOSi bond angle distribution in simulated sodium silicate systems, J.Non-Cryst. Solids, 1992, 146, 218.
R.Guaker and S.Urnes, X-ray diffraction studies of glasses in the system Na2O - SiO2, Phy. Chem. Glasses, 1973, 14 (2), 21.
I.Yasui, H.Hasegawa and M.Imaoka, X-ray diffraction study of the structure of silicate glasses. Part 1. Alkali metasilicate glasses, Phy. Chem. Glasses, 1983, 24 (3), 65.
D.Radu, O.Dumitrescu and A.Volceanov, Proceedings of the First Balkan Conference on Glass Science & Technology, edited by G.Kordas & N.Vlachos, Volos, Greece, 2000, p.113.
O.Dumitrescu and D.Radu, The Implications of Basicity on the Thermodynamic Properties of Silica-Alkali Vitreous Systems Gibbs, Rev. Chim. (Bucuresti), 2009, 60 (4), 347.
O.Dumitrescu and D.Radu, Systèmes cristallins silico-alcalins: l'influence de la basicité sur certaines propriétés thermodynamiques, Revue Roumaine de Chimie, 2009, 54 (2), 165.
O.Dumitrescu and D.Radu, Gibbs free energy - basicity correlations in binary crystalline and vitreous systems, Romanian Journal of Materials, 39, nr.1, 2009, p.38.
D.Radu and O.Dumitrescu, Gibbs Free Energy-Basicity Correlation in Binary Silica-Alkali Systems, Rev. Chim. (Bucuresti), 2008, 59 (6), 635.
O.Dumitrescu and D.Radu, Basicity-Gibbs Free Energy Relationships for Binary Alkali Silicates, Advanced Materials Research, 2008, 39-40,169.
V.I.Babuschin, G.M.Matveev and D.P.Mcedlov-Petrosian, Thermodynamic of Silicates, Springer Verlag, Berlin Heidelberg, New York, Tokyo, 1985.
***, Handbook of Chemistry and Physics, 80th ed., D.R. Linde, Ed. CRC Press: New York, 1999-2000.
H.Malkawa, T.Malkawa, K.Kawamura and T.Yokokawa, The structural groups of alkali silicate glasses determined from 29Si MAS-NMR, J. Non-Cryst. Solids, 1991, 127 (1), 53.
J.J.F.Emerson, P.E.Stallworth and P.J.Bray, High-field 29Si NMR studies of alkali silicate glasses", J. Non-Cryst. Solids, 1989, 113 (2-3), 253.
N.Vedishcheva, B.Shakhmatkin, M.Shultz, B.Vessal, A.Wright, B.Bachra, A.Clare, A.Hannon and R.Sinclair, "A thermodynamic, molcular dynamcs and neutron diffraction investigation of tetrahedral species and the network modifying cation environment in alkali silicate glasses", J. Non-Crystal. Solids, 1995,192&193, 292
S.Sen and R.Youngman, NMR study of Q-speciation and connectivity in K2O-SiO2 glasses with high silica content, J. Non-Cryst. Solids, 2003, 331 (1-3), 100.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








