
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Retele cristaline ale metalelor |
Retele cristaline ale metalelor
RETELE CRISTALINE ALE METALELOR
Metalele si aliajele sunt corpuri solide cristaline. Ele difera de solidele amorfe in care atomii sunt dispusi dezordonat, prin faptul ca distributia atomilor este ordonata, prezentand o periodicitate in cele trei directii spatiale.
Cristalele metalice cuprind un numar imens de ioni pozitivi plasati dupa un aranjament regulat. Acest aranjament regulat poate fi divizat in paralelipipede elementare, egale intre ele si aflate in contact. Laturile paralelipipedelor formeaza un sistem de drepte paralele orientate in cele trei directii. Aceste directii putand fi ortogonale sau nu. Aceste paralelipipede sunt numite si celule elementare, iar ansamblul lor formeaza o retea cristalina (fig.2.1).
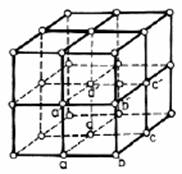
Figura 2.1. Retea cristalina reprezentata in spatiu
Daca in desen se prezinta si atomii plasati in nodurile retelei, va rezulta structura cristalina a metalului (fig. 2.2).
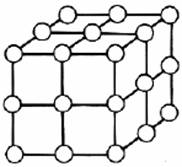
Figura Structura cristalina reprezentata in spatiu
Un sistem cristalin este definit prin parametrii celulei elementare (fig.2.3) adica prin laturile si unghiurile paralelipipedului elementar. In functie de valoarea unghiurilor , , si in functie de relatiile intre parametrii retelei a, b, c retelele se impart in 7 sisteme cristaline, prezentand 14 tipuri de retele cristaline si acestea cuprinzand 32 clase de simetrie, in care se pot forma 230 de retele posibile.
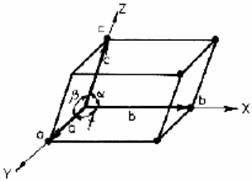
Figura 2.3. Celula elementara si denumirea parametrilor retelei cristaline
In cadrul retelelor cristaline ionii ocupa pozitii in nodurile retelei dar ei pot fi plasati si in afara nodurilor, in pozitii precise. In acest caz, retelele compuse contin mai multi atomi in celula elementara, datorita amplasarii suplimentare a atomilor in centrul celulei sau in centrele fetelor. Un atom al retelei din interiorul celulei apartine complet celulei, un atom plasat pe centrul fetei este comun Ia doua celule, iar un atom din coltul celulei este comun la opt celule. Se constata ca metalele cristalizeaza intr-un numar limitat de sisteme. Frecvent ele prezinta o retea cubica cu fete centrate CFC (fig.2.4), retea cubica cu volum centrat CVC (fig.2.5) sau o retea hexagonal compacta HC (fig.2.6).
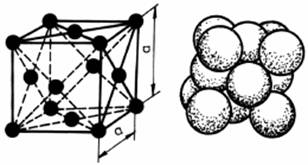
Figura 2.4. Retea cubica cu fete centrate
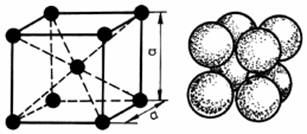
Figura 2.5. Retea cubica cu volum centrat
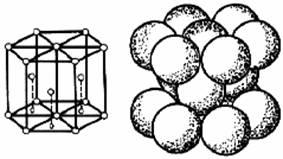
Figura 2.6. Retea hexagonal compacta
Toate aceste retele raspund exigentelor de compactitate si simetrie ridicata, rezultate din caracterul nedirectional al legaturii interatomice de tip metalic. Simetria sferica a campului de potential al ionilor pozitivi din metale le permite ionilor sa adopte aranjamente spatiale ordonate pe criteriul umplerii maxime a spatiului, ionii putand fi asimilati cu un sistem de sfere rigide.
|
Modul de amplasare al ionilor in cadrul retelei influenteaza in mare masura proprietatile metalelor. Metale care cristalizeaza in sistemul CVC sunt caracterizate printr-o rezistenta mecanica ridicata si o plasticitate moderata (V, Cr, Fe, Nb, Mo, Ta, W). Toate metalele care cristalizeaza in sistemul CFC se caracterizeaza printr-o ductilitate si maleabilitate ridicata (Al, Cu, Ni, Ag, Ir, Pt, Au, Pb, Fe). Metalele care cristalizeaza in sistemul HC au o plasticitate scazuta (Be, Mg, Zn, Cd, Ti, Zr).
1. Compactitatea retelei cristaline
In cadrul retelelor cristaline atomii pot fi reprezentati prin sferele lor de influenta, sfere ce se ating intre ele (fig.2.4, 2.5 si 2.6). Se observa ca aceste sfere nu reusesc sa umple intreg volumul retelei cristaline. Raman spatii libere intre sferele aflate in contact, aceste spatii reprezentand interstitiile retelei cristaline.
Compactitatea unei retele cristaline poate fi caracterizata prin coeficientul de compactitate. Conform modelului sferelor rigide, coeficientul de compactitate (k) este definit ca fiind raportul dintre volumul sferelor si volumul total al retelei. Astfel coeficientul de compactitate prezinta intotdeauna valori subunitare, compactitatea fiind cu atat mai ridicata cu cat valoarea lui k se apropie de unitate.
Compactitatea retelei cristaline poate fi caracterizata si prin numarul de coordinatie. Numarul de coordinatie (c) reprezinta numarul atomilor vecini cu un atom din reteaua cristalina (fig.2.7).
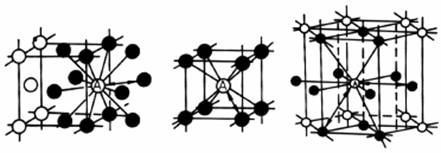
Figura 2.7. Determinarea numarului de coordinatie
pe retelele CVC, CFC si HC
In spatiile interstitiale ale retelei pot fi cuprinsi si atomi straini cu raze atomice mici, fara ca prezenta acestora sa produca deformatii ale retelei cristaline, sau determinand deformatii reduse ale acesteia; astfel de atomi straini pot fi de hidrogen, azot sau carbon. Se remarca faptul ca la reteaua CFC, desi compactitatea este foarte mare si volumul liber mic, modul de fragmentare al acestui volum liber, este avantajos dizolvarii interstitiale a atomilor straini.
Aceasta particularitate prezinta o importanta deosebita in transformarile de faza ce stau la baza tratamentelor termice si termochimice aplicate otelurilor.
2. Alotropia metalelor
Unele elemente metalice dar si unele nemetalice, prezinta mai multe tipuri de retele cristaline. Insusirile unor elemente de a prezenta retele cristaline diferite, in diferite intervale de temperatura, poarta denumirea de polimorfism, iar starile respective se numesc stari alotropice.
Prezinta transformari alotropice cateva metale din grupele principale ale sistemului periodic (Ca, Sr, Ga, In, Sn) dar majoritatea metalelor care prezinta transformari alotropice apartin grupelor secundare ale sistemului periodic respectiv metale de tranzitie, lantanide si actinide (Mn, Fe, Co, Ti, Ce, s.a.)
Starile alotropice se noteaza cu litere grecesti : etc., aceste litere scriindu-se alaturi de simbolul metalului care sufera transformari alotropice (Fe, Fe, Sn, Sn etc.).
Transformarile alotropice ale metalelor prezinta o importanta tehnica deosebita, deoarece aliajele acestor metale sunt susceptibile la tratamente termice mai variate. Prin racirea rapida pana la temperatura ambianta este posibila pastrarea starii alotropice stabile la temperaturi ridicate sau pastrarea distributiei elementelor de aliere in metalul de baza, distributie existenta la temperaturi ridicate. Intr-o astfel de stare, aliajul se afla in neechilibru si poate prezenta unele proprietati fizico-mecanice deosebite.
Transformarile alotropice sunt insotite de modificari ale volumului specific, aceasta ca urmare a modificarii compactitatii retelei cristaline. Astfel la racirea otelului densitatea variaza cu cca. 5% prin transformarea Fe (CFC) in Fe (CVC). In cazul staniului, transformarea Sn (retea tetragonala) in Sn (retea cubica) se face cu o crestere a volumului specific de 26%, tensiunile ce apar determinand faramitarea materialului.
Ca urmare a modificarilor compactitatii retelei cristaline, se vor modifica si dimensiunile spatiilor interstitiale si evident se va modifica si capacitatea de dizolvare a atomilor straini. Astfel dimensiunile relativ mari ale interstitiilor din reteaua Fe (CFC), permit dizolvarea atomilor de carbon intr-o proportie mai mare decat in Fe (CVC), acesta din urma avand interstitii mai numeroase, dar de dimensiuni mai reduse. Multe din tratamentele termice aplicate otelurilor si fontelor folosesc aceasta insusire a fierului in vederea modificarii proprietatilor prin intermediul modificarilor structurale.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








