
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Structura enzimelor - enzime cu structura proteica |
Structura enzimelor - enzime cu structura proteica
1. ASPECTE GENERALE
Din studiul naturii chimice a catorva mii de enzime cunoscute rezulta ca ele sunt, cu foarte rare exceptii, proteine sau heteroproteine. Exceptiile, descoperite in ultimii zece ani, sunt enzime cu structura de acizi ribonucleici, iar ribonucleaza P este un complex proteina-acid ribonucleic: activitatea enzimatica a acesteia din urma este datorata acidului ribonucleic si nu proteinei. Una dintre teoriile formulate in legatura cu existenta acestor enzime are in vedere urmatoarele: pe scara evolutiva, acizii nucleici au precedat proteinele si alaturi de alte functii ei au indeplinit-o si pe aceea de enzime; cand s-au sintetizat proteinele, acizii nucleici si le-au atasat pe acestea dobandind stabilitate si unele activitati crescute. Treptat insa, din motivele ce vor fi specificate, proteinele au preluat functia catalitica, ARN-ul fiind abandonat. De aceea enzimele cu structura de ARN, sau complexe ARN - proteine, sunt considerate drept 'fosile biochimice'.
Structura proteica si heteroproteica a enzimelor este avantajoasa din mai multe motive: resturile de aminoacizi din proteine dispun de o mare varietate de grupari functionale care participa la legarea substratului cat si la desfasurarea catalizei; nici-o alta clasa de compusi din lumea vie nu are varietatea de monomeri si de grupari functionale pe care o au proteinele. In plus, enzimele sunt proteine globulare, ele au deci structura secundara, tertiara si deseori structura cuaternara. Structurile secundara si mai ales cea tertiara asigura posibilitati multiple de constituire a centrelor active, zonele 'fierbinti' ale enzimelor, unde se desfasoara reactiile. Deosebit de importanta este existenta la aprox. 10-20% dintre enzime a structurii cuaternare. Activitatea acestor enzime poate fi reglata (crescuta, scazuta) prin diferiti compusi din mediu care produc mici modificari ale structurii cuaternare. Asemenea reglaje apar si la unele enzime care nu au structura cuaternara.
2. ENZIME CU STRUCTURA PROTEICA
Enzime cu structura strict proteica sunt relativ putine. Dintre cele 6 clase mari de enzime mai ales hidrolazele sunt proteine pure; exemple sunt ribonucleaza, chimotripsina si lizozimul. In cazul acestor enzime atat legarea substratului cat si cataliza in sine se realizeaza de catre gruparile functionale ale resturilor de aminoacizi.
Un exemplu il constituie actiunea catalitica a lizozimului, o enzima aflata in mucusul nazal si in lacrimi. In prezenta lizozimului are loc scindarea hidrolitica a unor compusi heterozidici care alcatuiesc peretii multor celule bacteriene; odata distrusi acesti pereti, celulele bacteriene mor. Fleming, care a descoperit actiunea hidrolitica a lizozozimului (in anul 1922), a avut un timp convingerea ca acesta este un antibiotic (compusi de a caror existenta era sigur). Ceva mai tarziu, in anul 1929, Fleming a descoperit un adevarat antibiotic, penicilina.
Heterozidele din peretii celulelor bacteriene sunt alcatuite din resturi de acid-N-acetil muramic (NAM) si resturi de N-acetilglucozamina (NAG); hidroliza lor, catalizata de lizozim, decurge astfel:
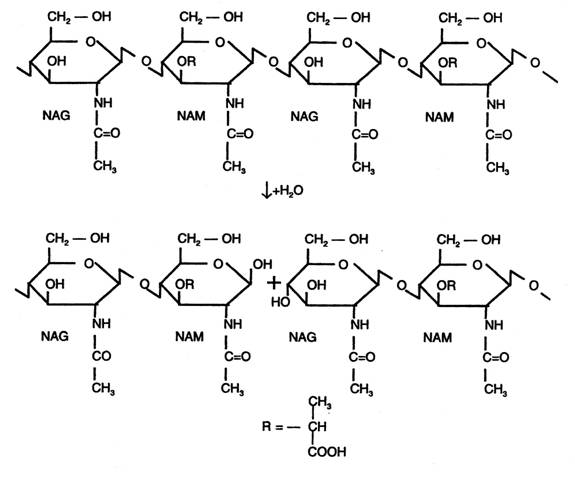
3. ENZIME CU STRUCTURA HETEROPROTEICA
Cele mai multe enzime au structura heteroproteica; ele sunt alcatuite din 'apoenzima' (componenta proteica) si 'cofactor' (componenta neproteica). Fiind molecule organice, cationi si anioni (mai rar) ai elementelor, stabilitatea cofactorilor la actiunea tempteraturii este mai mare decat a apoenzimelor.
De regula, o enzima are un singur cofactor, exista totusi si enzime cu doi cofactori, diferiti structural si functional.
In privinta terminologiei cofactorilor s-au facut recent urmatoarele recomandari (ele urmaresc sa elimine confuziile, destul de frecvente):
termenul cofactor se va utiliza pentru totalitatea compusilor neproteici din structura heteroenzimelor;
termenul 'coenzima' se va utiliza numai pentru componentele neproteice de natura organica care se leaga prin legaturi foarte slabe de apoenzime (legaturi de hidrogen, ionice, hidrofobe etc);
termenul 'grupare prostetica' se va utiliza tot pentru cofactori de natura organica dar care se leaga de apoenzime prin legaturi puternice, inclusiv covalente.
Numarul cofactorilor cunoscuti este foarte mic in comparatie cu numarul enzimelor cu structura heteroproteica. Faptul se explica prin aceea ca un anumit cofactor este capabil sa se asocieze cu diferite apoenzime rezultand astfel mai multe heteroenzime. Mai ales o parte dintre coenzime si ioni au aceasta capacitate. Exista, de exemplu, cateva sute de enzime cu rol de hidrogenaze-dehidrogenaze a caror coenzima este nicotinamid-adenin-dinucleotidul, notat NAD+ (in forma oxidata). Ele pot actiona simultan intr-un compartiment celular dat care are o cantitate limitata de NAD+, ca urmare a faptului ca NAD+ trece cu usurinta de pe o apoenzima pe alta in functie de necesitatile de moment. De exemplu, alcool-dehidrogenaza si lactatdehidrogenaza, ambele enzime citosolice (reactiile catalizate au fost prezentate mai inainte) utilizeaza NAD+ din fondul citosolic comun. Dar, in timp ce in cursul reactiilor de dehidrogenare de tipul celor catalizate de alcool dehidrogenaza, NAD+ trece in NADH + H+ (forma redusa a coenzimei) aceasta din urma este retransformata in NAD+ in reactia de hidrogenare a acidului piruvic (sau alte hidrogenari) in conditiile unui echilibru intre reactiile care genereaza si cele ce utilizeaza NAD+, este posibil ca o cantitate limitata a acestei coenzime sa asigure functionarea unui numar foarte mare de hidrogenaze-dehidrogenaze. Situatia este asemanatoare pentru enzimele cu coenzime NADP+, FMN si FAD.
|
Date ample privitoare la coenzime, care sunt derivati ai vitaminelor hidrosolubile, se afla in capitolul 'Vitamine si coenzime'. Alte date privind functia lor se afla in subcapitolul 'Centrul activ si mecanismul de actiune al enzimelor'.
Dintre gruparile prosteice, hemul este intalnit cel mai frecvent in diverse enzime din organismul uman. Alte date despre structura si functiile acestora se afla in capitolele 'Hemoproteine' si 'Energetica biochimica' Cantul respirator).
O regula generala reiesita din studiul unui mare numar de heteroenzime cu cofactori organici este ca specificitatea lor este determinata in totalitate de apoenzime in timp ce coenzimele sunt gruparile responsabile in cea mai mare parte de transformarea chimica propriuzisa.
Cum s-a mai aratat, cofactorii multor enzime sunt ioni metalici (metaloenzime). Legaturile dintre componentele proteice si ionii metalici sunt de tip electrostatic. Stabilitatea complexelor este in functie de numarul si intensitatea acestor interactiuni; din studiul acestor complexe a mai reiesit ca resturile aminoacizilor care elibereaza protoni (de exemplu, Glu, Asp, Ser) sau care au atomi de azot cu electroni neparticipanti (inclusiv atomi de azot din legaturi peptidice) constituie liganzii pentru ionii metalici.
Daca ionii metalici sunt disociati de apoenzima, enzima isi pierde complet sau isi diminua activitatea; de regula disocierile sunt reversibile in sensul ca ionul metalic poate fi reintegrat in componenta proteica.
In reactiile catalizate de metaloenzime, ionii metalici indeplinesc, de la caz la caz, roluri variate:
stabilizeaza structura enzimei;
participa la legarea substratului;
induc unele modificari in conformatia enzimei, cu efect asupra vitezei de reactie;
participa nemijlocit la cataliza, de exemplu in cazul multor reactii de oxido-reducere.
In legatura cu structura enzimelor in general, a metaloenzimelor in particular, este de remarcat si existenta enzimelor omoloage (care catalizeaza aceeasi reactie in tesuturi sau celule diferite, uneori chiar in compartimente diferite ale aceleiasi celule). Asemenea situatii s-au remarcat la enzime cum sunt aldolaza, piruvatcarboxilaza si altele. In cazul metaloenzimelor diferenta intre enzimele omoloage poate fi la nivelul apoenzimei sau/si a ionilor metalici; de exemplu, enzima superoxid-dismutaza extrasa din mitocondrii contine Mg2+ iar cea extrasa din citosol contine Cu2+ si Zn2+.
Sunt si enzime care necesita pentru cataliza simpla prezenta in mediu a anumitor ioni, cationi sau anioni; exemple sunt prezenta Ca2+ pentru activitatea lipazelor si prezenta Cl- pentru activitatea amilazei salivare.
In tabelul 1 se dau si alte enzime care au in structura, sau necesita pentru activitate, diferiti ioni.
Tabelul 1
Enzime care contin sau necesita prezenta unor ioni
|
Enzime |
Ionul |
|
Citocromi Peroxidaze Catalaze |
Fe2+ sau Fe3+ |
|
Alcooldehidrogenaza Anhidraza carbonica Carboxipeptidaza |
Zn2+ |
|
Fosfohidrolaza Fosfotransferaze |
Mg2+ |
|
Arginaza |
Mn2+ |
|
Tirozinaza Citocrom oxidaza |
Cu2+ sau Cu+ |
|
Piruvatkinaza |
K+ si Mg2+ |
|
ATP-aza membranara |
Na |
|
Amilaza salivara |
Cl- |
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2026 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Analize pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








