
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Structura invelisului de electroni |
Structura invelisului de electroni
Structura invelisului de electroni
Numarul de electroni al unui atom este egal cu numarul de protoni din nucleu. Electronii sunt repartizati pe straturi, substraturi si orbitali.
Electronii graviteaza in spatial din jurul nucleului. Ei se rotesc in jurul axei lor (miscare de spin) si in jurul nucleului cu viteze foarte mari.
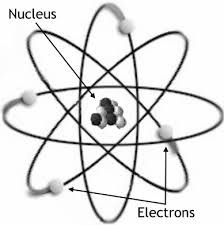
Exista un spatiu in care fiecare electron graviteaza in jurul nucleului, unde probabilitatea de a-l gasi este maxima,formandu-se o zona de electricitate negative (nor electronic), numita orbital.
Orbitalul este spatiul din jurul nucleului in care se gaseste cu probabilitate
maxima electronul, sub forma unui nor electronic.
Orbitalii se caracterizeaza prin;
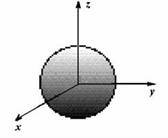
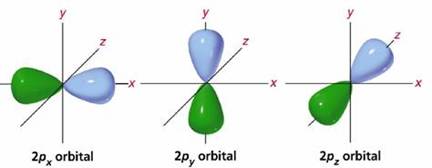
- au o anumita forma: orbitalii de tip s au forma sferica; orbitaii de tip p au forma bilobara; orbitaliide tip d si f au forma mai complicata.
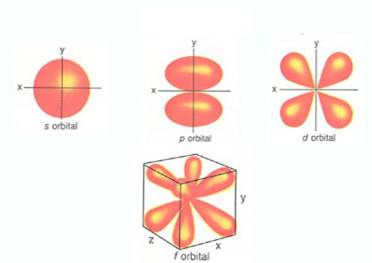
-au o anumita energie ( electronii sunt particule materiale in miscare ,deci poseda energie cinetica)
Invelisul de electroni este format din 1 -7 straturi electronice, notate cu1, 2, ----7, sau K,L, M, -----Q.
Fiecare strat este format din unul sau mai multe substraturi Substratul este format din totalitatea orbitalilor de acelasi fel dintr-un strat.
Fiecare substrat contine unul sau mai multi orbitali.
In fiecare orbital pot exista maximum doi electroni.
Pe un orbital se pot gasi maxim 2 electroni cu spin opus ( se rotesc in jurul propriei axe in sens contrar), numiti electroni cuplati.
Orbitalul se reprezinta printr-o casuta care contine fie 2 electroni cu spin opus( orbital bielectronic / cu electroni cuplati/complet ocupat), fie unul (orbital monoelectronic /semiocupat /semivacant), fie nici unul( orbital liber/vacant)
Numarul de orbitali dintr-un substrat difera in functie de tipul substratului.
substraturile de tip ns (n= 1,2,3, . 7) contin cate un singur orbital de tip s, deci pot contine maximum 2 electroni cu spin opus
substraturile de tip np(n= 2,3,4, . 7) contin cate 3 orbitali de tip p, deci pot contine maximum 6 electroni
substraturile de tip nd (n= 3,4, 5, . 7) contin cate 5 orbitali de tip d, deci pot contine maximum 10 electroni
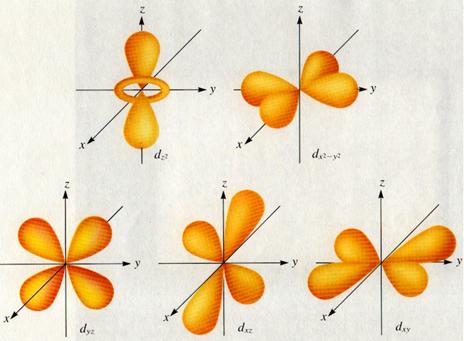
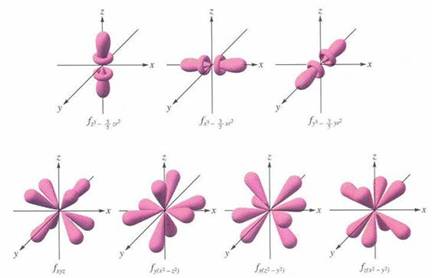
substraturile de tip nf (n= 4,5,6, 7) contin cate 7 orbitali de tip f, deci pot contine maximum 14 electroni
. Energia electronilor creste de la nucleu spre exterior (de la stratul 1 la stratul 7) si
inacelasi strat, energia orbitalilor creste in sensul ns, np, nd, nf. Deoarece la substraturile de tip nd si nf respingerile electrostatice dintre electronii in numar mare sunt mai puternice este posibil ca energia electronilor din unele substraturi de acest fel dintr-un strat inferior sa depaseasca energia electronilor din substraturile ns si np superioare.(suprapunerea straturilor)
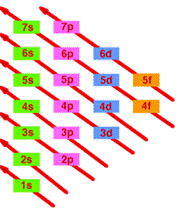
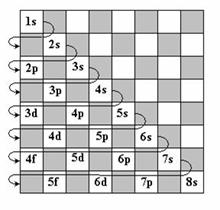
Ca urmare, ordinea nivelelor electronice(substraturilor) in atom este:
1s; 2s; 2p; 3s; 3p;4s;3d;4p;5s;4d;5p;6s;4f;5d;6p;7s;5f;6d;7p
Ea poate fi dedusa cu ajutorul schemelor de mai sus ( regula sagetilor paralele si regula tablei de sah).
Numarul maxim de electroni dintr-un strat este dat de relatia 2n2,unde n este numarul stratului.
Tema: Rezolvati aplicatiile din manual,pag. 10
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Proiecte pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








