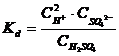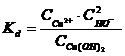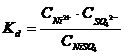| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Fizica
|
|
Qdidactic » didactica & scoala » fizica Determinarea constantei de disociere (Kd) si a gradului de disociere (α) din masuratori de conductivitate |
Determinarea constantei de disociere (Kd) si a gradului de disociere (α) din masuratori de conductivitate
Determinarea pH-ului
Scopul lucrarii
Se determina constanta de disociere Kd, gradul de disociere a si pH-ul pentru un electrolit slab, acid acetic (CH3COOH) pentru a studia variatia conductivitatii si a pH-ului acestuia cu concentratia.
Principiul lucrǎrii:
Proprietatea unei substante de a conduce curentul electric poate fi caracterizata prin conductivitatea sa electrica.
Electrolitii sunt substante care prin dizolvare intr-un solvent polar se desfac in particule cu sarcini electrice pozitive sau negative, numite ioni. Trecerea electrolitilor sub forma de ioni se numeste disociere electrolitica. Procesul de disociere electrolitica este un proces de echilibru, care se realizeaza intre ioni si molecule nedisociate ale electrolitului.
Pentru compararea din punct de vedere al conductivitatii electrice solutiilor de electroliti diferiti se defineste o alta marime, conductivitatea echivalenta, L care reprezinta conductivitatea ionilor, l raportata la un echivalent-gram de electrolit dizolvat intr-un volum, V (cm3) de solutie.
![]() , unde
, unde ![]() si reprezinta dilutia (1)
si reprezinta dilutia (1)
![]() (2)
(2)
V este volumul exprimat in cm3 de solutie ce contine un echivalent chimic din electrolitul considerat, iar C este concentratia normala a lui.
![]() (3)
(3)
iar ![]()
Conductivitatea echivalenta L creste cu dilutia si tinde catre o valoare maxima limita L , atinsa la dilutie infinita, cand disocierea electrolitului este completa. Pentru determinarea lui Lo se determina L la diferite concentratii alei unei solutii de electrolit si se extrapoleaza la C = 0.
Disocierea unui electrolit se exprima cantitativ prin doua marimi:
Constanta de disociere Kd - egala cu constanta de echilibru a procesului reversibil de echilibru ce are loc intre ioni si molecule nedisociate ale electrolitului.
Grad de disociere a - o marime fizico-chimica introdusa de Arrhenius ce reprezinta raportul dintre numarul de molecule disociate si numarul total de molecule dizolvate si se exprima prin raportul dintre L si L
![]() (5)
(5)
Kd si a reprezinta un criteriu de clasificare a electrolitilor:
Kd > 1 si a - electroliti tari practic complet disociati in solutii de concentratii cuprinse intre 0,1 si 0,001M;
Kd < 10-2 si a < 0,5 - electroliti slabi chiar si in solutii de concentratii mai mici de 0,01 M;
< Kd < 1 si 0,5 < a < 0,8 - electroliti medii.
Kd = a C / (1- a - legea dilutiei lui Ostwald (6)
Legea dilutiei lui Ostwald exprima legatura dintre Kd si a si se aplica doar pentru electrolitii slabi, deoarece in cazul electrolitilor tari, a creste cu dilutia si nu se mai obtin valori constante pentru Kd.
Inlocuind pe a din relatia (5) in relatia (6) se obtine:
![]() (7)
(7)
Electrolitii pot fii: acizi, baze sau saruri. In continuare sunt prezentate procesele de disociere in cazul electrolitilor tari
|
Disociere acid tare |
Disociere baza tare
|
Disociere sare |
||||
|
H2SO4 2H+ + SO4 2- |
Cu(OH)2 Cu2+ + 2HO- |
NiSO4 Ni2+ + SO42- |
||||
|
|
|
|
unde, "C" este concentratia electrolitilor
In cazul electrolitilor slabi: Apa este un electrolit foarte slab, doar o molecula de apa din 550.000.000 disociaza:
H2O ⇄ H++ HO- (8)
sau 2H2O ⇄ H3O++ HO- (9)
deoarece ionul de H+
nu se gaseste liber. Constanta
de disociere va fi:![]()
dar, Kd
La 250C, Kw=10-14
Fata de apa neutra solutiile pot fi: - acide,
daca
- bazice,
daca
CH3COOH
⇄ H+ + CH3COO- (10) 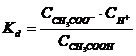 (11)
(11)
Aciditatea unei solutii se poate exprima prin marimea fizico-chimica numita pH.
In cazul solutiilor ideale, ![]() (12)
(12)
sau in cazul solutiilor reale, ![]()
![]() (13)
(13)
unde, aH+- concentratia activa sau activitatea;
![]() (14)
(14)
![]() (15)
(15)
unde, f - factor de activitate al
electrolitului, depinde de natura substantei, de temperatura si de
concentratie. Tinde catre 1 cand dilutia creste: ![]() si
si
![]()
Pentru solutii apoase, pH Daca pH < 7 solutiile au caracter acid, daca pH > 7 solutiile au caracter bazic. Pentru pH = 7 solutiile au caracter neutru.
Aparatura si substante: conductometru - inoLab® pH/Cond 720 (fig. 1), electrod de conductivitate, electrod de pH, pahare Berzelius, solutii de CH3COOH de concentratii diferite.
Mod de lucru
electrodul de conductivitate aflat in paharul Berzelius ce contine apa distilata se scoate si sterge cu hartie de filtru;
se scoate capacul protector al electrodului de pH. Se spala in apa distilata electrodul de pH, apoi se sterge cu hartie de filtru;
 Fig. 1 Conductometru - inoLab®
pH/Cond 720
Fig. 1 Conductometru - inoLab®
pH/Cond 720
se conecteaza conductometrul la reateaua de alimentare cu curent electric;
electrodul
de conductivitate se cupleaza la conductometru. Se porneste aparatul,
apasand butonul "ON/OFF" si apoi butonul "▲▼, pana
apare scala de citire a conductivitatii l exprimata in
electrodul de conductivitate se introduce pe rand in 4 pahare Berzelius ce contin solutii de CH3COOH (0.001N, 0.01N, 0.1N si 1N) in ordinea crescatoare a concentratiei. Pentru a face prima citire de conductivitate se apasa butonul "AR" pana ce apare pe ecranul aparatului in dreapta jos scris "AR". Apoi se apasa "Enter" si incepe sa clipeasca pe ecran "AR". Se asteapta ca acesta sa ramana fix pe ecran dupa care se noteaza valoarea conductivitatii l in tabelul de mai jos. Se procedeaza in acelasi mod pentru toate citirile de conductivitate;
electrodul de pH se cupleaza la aparat. Se porneste aparatul, apasand butonul "ON/OFF" si apoi butonul "▲▼, pana apare scala de citire a pH-ului;
electrodul de pH se introduce pe rand in cele 4 pahare Berzelius ce contin solutii de CH3COOH in ordinea crescatoare a concentratiei si se citesc valorile pH-ului.
dupa terminarea determinarilor se opreste aparatul, se spala electrodul de conductivitate si cel de pH. Electrodul de conductivitate se introduce in paharul Berzelius cu apa distilata, iar celui de pH i se pune capacul protector.
Rezultate si calcule
Se intocmeste tabelul urmator cu datele experimentale obtinute:
|
Solutie |
C N] |
|
|
a |
Kd |
CH+ |
pHcal |
pHmas |
|
CH3COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pentru solutiile de electrolit slab, (CH3COOH), se calculeaza:
conductivitatea echivalenta L cu ajutorul relatiei
gradul de disociere a folosind relatia (5), stiind ca valoarea conductivitatii echivalente limita L = 380 Scm2
constanta de disociere Kd pe baza relatiei (6);
concentratia ionilor de hidrogen, (CH+) cu relatia (15) si pHcalc cu relatia (13).
Exercitii:
O celula de conductivitate are urmatoarele caracteristici: suprafata electrozilor
S = 2 cm2, iar distanta dintre cei doi electrozi l = 2,5 cm. Concentratia solutiei din celula fiind 1N, iar rezistenta ei R = 50 W, sa se calculeze conductivitatea, conductivitatea echivalenta si gradul de ionizare al electrolitului. Se cunoaste L W cm2.
Rezistenta unei solutii ce contine 0,1echiv.g KCl la 1000 cm3 solutie, la 250C este
R1 = 3468,9 W; conductivatatea acestei solutii este l = 1,285 x10-2 W cm-1. O solutie 0,1N dintr-o substanta oarecare, in aceeasi celula de conductibilitate are rezistenta
R2 = 4573,4 W. Sa se calculeze conductivitatea echivalenta a acestei solutii.
Cunoscand conductivitatea echivalenta limita L W cm2 si a = 0,99 pentru o solutie de KCl, sa se calculeze concentratia acestei solutii.
Se da l W cm-1.
Rezistenta unei celule de conductivitate cu solutie de KCl, determinata experimental este R = 100 W. Stiind ca pentru solutia de KCl 0,02N, l W cm-1, sa se calculeze constanta celulei si conductivitatea echivalenta a solutiei.
Sa se calculeze pH-ul pentru: (a) 0,1 M NH4Cl (aq); (b) 0,1 M CH3COOH(aq);
c) 0.25 M CH3COOH
Calculati pH-ul unei solutii de acid acetic de concentratie 0,1 M, cunoscand valoarea constantei de disociere kd =1,8 x 10-5. Calculati pH-ul unei solutii de amoniac 0,1 N, cunoscand valoarea constantei de bazicitate kb =1,17 x 10-5.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Documente online pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||