
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Fizica
|
|
Qdidactic » didactica & scoala » fizica Reactii in sisteme omogene |
Reactii in sisteme omogene
Reactii in sisteme omogene
Intr-un sistem omogen, reactiile chimice se produc intre ioni, cel mult intre molecule. Pentru ca doua particule sa poata reactiona intre ele, Trebuie sa vina in contact (sa se ciocneasca); aceasta prima conditie pentru o reactie chimica nu este suficienta; intr-adevar, cei doi componenti ai aerului atmosferic, moleculele de O2 si N2 se ciocnesc de un numar foarte mare de ori si nu reactioneaza; daca ar reactiona chimic, s-ar forma oxizii de azot si astfel nu ar mai fi posibila viata pe pamant.
Pentru producerea unei reactii chimice, pe langa conditia ca particulele reactantilor sa vina in contact, acestea trebuie sa fie intr-o stare mai bogata in energie (stare activa); surplusul de energie al particulelor, necesar producerii reactiei chimice se numeste energie de activare ce poate fi transmisa reactantilor prin diferite forme cum ar fi:
prin incalzire, reactii termochimice;
cu ajutorul electricitatii, reactii electrochimice;
in prezenta luminii, reactii fotochimice;
prin bombardare cu particule nucleare, reactii nucleare;
cu aportul unor substante chimice, numite catalizatori, reactii catalitice etc.
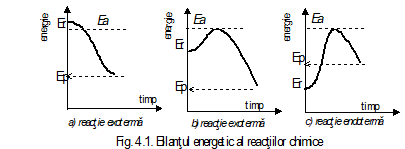
Fig.6.1. Sensul
fizic al energiei de activare
![]()
Sensul fizic al energiei de activare este urmatorul (fig.5.1.): sa presupunem ca energia particulelor reactantilor este Er iar energia produsilor de reactie la finele reactiei chimice este Ep; diferenta de energie Er-Ep = DE reprezinta efectul termic al reactiei. Pentru producerea reactiei, particulele reactantilor trebuie sa fie aduse la o energie Ea numita bariera de energie mai mare decat energia reactantilor Er; diferenta Ea - Er este energia de activare a reactiei.
In cazul cand Er > Ep (fig.5.1.b) diferenta Ea-Er < Ea - Ep, reactia decurge cu degajare de caldura, reactie exoterma .
Reactiile in care Er < Ep (fig.6.1.c) cu diferenta Ea-Er > Ea-Ep, pentru realizarea procesului este necesar un aport suplimentar de energie, reactii endoterme.
Procesele chimice se desfasoara dupa niste legi universal valabile, caracteristice si dintre care mai importante sunt: viteza de reactie si ordinul de reactie.
1. Viteza de reactie
Viteza de reactie defineste mersul reactiilor chimice in timp si depinde de : natura chimica a reactantilor, concentratia reactantilor si a produsilor de reactie, temperatura si presiunea la care se produce reactia, prezenta catalizatorilor.
Viteza de reactie se poate aprecia prin concentratia reactantilor (ce scade in timp) sau prin concentratia produsilor de reactie (ce creste in timp).
Expresia matematica a vitezei de reactie prin care se evalueaza natura chimica si concentratia este:
v ![]() (6.1.)
(6.1.)
Semnul - pentru descresterea concentratiilor reactantilor
Semnul + pentru cresterea concentratiilor produsilor de reactie.
In ipoteza ca se ia in consideratie numai concentratia, ceilalti factori raman constanti, influenta acesteia asupra vitezei de reactie se face dupa legea actiunii maselor, stabilita de Guldberg si Waage in anul 1867:
Viteza unei reactii chimice este direct proportionala cu concentratia substantelor care reactioneaza (legea actiunii maselor)
Intr-o reactie generala de forma: aA +bB + cC + mM + nN + oO , se poate scrie viteza de reactie (pentru reducerea reactantilor sau cresterea produsilor de reactie M) astfel:
v ![]() (6.2)
(6.2)
in care:
k = constanta de viteza (depinde de temperatura, presiune, prezenta catalizatorilor etc.)
CA, CB, CC si ![]() reprezinta
concentratia molara a reactantilor, A, B, C
reprezinta
concentratia molara a reactantilor, A, B, C
|
a, b, c coeficienti stoechiometrici
Temperatura influenteaza viteza de reactie deoarece energia cinetica a reactantilor creste cu temperatura; experimental, s-a demonstrat ca ridicarea cu 100 C a temperaturii reactantilor a determinat o dublare sau o triplare a vitezei de reactie. Acest fapt este utilizat in practica in vedere reducerii timpului de formare a unor materiale de constructii
Presiunea la care se produce reactia chimica este de asemenea, un factor de influenta de o mare importanta a vitezei de reactie, intrucat influenteaza compactitatea sistemului si implicit probabilitatea de ciocnire a particulelor reactantilor si este determinanta cand reactantii sunt in stare gazoasa.
Prezenta catalizatorilor (substante care intervin intr-un proces chimic fara a intra in compozitia produsilor de reactie)accelereaza reactia chimica. Mecanismul acestor reactii chimice se poate explica prin formarea unor produsi intermediari (in care intra catalizatori si reactanti) si care trec rapid in produsi de reactie si regenerarea catalizatorilor, dupa schema:
A + B + K AK + B AB+ K (6.3)
2. Ordinul de reactie
Ordinul de reactie se exprima prin suma exponentilor concentratiilor reactantilor care intervin in viteza de reactie si care reflecta de fapt numarul particulelor care prin interactiuni simultane determina o reactie chimica.
In functie de marimea ordinului de reactie, se disting reactii chimice de ordinul 1,2,3 si mai mare. S-a aratat ca reactiile chimice se produc si ca urmare a ciocnirii particulelor activate. La reactiile de ordinul intai ciocnirile pot sa lipseasca, reactiile se desfasoara sub actiunea energiei de activare; la reactiile de ordinul al doilea, ciocnirea este necesara si probabilitatea ciocnirii este ridicata, astfel incat reactiile se desfasoara relativ usor; la reactiile de ordinul trei si mai mare, probabilitatea de ciocnire a trei particule si mai multe este foarte mica, practic nula, aceste reactii se produc in trepte caracterizate prin reactii de ordinul unu si doi.
Reactiile de diferite ordine si vitezele lor de reactie sunt de forma:
reactiile de ordinul unu, cuprind procesele de descompunere in care un reactant da nastere la mai multi produsi de reactie:
A produsi de reactie
v1= k1 CA
= k1![]()
CaCO3
CaO + CO2 v1=
k1 . ![]()
reactiile de ordinul doi sunt cele mai frecvente si constau in formarea din doi reactanti ai produsilor de reactie:
A +
B produsi de reactie v2 = k2.CA.
CB = k2![]()
H2+Cl2 2 HCl v2= k2. ![]()
reactiile de ordinul trei reprezinta procese chimice dintre trei tipuri de molecule:
2A + B produsi de reactie v3 = k3. CA. CB. CC =
= k3 . ![]() .
. ![]()
2H2 + O2 H2 O v3 = k3 . ![]()
3. Tipuri de reactii chimice
Reactiile chimice cel mai des intalnite sunt:
a) Reactii de sinteza de forma A + B = C; cum ar fi oxidarile, combinatiile halogenilor, reactiile de polimerizare si aditie
b) Reactii de descompunere :
simple, de forma: A = B + C , cu ar fi descompunerea substantelor monomoleculare in procesul de incalzire, numite si disocieri termice (CaCO3 CaO + CO2);
de dubla descompunere, de forma: A + B C + D si care cuprind reactiile de hidroliza, saponificare, substitutie, policondensare;
c) Reactiile de neutralizare se produc cand reactioneaza acizi tari cu baze tari (NaOH + HCl NaCl + H2O) ;
d) Reactii de hidroliza, inversul reactiilor de neutralizare, in care apa poate sa desfaca o sare in baza si acidul din care s-a format. Numai sarurile formate dintr-un acid slab si o baza tare sau dintr-un acid tare si o baza slaba pot fi hidrolizate la temperatura normala, reactiile oprindu-se insa intr-o stare intermediara de echilibru (Na2CO3+ H2O NaOH + NaHCO3; FeCl3 + 3H2O Fe(OH)3 + 3HCl). Sarurile formate din baze tari si acizi tari hidrolizeaza numai la temperaturi ridicate in prezenta vaporilor de apa.
e) Reactii de substitutie, cum ar fi inlocuirea anionului dintr-o sare cu un alt anion provenit de la un acid tare sau inlocuirea unui cation cu un alt cation provenit de la o baza mai tare (Na2CO3+ 2HCl 2NaCl + H2CO3 ; NH4Cl + NaOH NaCl + NH4 (OH).
4. Echilibru chimic
Reactiile chimice nu se desfasoara in toate cazurile intr-un singur sens (de la reactanti la produsi de reactie) ci la un moment dat intre produsii de reactie apar interactiuni cu formarea reactantilor, se realizeaza astfel o reactie reversibila de forma A+B C+D.
Reactiile reversibile decurg in ambele sensuri pana la stabilirea unui echilibru chimic.
Vitezele de reactie se pot scrie in acest caz astfel:
- pentru reactanti v1 = ![]() .
. ![]()
- pentru produsii de
reactie: v2
= k2 . ![]()
k1 si k2 fiind constante de viteza
Analizand vitezele de reactie rezulta ca v1 va scadea in timp iar v2 va creste; vitezele v1 si v2 variind in sensuri contrare se ajunge la un moment dat ca v1 = v2, ceea ce conduce la :
![]() .
. ![]() = k2 .
= k2 . ![]()
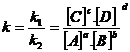 (6.4)
(6.4)
k = constanta de echilibru, relatia (6.4) este exprimarea matematica a legii actiunii maselor .
Stabilirea echilibrului intr-o reactie chimica poate constitui un neajuns in unele procese industriale in care se urmareste ca reactia sa mearga pana la capat. In cuptoarele metalurgice tehnologiile au la baza reducerea oxizilor de metal cu ajutorul oxidului de carbon. Oxidul de carbon se obtine din arderea cocsului intr-un curent de aer; la temperatura de 9000C carbonul din cocs nu se mai poate oxida direct, reactia se realizeaza prin extragerea oxigenului din dioxidul de carbon rezultat prin ardere. La un moment dat se stabileste un echilibru chimic intre oxidul de carbon si dioxidul de carbon, avand drept urmare incetinirea reactiilor reducatoare si deci incetinirea procesului tehnologic. Realizarea cuptoarelor inalte de ardere, furnale, nu a avut influenta asupra echilibrului chimic, ci numai folosirea unor adaosuri, cu rol de catalizator, au rezolvat problema.
Deplasarea echilibrului chimic in sisteme omogene se realizeaza conform principiului lui Le Chatelier, factorii perturbatori fiind concentratia, temperatura si presiunea.
Influenta concentratiilor asupra echilibrului chimic este cuprinsa in legea actiunii maselor. Deplasarea echilibrului chimic in acest caz se poate realiza prin reducerea concentratiilor pe masura ce se formeaza reactantii; eliminarea produsilor de reactie se poate realiza prin volatilizarea ca urmare a incalzirii cand produsii sunt volatili, prin precipitare in cazul produsilor greu solubili etc.
Temperatura influenteaza echilibrul chimic la reactiile insotite de absorbtie sau degajare de caldura, acestea fiind exoterme intr-un sens si endoterme in celalalt sens. Echiibrul se deplaseaza intr-un sens sau altul la incalzire sau la racire.
Presiunea determina deplasarea echilibrului chimic numai la reactiile intre gaze, care sunt urmate de variatii de volum. Astfel, cresterea presiunii favorizeaza procesele care decurg cu micsorare de volum iar reducerea presiunii favorizeaza reactiile in care au loc mariri de volum.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2026 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Documente online pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








