
| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina TUMORI MALIGNE ALE GLANDEI MAMARE - morfopatologie, carcinoamele invazive |
TUMORI MALIGNE ALE GLANDEI MAMARE - morfopatologie, carcinoamele invazive
Glanda mamara reprezinta cea mai frecventa localizare a proceselor neoplazice la femei; cancerul glandei mamare constituie o importanta componenta o morbiditatii si una din cauzele frecvente de mortalitate in populatia generala, in conditiile in care neoplaziile mamare la barbati sunt rare.
Procesele neoplazice ale celorlalte structuri ale sanului (piele, tesut conjunctiv) apar cu aceeasi frecventa si cu aceleasi caracteristici ca si in alte localizari.
1. Epidemiologie, factori de risc, etiopatogenie:
La femei, riscul de a dezvolta cancer mamar pe parcursul intregii vieti este de 12.6% (una din 8 femei); astfel, cancerul de san este cea mai frecventa neoplazie la femei si este responsabil de 30% din cazurile noi de cancer in populatia generala in fiecare an. In ciuda perfectionarii metodelor de screening si tratament, mai mult de jumatate din femeile afectate mor din cauza acestei boli (procentul este mai mare in Romania); cancerul de san reprezinta a doua cauza de mortalitate prin cancer la femei, dupa cancerul pulmonar. De remarcat ca, in ciuda progresului medicinei in general si a studiilor intensive in acest domeniu in special, mortalitatea prin cancer de san a ramas relativ stabila de la 1950; mortalitatea la femeile afectate a scazut in ultima vreme la cele in premenopauza si a crescut la cele in postmenopauza; grupurile cu cea mai mare mortalitate sunt cele cu varste extreme, sub 35 de ani si peste 75 de ani.
Etiologia bolii este necunoscuta si, ca la majoritatea neoplaziilor (cu exceptia celor cu transmitere genetica directa) este presupusa a fi multifactoriala. Desi factorii determinanti direct nu au fost stabiliti, sunt discutati o serie de factori de risc:
exogeni: iradierea, expunerea la soare, dieta, traumatismele repetate, factorii virali, medicatia (mai ales medicatia hormonala - anticonceptionalele orale si substitutia estrogenica);
endogeni: varsta, menarha precoce si menopauza tardiva, nuliparitatea sau prima sarcina dupa 30 de ani, lipsa alaptatului la san, hiperestrogenismul si alte tulburari endocrine, tumorile benigne sau leziunile distrofice si precanceroase ale glandei mamare.
Un factor de risc mult discutat este istoricul familial de cancer de san; daca in cazul transmiterii directe a defectelor genetice specifice cum ar fi mutatiile genelor BRCA [BReast CAncer gene 1, respectiv BReast CAncer gene 2], specifice cancerului de san, situatia este clarificata (ceea ce ii face pe multi sa indice mastectomia profilactica de principiu), in ceea ce priveste istoricul de agregare familiala care ar presupune o predispozitie genetica determinata probabil poligenic, cu expresie variabila, unii autori considera ca riscul pentru descendente este mare, in timp ce altii considera ca acest risc este destul de mic (vezi capitolul despre determinarea riscului la pacientele cu istoric familial si testarea genetica pentru cancerul de san - pag. 236).
Actiunea (combinata) a unora din acesti factori ar determina in final leziuni la nivel molecular, mai ales leziuni ale materialului genetic, dintre care cele mai bine documentate in cancerul de san sunt: transformarea in oncogene a protooncogenelor c-sis, c-erbB-2, c-myc; mutatii inhibitorii ale genelor supresoare p53, RB, NM23. Exista si situatii in care alterarea materialului genetic nu apare in cursul existentei individuale, ci este mostenita, de exemplu in cazul transmiterii genetice a mutatiilor BRCA-1 si BRCA-2 in cancerul de san familial cu transmitere dominanta.
2. Morfopatologie:
Peste 95% din neoplasmele sanului deriva din elementele epiteliale ale glandei mamare (epiteliul canalelor galactofore sau al lobulilor glandulari) si sunt, prin urmare, carcinoame; termenul de carcinom mamar cuprinde in aceasta prima definire un grup foarte heterogen de situatii diferite ca aspect macroscopic si microscopic, ca tip de comportament biologic si, prin urmare, ca prognostic; astfel, carcinoamele glandei mamare pot fi impartite in doua grupuri mari:
carcinom in situ: celulele tumorale raman strict localizate in ducte sau lobuli, fara dovezi de invazie a stomei inconjuratoare la microscopia obisnuita; teoretic, din asemenea leziuni nu s-ar putea produce diseminare regionala sau la distanta, dar in practica se intalnesc cazuri de carcinoame in situ documentate histologic ca atare dar cu implicarea nodulilor regionali (vezi discutia despre tratamentul carcinomului in situ - pag. 240). O notiune care completeaza din acest punct de vedere pe aceea de carcinom in situ este cea de carcinom microinvaziv, o entitate mai putin bine definita dar care nu poate fi eludata in practica si care s-ar referi la o leziune cu invazie stromala existenta dar atat de mica incat riscul de metastazare, desi existent teoretic, sa fie neglijabil practic; o definitie acceptabila (AJCC) este aceea de carcinom cu invazie la mai putin de 0.1 cm de la membrana bazala, pe o suprafata de mai putin de 10% din suprafata specimenului (T1mic fata de Tis);
carcinom invaziv: celulele tumorale invadeaza stroma, astfel incat determina un potential important de metastazare.
a) Carcinoamele in situ sunt de doua categorii: carcinoame in situ ductale si carcinoame in situ lobulare; de mentionat ca distinctia se face mai degraba pe baza pattern-ului de crestere si a caracteristicilor citologice, decat pe baza localizarii anatomice. Carcinoamele in situ ductale si lobulare difera ca prezentare clinica, morfologie, comportament biologic si, prin urmare, ca prognostic.
![]() Carcinoamele ductale in situ cuprind un grup
heterogen de leziuni cu evolutie bio-logico-clinica greu
predictibila, astfel incat nici una din clasificarile care s-au
facut nu este pe deplin relevanta in ceea ce priveste
managementul si prognosticul lor (vezi discutia despre tratamentul
carcinomului ductal in situ). O clasificare simpla care se coreleaza
cel mai bine cu potentialul de recidiva dupa excizie
limitata imparte carcinoamele ductale in situ in carcinoame in situ de
grad inalt (high grade), de grad intermediar si de grad jos (low grade) -
clasificarea Lagio -, respectiv slab diferentiate, intermediar
diferentiate si bine diferentiate - clasificarea europeana:
Carcinoamele ductale in situ cuprind un grup
heterogen de leziuni cu evolutie bio-logico-clinica greu
predictibila, astfel incat nici una din clasificarile care s-au
facut nu este pe deplin relevanta in ceea ce priveste
managementul si prognosticul lor (vezi discutia despre tratamentul
carcinomului ductal in situ). O clasificare simpla care se coreleaza
cel mai bine cu potentialul de recidiva dupa excizie
limitata imparte carcinoamele ductale in situ in carcinoame in situ de
grad inalt (high grade), de grad intermediar si de grad jos (low grade) -
clasificarea Lagio -, respectiv slab diferentiate, intermediar
diferentiate si bine diferentiate - clasificarea europeana:
carcinoamele in situ de grad inalt prezinta aneuploidie, hiperexpresia onco-genei c-erbB-2, mutatii ale genei p53, rata de proliferare mare, lipsa receptori-lor pentru estrogen si progesteron, angiogeneza in stroma inconjuratoare;
carcinoamele in situ de grad jos au rata de proliferare mica, foarte rar prezinta
alterari ale marker-ilor biologici, sunt pozitive pentru receptorii de estrogen si
progesteron;
carcinoamele intermediare se situeaza intre aceste doua modele atat in ceea ce priveste morfologia cat si in ceea ce priveste frecventa alterarilor marker-ilor biologici.
![]() Carcinoamele lobulare in situ au, spre
deosebire de cele ductale, un aspect omo-gen si un comportament biologic
foarte putin agresiv (mai putin agresiv decat al celor ductale in
situ low grade); nu se prezinta niciodata clinic ca o masa
palpapila si nu au caracteristici speciale mamografice, asa
ca reprezinta o descoperire microscopica intamplatoare;
aceste motive fac ca in ultima vreme carcinomul lobular in situ sa fie
privit mai putin ca o neoplazie per se si mai mult ca un marker al riscului de dezvoltate al unui
carcinom invaziv (riscul de aparitie a unui carcinom invaziv la
pacientele cu carcinom lobular in situ este de 1% pe an pe tot parcursul
vietii, dar neoplaziile invazive care apar nu au legatura
topografica sau asemanare histologica cu carcinomul in situ
descoperit).
Carcinoamele lobulare in situ au, spre
deosebire de cele ductale, un aspect omo-gen si un comportament biologic
foarte putin agresiv (mai putin agresiv decat al celor ductale in
situ low grade); nu se prezinta niciodata clinic ca o masa
palpapila si nu au caracteristici speciale mamografice, asa
ca reprezinta o descoperire microscopica intamplatoare;
aceste motive fac ca in ultima vreme carcinomul lobular in situ sa fie
privit mai putin ca o neoplazie per se si mai mult ca un marker al riscului de dezvoltate al unui
carcinom invaziv (riscul de aparitie a unui carcinom invaziv la
pacientele cu carcinom lobular in situ este de 1% pe an pe tot parcursul
vietii, dar neoplaziile invazive care apar nu au legatura
topografica sau asemanare histologica cu carcinomul in situ
descoperit).
b) Carcinoamele invazive se clasifica in:
infiltrativ ductal sau comun, cel mai frecvent, 70-80%; poate fi bine diferentiat, intermediar sau slab diferentiat; in proportii variabile se asociaza carcinom ductal in situ care reprezinta un factor de prognostic important la pacientele tratate cu chirurgie conservatoare pe san;
invaziv lobular, al 2-lea ca frecventa, 5-10%, in mod clasic cu prognostic mai bun ca primul; deseori se asociaza carcinom lobular in situ, frecvent bilateral si multicentric;
tubular, poate reprezenta pana la 10% din carcinoamele de san si are un prognostic mult mai bun decat cel ductal invaziv, desi in 75% din cazuri se asociaza cu carcinom ductal in situ low grade; reprezinta invadarea stromei de structuri foarte asemanatoare cu structuri glandulare normale;
mucinos (coloid), 1-2%, apare mai frecvent la pacientii in varsta si are prognostic favorabil;
medular
papilar, metaplazic, adenoid chistic etc., 1-2%;
forme speciale: boala Paget (carcinom in situ cu punct de plecare canalele galacto-fore) si carcinomul inflamator, o forma a cancerului de san avansat local care va fi discutata separat.
c) Carcinomul inflamator poate fi primar (rar) sau secundar (recidiva inflamatorie); este o forma agresiva de carcinom, intens angiogenic si angioinvaziv; la prezentare, aproape toate pacientele au interesare ganglionara si mai mult de o treime au meta-staze sistemice; biopsia tegumentelor sanului evidentiaza emboli tumorali in limfa-ticele superficiale; prognosticul vital este prost. Acest tip de boala, incadrata intre for-mele de cancer de san avansat local, nu reprezinta un tip histologic special, in cele mai multe cazuri tumora fiind de tip ductal, dar capacitatea foarte mare de angiogeneza pare a fi o caracteristica intrinseca a tumorii. Din punct de vedere al cineticii celulare, rata de crestere este foarte mare; din punct de vedere al geneticii moleculare, sunt prezente alterari comune cu alte carcinoame (hiperexpresia c-erbB-2, mutatia p53) si alterari specifice carcinomului inflamator (hiperexpresia RhoC-GTP-asei si pierderea LIBC, un factor de crestere insulin-like).
3. Evolutie:
Se admite ca neoplsmul de san are o evolutie infraclinica indelungata, uneori de mai multi ani, pana sa poata fi descoperit clinic sau imagistic; se pare chiar ca multe din aceste forme infraclinice nu progreseaza niciodata spre manifestari clinice, ci stagneaza sau sunt rezolvate spontan. Din momentul in care devine o tumora palpabila (aproximativ 1cm), cancerul de san are, de obicei, o evolutie locala care poate dura 1-2 ani; local, carcinomul mamar poate evolua prin: extensie directa de-a lungul traveelor conjunctive si canalelor galactofore; invazia sau permeatia limfaticelor sau capilarelor (permeatia in limfaticele dermice determina noduli de permeatie, care, daca sunt localizati in regiunea mamara, sunt considerati categorie T4b, iar daca sunt localizati la distanta, sunt considerati categorie Mskin); diseminarea se produce discontinuu in mamelon, motiv pentru care acesta trebuie examinat histologic separat.
In timp, extensia locala a tumorii se face in profunzime (spre fascia pectorala pe care o invadeaza si spre peretele toracic la care se poate fixa) si superficial (spre tegumente, care devin ulcerate, cu suprainfectie si hemoragie); amandoua aceste situatii, fixarea la peretele toracic si invadarea macroscopica a tegumentelor, se incadreaza in notiunea de cancer de san avansat local.
In cam 30% din cazuri, neoplasmul de san nu evolueaza dupa acest model de crestere progresiva locala, ci are o evolutie rapida sau chiar fulminanta, cu diseminare sistemica la prezentare, uneori in ciuda unei situatii locale nu foarte grave (in 0.5% din carcinoamele de san diseminate sistemic, tumora primara nu poate fi evidentiata).
Urmatoarele etape in evolutia carcinomului mamar sunt: evolutia regionala si diseminarea sistemica.
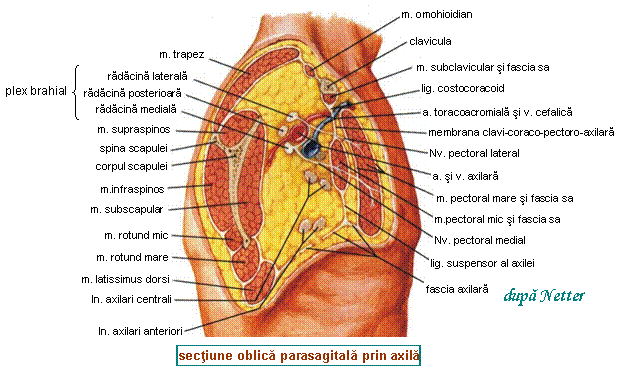
![]() Evolutia regionala se face cu
implicarea limfonodulilor regionali; cel mai frecvent invadati de procesul
neoplazic sunt ganglionii: axilari,
mamari interni si supraclaviculari; invadarea grupelor ganglionare se
produce cu frecventa diferita, iar semnificatia
prognostica este de asemenea diferita; riscul ca o anume grupa
limfonodulara sa fie invadata poate fi evaluat in functie
de diversi factori (discutia este importanta la pacientele cu
cancer incipient la care se pune problema daca tratarea axilei este sau nu
necesara, la cazurile cu situatie clinica N0, etc
→ vezi tratamentul cancerului mamar - pag. 241).
Evolutia regionala se face cu
implicarea limfonodulilor regionali; cel mai frecvent invadati de procesul
neoplazic sunt ganglionii: axilari,
mamari interni si supraclaviculari; invadarea grupelor ganglionare se
produce cu frecventa diferita, iar semnificatia
prognostica este de asemenea diferita; riscul ca o anume grupa
limfonodulara sa fie invadata poate fi evaluat in functie
de diversi factori (discutia este importanta la pacientele cu
cancer incipient la care se pune problema daca tratarea axilei este sau nu
necesara, la cazurile cu situatie clinica N0, etc
→ vezi tratamentul cancerului mamar - pag. 241).
|
Ganglonii limfatici axilari: primesc 85% din drenajul limfatic din toate cadranele sanului; factorii de risc pentru invadarea lor sunt legati de: dimensiunile tumorii si marginile postrezectie ale acesteia, localizarea tumorii (risc mai mare pentru tumorile laterale decat pentru cele situte mai medial), caracteristicile histologice ale tumorii, prezenta invaziei limfatice.
Ganglionii limfatici mamari interni: primesc de asemenea limfa din toate cadranele sanului; cel mai fecvent contin metastaze primii trei limfonoduli din cei patru, dar ganglionii mamari interni sunt rareori singurul sediu al metastazelor ganglionare; sunt mai frecvent implicati in cazul tumorilor situate medial; ideea ca implicarea lor indica un prognostic mai grav pare a se infirma si, oricum, practicarea chimioterapiei si la pacientele cu noduli axilari negativi a diminuat mult importanta invadarii limfono-dulilor mamari interni in prognosticul cancerului de san.
Ganglionii limfatici supraclaviculari: invadarea lor reprezinta un stadiu tardiv si cu prognostic grav al bolii metastatice regionale (de fapt, invadarea lor este considerata metastazare la distanta a cancerului de san); invadarea limfonodulilor supraclaviculari este asociata de obicei cu invadare axilara masiva, dar ocazional poate aparea si in lipsa acesteia (skip metastases).
![]() Diseminarea sistemica se produce cel mai
frecvent in os, ficat si plaman; sistemul nervos central este rareori
implicat (5%); metastazele care apar la pacientii tratati sunt
localizate in 50-75% din cazuri intr-un singur organ.
Diseminarea sistemica se produce cel mai
frecvent in os, ficat si plaman; sistemul nervos central este rareori
implicat (5%); metastazele care apar la pacientii tratati sunt
localizate in 50-75% din cazuri intr-un singur organ.
4. Diagnostic
a) Screeningul pentru cancer de san: este unul din tipurile de screening care si-a dovedit utilitatea in practica, avand un impact considerabil asupra prognosticului vital in aceasta afectiune; cuprinde doua aspecte:
- autoevaluarea si examenul clinic periodic, pentru detectarea formelor clinice de boala;
- mamografia pentru determinarea formelor infraclinice de boala, deziderat de mare importanta deoarece cancerul mamar in forma preclinica este considerat curabil. Nu exista inca un consens asupra varstei la care ar trebui sa inceapa si a varstei la care ar trebui sa inceteze efectuarea de mamografii periodice, dar mai multe studii au aratat beneficiul efectuarii unei mamografii pe an la pacientele din grupul de varsta 50-70 de ani, respectiv o data la 2 ani in cazul pacientelor cu varsta cuprinsa intre 40-50 ani si antecedente heredocolaterale absente (prezenta antecedentelor heredocolaterale impune reducerea intervalului de screening la jumatate). In ultima vreme, multi autori sunt de parere ca mamografia nu ar trebui sa fie o analiza de prima intentie la pacientele sub 35 de ani, chiar in prezenta unor mase mamare, investigatia respectiva fiind greu de interpretat din cauza caracteristicilor tesutului mamar la acea varsta.
b) Evaluarea riscului la persoane cu istoric familial si testarea genetica pentru cancerul de san cu transmitere familiala: Problema critica este identificarea, dintre pacientele cu istoric familial de cancer de san, a acelora cu cancer ereditar de san (paciente care au probabilitate mare sa fi mostenit mutatii genetice specifice implicate in geneza carcinomului mamar). Istoricul familial la persoane fara mutatii genetice specifice transmisibile nu mai este considerat indicator al unui risc inalt de dezvoltare a carcinomului mamar. Date sugestive pentru transmiterea familiala dominanta a cancerului de san sunt: mai multe rude de sex feminin afectate, cu cancer de san si de ovar instalat de obicei la varste tinere; rude cu mai mult de un cancer primar, de exemplu cancer de san si de ovar sau cancer de san bilateral; transmiterea verticala pe mai mult de doua generatii, inclusiv prin descendenti de sex masculin; forme rare de cancer.
Majoritatea cancerelor ereditare de san apar ca urmare a mutatiilor genelor supre-soare tumorale BRCA1 si BRCA2 alte mutatii genetice, care pot determina cancer de
san in cadrul sindroamelor familiale Li-Fraumeni, Muire-Torre, Peutz-Jeghers, ata-
xie-teleangiectazie, etc., sunt rare. De aceea, in caz de suspiciune de cancer ereditar de san, se face testare genetica pentru mutatii ale genelor BRCA1 si BRCA2.
c) Evaluarea maselor mamare si diagnosticul diferential al cancerului de san: Prezenta unei mase mamare este o situatie frecventa (16% dintre femeile intre 30 - 69 de ani, in fiecare an), dar numai 4-8% dintre pacientele care se prezinta cu mase mamare au cancer de san; astfel, daca o masa mamara ridica in majoritatea situatiilor si suspiciunea de cancer de san, in toate cazurile trebuie facut diagnosticul diferential cu alte afectiuni care pot avea aceasta prezentare clinica. Cele mai folosite metode pentru evaluarea maselor mamare sunt:
 examenul clinic: caracteristicile
care sugereaza malignitatea la examenul clinic sunt: leziune unica,
consistenta dura, delimi-tare proasta sau fixare, diametru
mai mare de 2 cm; caracterul citat clasic de absenta a durerii nu mai
este considerat folositor, pana la 35% din cancerele mamare fiind
insotite de durere;
examenul clinic: caracteristicile
care sugereaza malignitatea la examenul clinic sunt: leziune unica,
consistenta dura, delimi-tare proasta sau fixare, diametru
mai mare de 2 cm; caracterul citat clasic de absenta a durerii nu mai
este considerat folositor, pana la 35% din cancerele mamare fiind
insotite de durere;
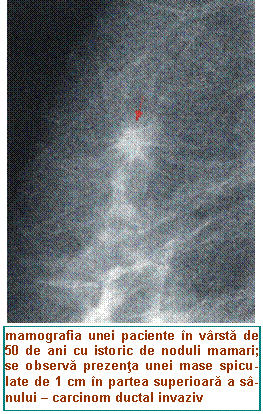
mamografia (la pacientele peste 35 de ani) → aspectele care exprima malignitate sunt: densita-te crescuta, margini neregulate, spiculi, clustere de microcalcifi-cari;
aspiratia pe ac subtire (FNA), care poate evidentia sangerare intrachistica sau atipii celulare.
Notiunea de triplu diagnostic se refera la faptul ca rezultate negative la toate cele trei pro-be descrise mai sus infirma suspiciunea de cancer de san, in timp ce trei rezutate pozitive confirma diagnosticul de cancer de san (diagnosticul final este in acest ultim caz histopatologic).
Biopsia cu ac gros este folosita mai ales pentru diagnosticul maselor mamare nepalpabile, in conjunctie cu mamografia stereotaxica sau cu ghidajul ultrasonografic (este cea mai valoroasa metoda in diagnosticul hiperpaziei atipice).
Biopsia excizionala stabileste diagnosticul histologic si poate rezolva leziunile delimitate; trebuie practicata cu margine de siguranta oncologica.
Ultrasonografia poate diferentia tumorile chistice de cele solide si este folosita la pacientele fara indicatie de mamografie, la pacientele care refuza aspiratia, precum si in urmarirea maselor mamare dupa un prim diagnostic de benignitate.
CT si RMN sunt folosite mai rar in evaluarea initiala.
d) Evaluarea diagnostica a cancerului de san si stadializarea initiala: diagnosticul cancerului de san se face dupa doi algoritmi diferiti, unul care porneste de la anomalii mamogafice si altul care porneste de la mase mamare evidente clinic.
Anomalii mamografice: se repeta mamografia; daca imaginea se mentine si daca este sugestiva pentru proces malign, se face evaluare locala de catre chirurg sau oncolog; daca leziunea nu este aparenta clinic, se face punctie ghidata stereotaxic; daca se gaseste o masa mamara, se face FNA dupa tehnica obisnuita. Daca rezultatul final este leziune benigna, optiunea este reevaluare din 6 in 6 luni; daca se diagnosticheaza o leziune maligna, tratamentul chirurgical radical este recomandat.
Mase mamare evidente clinic: La femeile tinere, FNA sau echografia sunt recomandate ca prim pas; daca acestea sustin suspiciunea de cancer, se recurge la mamografie si in continuare la biopsie; daca rezultatul acestei evaluari initiale este cancer, o mamografie bilaterala este necesara chiar daca, in ceea ce priveste leziunea initiala, acuratetea acesteia este alterata de biopsia anterioara. La femeile in varsta, primul gest in caz de masa mamara evidenta este o mamografie bilaterala, chiar daca suspiciunea de tumora maligna poate fi sustinuta clinic, nu atat pentru confirmarea diagnosticului de cancer mamar cat pentru evidentierea eventualelor leziuni concomitente, care pot influenta decizia terapeutica; acest gest trebuie facut inaintea FNA sau a oricarui alt tip de biopsie, deoarece biopsia modifica aspectul mamografic si ultasonografic. Daca tumora este destul de mare cat sa contraindice chirurgia conservatoare, aceasta discutie este mai putin importanta.
Dupa ce diagnosticul de cancer mamar este stabilit, in continuare este necesara investigarea eventualei boli sistemice. Tomografia computerizata este necesara pentru planificarea tratamentului radioterapeuric, dar nu este obligatorie pentru evidentierea metastazelor; markerii tumorali nu sunt utili in acest stadiu initial al diagnosticului. Stadializarea initiala este doar o stadializare orientativa, stadializarea completa se poate face doar postoperator.
e) Stadializarea TNM a cancerului de san elaborata de American Joint Commit-tee on Cancer (AJCC) in 1997:
![]() stadiul T:
stadiul T:
Tx - tumora primara nu poate fi evaluata;
T0 - fara evidenta de tumora primara;
Tis - carcinom in situ (intraductal, lobular sau boala Paget cu localizare strict mame-lonara);
T1 - tumora < 2 cm:
T1mic - microinvazie,
T1a - tumora intre 0.1-0.5 cm (diametru maxim),
T1b - tumora intre 0.5-1 cm (diametru maxim),
T1c - tumora intre 1-2 cm;
T2 - tumora intre 2-5 cm;
T3 - tumora > 5 cm;
T4 - tumora indiferent de marime cu extensie directa la peretele toracic sau tegument:
T4a - tumora cu extensie la peretele toracic,
T4b - tumora cu extensie la tegument (inclusiv aspectul de "coaja de portocala" sau noduli de permeatie limitati la sanul respectiv),
T4c - T4a + T4b,
T4d - carcinom inflamator (mastita carcinomatoasa).
![]() stadiul N:
stadiul N:
Nx - limfonodulii regionali nu pot fi evaluati (inclusiv in caz de reinterventie);
N0 - fara metastaze limfonodulare;
N1 - metastaze in limfonodulii axilari ipsilaterali cu mobilitate pastrata;
N2 - metastaze cu fixare a limfonodulilor axilari ipsilaterali;
N3 - metastaze in limfonodulii mamari interni ipsilaterali;
![]() stadiul pN (evaluarea postoperatorie a
limfonodulilor - vezi discutia despre nivelu-rile de disectie
axilara):
stadiul pN (evaluarea postoperatorie a
limfonodulilor - vezi discutia despre nivelu-rile de disectie
axilara):
pNx - limfonodulii regionali nu pot fi evaluati (rezecati anterior sau nerezecabili);
pN1 - metastaze in limfonodulii axilari ipsilaterali cu mobilitate pastrata:
pN1a - micrometastaze (< 0.2 cm),
pN1b - metastaze > 0.2 cm,
pN1bi - implicare a 1-3 noduli cu metastaze 0.2-2 cm,
pN1bii - implicare a 4 noduli cu metastaze 0.2-2 cm,
pN1biii - metastaza limfonodulara < 2 cm cu extensie extracapsulara,
pN1biv - metastaza limfonodulara > 2 cm;
pN2 - metastaze cu fixare a limfonodulilor axilari ipsilaterali;
pN3 - metastaze in limfonodulii mamari interni ipsilaterali;
![]() stadiul M:
stadiul M:
Mx - boala sistemica nu poate fi evaluata,
M0 - fara metastaze la distanta,
M1 - metastaze la distanta (inclusiv implicarea ln. supraclaviculari sau contralaterali).
f) Masurarea factorilor de prognostic: evaluarea prognosticului trebuie sa fie una din etapele initiale ale evaluarii pacientelor cu cancer de san; trebuie avute in vedere doua aspecte: stabilirirea tiparului predictibil de evolutie a bolii si stabilirea gradului previzibil de raspuns la schema terapeutica; din acest punct de vedere, exista doua categorii de indicatori:
factorii prognostici dau informatii asupra posibilei evolutii a situatiei clinice din momentul diagnosticului, independent de terapie; de obicei, sunt indicatori de crestere, invazie sau de potential de metastazare;
factorii predictivi indica probabilitatea de raspuns la o anumita terapie si sunt de obicei legati de mecanismele prin care actioneaza sau de fenomenele produse de terapia respectiva.
Astfel, starea ganglionilor regionali este un indicator prognostic important dar nu furnizeaza date despre probabilitatea de raspuns la radioterapie sau chimioterapie. Statusul receptorilor hormonali este un factor predictiv deoarece exprima posibilitatea de raspuns la tratament hormonal, dar rolul sau ca factor prognostic este inca neclar (se pare ca tumorile hormonodependente dau caracteristic metastaze osoase si somatice, care nu sunt fatale, in timp ce tumorile hormonoindependente dau in primul rand metastaze viscerale - in plaman, ficat, creier - care reprezinta cauza mortii). Tipul expresiei oncogenei HER 2/neu (c-erbB-2) ar reprezenta un factor prognostic important si ar putea in acelasi timp sa furnizeze date predictive despre raspunsul la chimioterapie.
Singurii factori de prognostic cu valoare statistic dovedita sunt: statusul ganglionilor regionali, volumul tumoral, tipul histologic si gradul de diferentiere al tumorii; invazia intralimfatica pare un factor prognostic important la pacientele cu ganglioni negativi. Din aceste date reiese ca examinarea histopatologica de rutina ramane elementul critic in determinrea prognosticului cancerului de san
Starea ADN-ului celular nu s-a dovedit, in ciuda asteptarilor, un factor de prognostic independent in cancerul de san. Markerii de proliferare pot servi ca factori prognostici. Desi maarkerii biologici (citologici) nu au fost inca studiati pe serii controlate mari, cel putin hiperexpresia oncogenei HER 2/neu pare a fi un factor prognostic folositor.
5. Tratament:
Tratamentul cancerului de san este un tratament complex multimodal care utilizeaza sinergic toate mijloacele terapeutice din oncologie (chirurgie, chimioterapie, radioterapie, hormonoterapie, imunostimulare) si care ia in consideratie de la inceput, din necesitate clinica actuala sau de principiu, toate posibilele localizari in organism ale procesului neoplazic cu punct de plecare mamar. Totusi, pentru claritate, va fi prezentat separat tratamentul diferitelor localizari ale procesului neoplazic (tumora primara de san, ganglioni regionali, metastaze sistemice).
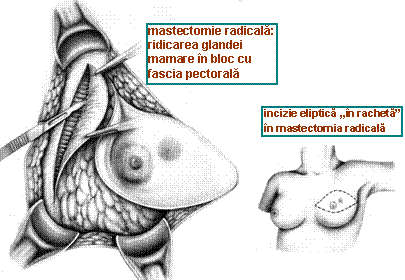
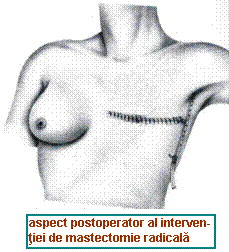
a) Tratamentul tumorii primare: se face in functie de stadiul local (incipient, invaziv, avansat) si de situatia generala. De la inceput trebuie precizat ca, de cand se poate apela la tratamente adjuvante efective cum sunt chimioterapia si radioterapia, tendinta este sa se renunte la interventiile chirurgicale radicale, si cu atat mai mult la cele supraradicale de tip Urban (asociere a exciziei limfonodulilor mamari interni) sau Wangenstiel (asociere a exciziei limfonodulilor supraclaviculari), in favoarea unor interventii mai conservatoare pe glanda mamara; totusi, de principiu, mastectomia radicala Halsted (ridica glanda mamara impreuna cu muschii pectorali) trebuie practicata la cazurile cu invazie a muschilor pectorali sau cu invazie masiva a axilei.
Tratamentul cancerului de san incipient: se prefera in prezent chirurgia conservatoare pe san si tratament adjuvant (radioterapie si, inca in discutie, chimioterapie, hormonoterapie cu Tamoxifen sau Raloxifen); excizia (sectorectomia) trebuie sa aiba o margine de siguranta de cel putin 2 cm, cu verificare histologica postoperatorie a marginilor specimenului de excizie; de fapt, atitudinea acceptata acum consta in mamografia postoperatorie a specimenului de excizie. Mastectomia ramane varianta de ales in cazurile neclare histologic sau neinvestigate corespunzator si are aproape intotdeauna rezultate curative in stadiile incipiente ale bolii.
Tratamentul cancerului de san invaziv: atitudinea clasica este mastectomia radicala (Halsted) sau variantele modificate ale acesteia: Patey (conserva m. mare pectoral), Madden (ridica glanda mamara impreuna cu fascia pectorala, conservand ambii pectorali), Chiricuta ("himerizare" a pectoralilor prin denervare); operatia cea mai practi-cata in prezent este mastectomia radicala modificata cu indepartarea unora din limfo-nodulii axilari (vezi tatamentul ganglionilor). Se pare insa ca si aceste interventii "mai putin radicale" reprezinta un exces interventionist pentru realizarea controlului local, in timp ce oricum nu pot realiza prin ele insele un control al bolii subclinice sistemice. De aceea, in ultima vreme s-a ajuns sa se opteze si in carcinomul de san invaziv, cand situatia locala o permite, pentru interventii conservatoare pe san, asociate cu disectie limfatica corespunzatoare si tratament adjuvant. Metoda QU.A.RT. se refera la: cvadrantectomie + disectie axilara + radioterapie.
Contraindicatiile terapiei conservatoare pe san sunt legate mai mult de contraindicarea radioterapiei care ar trebui sa urmeze: istoric de iradiere a sanului, sarcina, boli de colagen. Prezenta mai multor tumori in cadrane diferite sau afectarea difuza a sanului, precum si marginile pozitive ale extemporaneului la excizie, reprezinta contraindica-tii absolute pentru terapia conservatoare; marimea tumorii nu reprezinta o contraindicatie absoluta, desi rareori terapia conservatoare se soldeaza cu succes in cazul tumorilor mai mari de 4-5 cm.
Tratamentul cancerului de san avansat local si al carcinomului inflamator (stadiile IIIA si IIIB TNM): de principiu nu se incepe cu tratament chirurgical, ci cu terapie neoadjuvanta, care in cazul carcinomului inflamator (T4d local, IIIB TNM) consta in mod specific in chimioterapie de inductie cu sustinerea hematopoiezei si radioterapie accelerata hiperfractionata; totusi, uneori poate fi necesara la inceput o interventie chirurgicala "de curatire"; intentia de radicalitate chirurgicala e considerata depasita.
|
clasificare pe grupe stadiale ce rezulta din clasificarea TNM |
|||
|
|
Tis |
N0 |
M0 |
|
I |
T1 |
N0 |
M0 |
|
IIA |
T0 T1 T2 |
N1 N1 N0 |
M0 M0 M0 |
|
IIB |
T2 T3 |
N1 N0 |
M0 M0 |
|
IIIA |
T0 T1 T2 T3 T3 |
N2 N2 N2 N1 N2 |
M0 M0 M0 M0 M0 |
|
IIIB |
T4 orice T |
orice N N3 |
M0 M0 |
|
IV |
orice T |
orice N |
M1 |
b) Tratamentul axilei: Disectia si evidarea limfonodulara axilara constituie in mod traditional un gest de rutina in managementul cancerului de san considerat curabil, avand beneficiu atat in controlul bolii cat si in diagnostic si prognostic (stadializare); de obicei, se prefera o disectie de nivel II, desi s-au semnalat rare cazuri in care lim-fonodulii apicali au fost invadati fara interesarea limfonodulilor de nivel I si II (skip metastases); disectia axilara de nivel II ar trebui sa produca in medie 10 limfonoduli. Rezectia limfonodulilor de nivel III nu este necesara pentru stadializare, dar daca intraoperator se descopera ganglioni de nivel III invadati macroscopic, acestia trebuie indepartati. In ultima vreme s-a dovedit ca iradierea are rezultate terapeutice echivalente cu disectia axilei, fara a avea insa aceleasi avantaje in definitivarea diag-nosticului si stabilirea prognosticului. In cazurile in care nu este sigur ca tratamentul axilei este necesar, se poate recurge la metoda "ganglionului santinela".
|
status |
starea axilei |
caracter tumoral |
indicatie |
|
premenopauza |
|
favorabil/ nefavorabil |
chimioterapie combinata |
|
pre |
|
nefavorabil |
ħ chimioterapie combinata |
|
pre |
|
favorabil |
fara argumente pentru beneficiul terapiei sistemice |
|
postmenopauza |
|
nefavorabil |
tamoxifen + chimioterapie |
|
post |
|
favorabil |
tamoxifen + chimioterapie |
|
post |
|
nefavorabil |
fara argumente pentru beneficiul terapiei sistemice |
|
post |
|
favorabil |
fara argumente pentru beneficiul terapiei sistemice |
Starea limfonodulilor regionali este un element-cheie diagnostico-prognostic, in functie de aceasta stabilindu-se daca exista suspiciunea de boala sistemica subclinica si deci indicatia de terapie sistemica; recomandarile recente (Sabiston 1997) in ceea ce priveste terapia sistemica la diverse grupe de paciente sunt prezentate in tabelul anterior.
c) Tratamentul metastazelor: Deoarece este improbabil ca pacientii cu metastaze sa fie vindecati prin orice fel de terapie, inclusiv terapie sistemica agresiva, ori de cate ori este posibil se prefera tratamentele locale (chirurgie, radioterapie locala); se pot practica interventii chirurgicale "de curatire", rezectia metastazelor izolate cu prognostic vital imediat, iradierea metastazelor osoase dureroase. Este de retinut la acest capitol ca, avand in vedere comportamentul biologic specific al carcinomului mamar, chimioterapia ar trebui rezervata de fapt stadiilor considerate curabile ale acestui tip de cancer (se prefera polichimioterapia, cele mai folosite citostatice in cazul cancerului de san fiind: adryamicin, ciclofosfamida, 5-FU). Hormonoterapia poate fi folositoare in orice stadiu al bolii, iar prezenta receptorilor hormonali pentru estrogen si progesteron semnifica in orice moment al evolutiei un prognostic mai favorabil; terapia hormonala foloseste trei categorii de mijloace: procedee ablative (chirurgicale, dar posibil si radiologice → ooforectomie, adrenalectomie, hipofizectomie anterioara), medicatie antihormonala (antiestrogenice [Tamoxifen - preparat mai vechi, Raloxifen - preparat modern, cu activitate modulata pe receptorii estrogenici ai sanului si osului, cu combatere a osteoporozei], antiprogesteronice [Megestrol acetat], aminoglutetimida [antiaromataza ce inhiba producerea steroizilor in corticosuprarenala]), medicatie aditiva (Dietilstilbestrol [estrogen-like nesteroidian], androgenice, progesteronice).
6. Prognostic si monitorizare posttratament:
Prognosticul vital al pacientelor cu cancer de san s-a imbunatatit de la perfectionarea tratamentelor multimodale si, mai ales, de la punerea in practica a unor metode eficiente de screening pentru aceasta boala; metodele de screening au avut cel mai mare impact (acolo unde se practica sistematic), deoarece principalul factor de care depinde prognosticul cancerului de san este stadiul in care acesta este tratat. Un alt factor important de prognostic este comportamentul biologic al tumorii, care poate fi dedus din tipul histologic, prezenta sau absenta receptorilor hormonali, ca si din pattern-ul marker-ilor citologici. Printre factorii cu semnificatie prognostica mai pot fi citati: varsta si starea generala a pacientei, volumul tumorii, rata de crestere a tumorii, marginile specimenului de rezectie, starea ganglionilor locoregionali, existenta metastazelor la prezentare, intervalul liber de boala.
Boala poate sa reapara oricand dupa tratamentul primar al cancerului de san si tipurile de recaderi posibile sunt: recidiva locoregionala, o noua tumora primara de san si boala metastatica. Daca, pe de o parte, majoritatea recaderilor la pacientele tratate pentru cancer de san incipient apar in primii cinci ani de la tratament, pe de alta parte se citeaza recaderi si dupa intervale libere de boala mai lungi de 30 de ani, ceea ce inseamna ca vindecarea acestei boli nu trebuie privita niciodata ca o certitudine si ca monitorizarea dupa tratament a pacientelor este o problema importanta.
Metodele recomandate de urmarire posttratament sunt: anamneza si examenul clinic; autoexaminarea sanilor; mamografia. Examenul clinic ar tebui efectuat de medicul de familie, oncolog sau chirurg, la 3-6 luni in primii trei ani posttratament, la 6-12 luni in urmatorii doi ani si anual dupa aceea. Pacientele trebuie sa aiba doua mamografii de baza la 6 luni si 1 an dupa chirurgie, unii autori recomandand dupa aceea mamografii de control anual.
Metode nerecomandate in urmarirea posttratament a cancerului de san sunt:
analiza biochimica a sangelui, deorece rezultatele sunt nepecifice iar unele determinari (de exemplu enzimele hepatice) pot da rezultate fals pozitive;
antigenele specifice tumorale, deoarece de fapt sunt nespecifice si pot fi asociate si cu unele afectari benigne ale unei varietati de tesuturi;
studii radiologice (radiografii de torace, scanning osos), deorece sunt analize putin sensibile.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2026 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Esee pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








