
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Botanica
|
|
Qdidactic » didactica & scoala » botanica CULTURA PLANTELOR SUPERIOARE "IN VITRO" - componentele unui laborator pentru cultura plantelor "in vitro" |
CULTURA PLANTELOR SUPERIOARE "IN VITRO" - componentele unui laborator pentru cultura plantelor "in vitro"
1. Definirea culturilor "in vitro"
Cultura de organe, tesuturi, celule, reprezinta ansamblul de procedee prin care se asigura mentinerea subsistemelor sistemului individual pe timp nedefinit in stare dediferentiata sau in curs de rediferentiere pe medii de cultura adecvate in conditii de asepsie totala si in conditii fizico-chimice strict delimitate.
Culturile "in vitro" fac parte din domeniul vast al biotehnologiei, reprezentand o alternativa biotehnologica, de la care se asteapta elucidarea unor probleme deosebit de importante, atat pentru biologia teoretica, cat si pentru cea aplicativa.
Categoria de probleme de ordin fundamental, a caror rezolvare se intrevede, vizeaza elucidarea proceselor ce se deruleaza la nivel celular: dediferentierea si rediferentierea celulara, rolul si modalitatile concrete de actiune a hormonilor, vitaminelor.
Problemele cu caracter aplicativ, ce decurg din culturile "in vitro" sunt:
obtinerea si selectia de noi genotipuri;
stocarea, prezervarea, multiplicarea genotipurilor de certa valoare;
biosinteza de substante utile (proteine, vitamine, hormoni, alcaloizi);
devirozarea plantelor;
obtinerea de hibrizi interspecifici prin fuziune de protoplasti.
2. Componentele unui laborator pentru cultura plantelor "in vitro"
Plantele pot fi cultivate nu numai in ghivece, sera sau camp, ci si "in vitro", adica "in sticla" (vasele de cultura au fost confectionate initial din sticla), pe medii nutritive adecvate, intr-un ambient steril.
Cultura "in vitro" se realizeaza pe suprafete mici, in conditii de mediu controlate, la parametrii fizici, nutritivi si horrmonali optimi, in absenta microorganismelor (bacterii, ciuperci) si virusurilor.
Practicarea culturii "in vitro" presupune existenta unui spatiu amenajat si echipat in acest scop, a unor vase din sticla sau material plastic, a mediilor de cultura adecvate, a materialuluiu biologic sub forma de celule, tesuturi, organe sau plante.
Asepsia (lipsa absoluta a microorganismelor si virusurilor) este o conditie sine qua non a reusitei fiecarei culturi "in vitro". Intrucat medile nutritive folosite cu acesta ocazie le ofera conditii optime de dezvoltare, bacteriile si ciupercile invadeaza culturile "in vitro" intr-un timp foarte scurt daca nu se asigura asepsia spatiilor de transfer, vaselor de cultura, mediului nutritiv, instrumentelor si materialului biologic cultivat.
Sursele de infectie sunt:
aerul, care contine o mare cantitate de microorganisme sub forma de spori;
materialul vegetal, la suprafata caruia se pot gasi ciuperci si/sau bacterii;
corpul uman, care vehiculeaza pe piele sau pri aerul expirat numeroase microorganisme.
Sterilizarea se poate realiza prin metode:
fizice, folosind vapori de apa sub presiune (121°C), aer uscat fierbinte (180°C), iradierea (raze ultraviolete sau gamma); aceste metode distrug microorganismele, sau efectuand filtrarea sub presiune, se elimina microorganismele al caror diametru depaseste 0,22 mm;
chimice, care constau in tratamente cu compusi sterilizanti, cum sunt hipocloritul de sodiu sau calciu, alcoolul, clorura mercurica, diversele produse bactericide si fungicide.
Spatiile necesare pentru o eficienta functionare a unui laborator de culturi "in vitro" sunt:
camera pentru prepararea mediilor de cultura;
camera pentru spalarea si sterilizarea sticlariei necesare prepararii mediilor si realizarii culturilor;
camera pentru depozitarea sticlariei, substantelor chimice, mediilor nutritive;
camera pentru initierea si transferul culturilor;
camera pentru incubarea culturilor, in conditii de temperatura controlata (17-27°C) si fotoperioada.
Dotarea minima a unui asemenea laborator include:
lupe binoculare;
microscoape optice;
balante de precizie (0,01 g) si analitice (0,0001g);
pH-metru;
autoclava;
etuve pentru sterilizat sticlaria;
dulapuri climatizate;
hote cu flux de aer laminar, orizontal sau vertical (fig. 1);
frigidere, congelatoare;
aparate pentru distilat si demineralizat apa.
Vasele de cultura si sticlaria de laborator necesare unui laborator de culturi "in vitro". Cultura "in vitro" poate fi practicata in vase de sticla sau din material plastic de forme si marimi diferite. Vasele din sticla utilizabile atat pentru prepararea mediilopr cat si pentru cultura sunt cele existente in laboratoarele de chimie: pahare Berzelius, baloane Erlenmayer, piupete, cilindri gradati, baloane cotate, vase Petri etc.
Vasele de cultura din sticla nu trebuie sa elibereze cationi toxici. Din aceasta cauza, se recomanda folosirea celor confectionate din sticla Pyrex sau borosilicat.
Desi scumpe, vasele de cultura din material plastic au inceput sa inlocuiasca vasele din sticla, deoarece prezinta numeroase avantaje. Calitatea materialului plastic face posibila atat confectionarea unor recipiente foarte variate ca forma si dimensiuni adaptate cerintelor, cat si sterilizarea acestoea la 121°C. In laboratoarele comerciale se recurge si la borcane din sticla obisnuita.
Pregatirea sticlariei ocupa un loc important in activitatea unui laborator de cultura "in vitro". Din aceasta cauza, camera destinata spalarii si sterilizarii trebuie echipata corespunzator, cu surse de apa deionizata, distilata, bidistilata si cu etuve.
Sticlaria uscata se sterilizeaza prin expunerea la aer uscat fierbinte (180°C), timp de 2-3 ore, in etuve. Alte materiale, cum sunt filtrele, apa distilata, capacele din material plastic, dopurile din bumbac sau tifon se sterilizeaza prin autoclavare (cu vapori de apa sub presiune), timp de 15-20 minute, la 121°C si 1,5 atmosfere.

Fig. 1 Hota cu flux de aer laminar
Mediile de cultura
Un mediu de cultura "in vitro" are o componenta anorganica si o componenta organica.
Mediile folosite pentru culturi statice contin si un agent gelifiant, care este agarul.
Apa folosita pentru prepararea mediilor trebuie sa fie purificata, deionizata, distilata, filtrata.
O serie de cercetatori au studiat cerintele de elemente minerale ale tesuturilor vegetale cultivate si au elaborat medii cu compozitii bine definite care le poarta numele: Murashige si Skoog (1962), Gamborg (1976), White, Schenck si Hildebrandt (1972), Nitsch si Nitsch.
Componenta anorganica a mediilor de cultura "in vitro" include elemente esentiale pentru cresterea plantelor, la care se adauga uneori aluminiul si nichelul. In functie de cantitatile in care se gasesc in diferitele formule de mediu, acestea se impart in:
macroelemente: N, P, K, S, Mg, Ca;
microelemente: B, Mn, Zn, Cu, Ni, Mo, Al, I, Fe.
Toate aceste elemente sunt incluse in mediu sub forma de saruri, alese dupa criteriul solubilitatii.
Componenta organica. Celulele si tesuturile cultivate "in vitro" nu sunt autotrofe, adica nu sunt capabile sa sintetizeze carbohidrati prin asimilarea CO2 in timpul fotosintezei. Din acest motiv, in mediile artificiale in care sunt cultivate trebuie inclusa zaharoza, in concentratie de 2-3%.
In conditii "in vivo", plantele sintetizeaza vitamine. In culturile de celule sau de tesuturi "in vitro", absenta sau insuficienta unor vitamine pot fi factori limitativi ai cresterii. De aceea, in mediile de cultura se adauga in mod curent tiamina (vitamina B1) in concentratie de 0,1-10,0 mg/l, acid nicotinic (vitamina PP) in concentratie de 0,1-5,0 mg/l, piridoxina (vitamina B6) in concentratie de 0,1-1,0 mg/l. Se mai utilizeaza biotina (vitamina H), cholina, acidul folic (vitamina M), acidul pantotenic, riboflavina (vitamina B2) si mio-inositolul.
Substantele reglatoare ale cresterii (fitohormonii, hormonii vegetali) reprezinta cea mai importanta componenta organica a unui mediu de cultura. Termenul de hormon provine din limba greaca si este utilizat in domeniul fiziologiei animale, avand sensul de mesager chimic. Fiziologia vegetala a imprumutat acest termen, desi in cazul hormonilor vegetali exista unele aspecte diferite.
Sinteza fitohormonilor poate fi localizata, dar ei pot fi sintetizati in diferite tesuturi sau chiar in anumite celule ditr-un tesut.
Fitohormonii sunt transportati si actioneaza de la distanta, dar pot actiona si in tesutul in care au fost sintetizati. De pilda, citochininele sunt transportate de la radacina la frunze, unde intervin in prevenirea senescentei, in timp ce etilena actioneaza in acelasi tesut in care a fost sintetizata.
In ceea ce priveste mecanismul de control al acestor fitohormoni, Trewavas semnaleaza anumite modificari ale sensibilitatii tesuturilor la anumiti compusi. De aceea s-a propus inlocuirea termenului de fitohormon cu regulator de crestere sau substanta de crestere.
Substantele bioactive, endogene si/sau sintetice, care regleaza procesele de crestere si dezvoltare la plante se clasifica in trei grupe:
stimulatoare;
retardante;
inhibitoare.
Aceste trei grupe de substante se interconditioneaza reciproc, astfel ca reactiile plantelor in toate fazele de crestere si dezvoltare, reprezinta rezultatul unui echilibru intre produsii stimulatori si cei inhibitori. In categoria substantelor stimulatoare se disting trei categorii de compusi si anume:
auxine;
citochinine;
gibereline.
In cazul culturilor vegetale "in vitro", fitohormonii orienteaza procesele de dezvoltare.
Auxinele sunt compusi naturali, fiziologic polivalenti, care in doze extrem de reduse pot influenta atat cresterea, cat si dezvoltarea plantelor, respectiv formarea organelor vegetative si generative. Ele se acumuleaza preferential in organele cu crestere activa: muguri, frunze tinere, varfuri de tulpini si radacini, antere, graunciori de polen, cotiledoane, seminte imature, cambiu etc.
Cele mai folosite auxine pentru culturile vegetale "in vitro" sunt: AIA (acidul indolil acetic) (auxina naturala), AIB (acidul indiolil butiric), ANA (acidul naftil acetic), 2,4-D (acidul 2,4-diclorofenoxiacetic), fiecare necesitand concentratii de 0,01-10,0 mg/l.
Auxinele naturale si sintetice exercita diferite actiuni fiziologice, care declanseaza reactii particulare de crestere, dezvoltare si metabolism. Acestea sunt:
Modificari citologice. Tratamentul cu auxine intensifica cresterea prin modificarea volumului celular, alungirea membranei plasmatice si ingrosarea ei prin depunerea de noi substante formative. In concentratii scazute, auxinele stimuleaza diviziunea celulara, in timp ce in concentratie ridicata stimuleaza elongatia celulara.
Stimularea germinarii semintelor. Tratamentele cu AIA, 2,4-D si ANA maresc energia germoinativa a semintelor.
Efecte asupra inradacinarii butasilor. AIA, ANA si 2,4-D stimuleaza formarea radacinilor, care in mod normal se inradacineaza greiu prin butasi (Rosa, Clematis, Magnolia).
Stimuleaza inmugurirea si inflorirea. In doze mari, auxinele mentin in stare de latenta mugurii pomilor fructifer sau pe cei ai tuberculilor de cartof. In declansarea infloririi, uu rol activ il au auxinele endogene existente in ovar, la baza inflorescentei si in pedunculul florii. Polenul contine, de asemenea, auxine implicate in cresterea tubului polinic.
Efecte asupra formarii si caderii fructelor. In timpul polenizarii si fecundarii are loc biosinteza auxinelor naturale. Cresterea fructului este stimulata de auxinele sintetizate in seminte, de unde difuzeaza in pulpa fructului si declanseaza extensia celulelor. Prin administrarea auxinelor exogene este posibila formarea fructelor fara polenizare, obtinerea fructelor partenocarpice (fara seminte) la tomate, vita de vie, mar, par, citrice, cucurbitacee etc.
Intarzierea imbatranirii tesuturilor se poate realiza prin tratamente cu auxine, ceea ce poate fi asociat cu mentinerea unui anumit nivel al proteinelor si acizilor nucleici.
Citochininele includ substante care determina efecte fiziologice legate de reglarea diviziunii celulare, cresterea celulei prin extensie, diferentierea si organogeneza. Prezenta citochininelor in vasele conducatoare lemnoase (xilem) arata ca sinteza acestor substante se face in radacini, de unde migreaza catre varful plantei si se acumuleaza in fructe, frunze si muguri. Migratia citochininelor se face concomitent cu curentul care asigura transpiratia.
Cele mai folosite citochinine pentru culturile vegetale "in vitro" sunt: kinetina, BAP (benzil aminopurina), 2IP (2 izopentenil adenina), zeatina. Citochininele endogene deriva din degradarea acizilor nucleici, trecand prin faza de nucleotide. Citochininele sunt aditionate in mediu in cantitati ce oscileaza intre 1 si 10 mg/l.
Actiunile fiziologice ale citochininelor sunt:
Stimularea diviziunii celulare, prin inducerea unor modificari esentiale in ciclul mitotic, reducand durata fazei G1, intensificand procesul de sintetizare (S) a ADN-ului si prelungind faza G2.
Diferentierea si formarea organelor. Ca urmare a intensificarii diviziunii si extensiei celulare au loc unele procese organogenetice ca:
- stimularea germinarii semintelor;
- stimularea formarii si cresterii frunzelor prin alungirea limbului;
- inlaturarea dominantei apicale, avand ca efect o puternica ramificare a tulpinii;
- stimularea dezvoltarii mugurilor, organelor florale, dezvoltarea ovarelor;
- inducerea formarii fructelor partenocarpice;
- intensificarea transportului asimilatelor;
marirea rezistentei plantelor la tenperaturi scazute sau ridicate, la infectii cu ciuperci, prin evitarea denaturarii proteinelor si a acizilor nucleici din frunzele vestejite.
Intarzierea imbatranirii tesuturilor. Prin stimularea sintezei proteinelor, a pigmentilor clorofilieni si a axcizilor nucleici, ca si prin polarizarea circulatiei metabolitilor din tesuturile adiacente spre cele tratate, citochininele au r4ol esential in intarzierea imbatranirii plantelor.
Giberelinele. S-a constatat ca gigantismul provocat plantelor de orez este datorat unei substante produse de ciuperca Gibberella fujikuroi, si anume giberelina. S-a detectat prezenta giberelinelor naturale in cca. 130 de specii de plante superioare. Locul de sinteza a giberelinei este in embrionii semintelor in curs de germinare, in frunzele tinere, mugurii apicali.
Actiunile fiziologice ale giberelinelor sunt:
Stimularea germinarii semintelor.
Stimularea cresterii tulpinii.
Stimularea cresterii frunzelor.
Determina pornirea mugurilor apicali in vegetatie.
|
Stimularea infloririi si fructificarii.
Giberelinele nu sunt esentiale pentru cultura plantelor "in vitro". In acest caz ele se folosesc pentru inducerea alungirii internodurilor, cresterea meristemelor, iesirea din latenta a embrionilor.
In concluzie, pentru culturile "in vitro", cei mai folositi reglatori de crestere sunt auxinele si citochininele, foarte rar giberelinele si extrem de rar acidul abcisic (substanta inhibitoare).
Aditionarea dozelor de fitohormoni in mediul de cultura directioneaza tipul de morfogeneza dint-o cultura "in vitro". Altfel spus, raportul dintre auxine si citochinine are o mare importanta. Mai precis, o valoare mare a raportului auxina/citochinina favorizeaza rizogeneza, embriogeneza si calusogeneza, in timp ce o valoare mica a respectivului raport induce proliferarea mugurilor axilari si organogeneza directa sau indirecta.
De obicei, tipul de cultura si de explant determina tipurile si concentratiile hormonilor ce vor fi folositi. De pilda, explantele care sintetizeaza auxina nu mai necesita aditionarea in mediu a acestui fitohormon pentru alungirea si/sau diviziunea celulelor. Bunaoara exista:
culturi care nu necesita nici un fitohormon;
culturi care necesita numai auxina ;
culturi care necesita numai citochinine ;
culturi care necesita atat auxine, cat si citochinine.
Aminoacizii. Celulele cultivate pot sintetiza toti aminoacizii necesari. Insa aditionarea unor aminoacizi in mediul de cultura, poate favoriza cresterea deoarece constituie o sursa de azot mai accesibila celulelor decat aportul de azot anorganic.
Procesele de crestere "in vitro" pot fi stimulate si prin adaugarea in mediul de cultura a unor extracte organice, cum sunt: hidrolizate proteice, endosperm lichid din nuci de cocos, extracte de drojdii, de cartof, de tomate etc.
Agarul este un polizaharid extras din alge rosii din genul Gelidium. Agarul este cel mai folosit agent gelifiant intrucat se dizolva in apa la 90°C, iar prin racire sub 40°C formeaza un gel transparent, mai mult sau mai putin solid, in functie de concentratie, puritate, marca si pH. Concentratia agarului in mediile de cultura "in vitro" este de 5-10g/l.
Prepararea mediului de cultura necesita sticlarie curata, apa de calitate corespunzatoare, substante chimice pure si o atenta dozare a tuturor componentelor. Erorile de preparare a mediului de cultura reprezinta cauzele majore ale esecurilor unei culturi "in vitro".
Inainte de sterilizarea mediului de cultura, dupa adaugarea zaharozei si a hormonilor termostabili, se ajusteaza valoarea pH la cote cuprinse intre 5,0 si 6,5.
Steriliozarea componentelor termostabile se face prin autoclavare, iar cea a componentelor termolabile, prin filtrare sub presiune pozitiva.
Mediile si apa distilata pot fi autoclavate la 121°C, un anumit timp in functie de volum: 20 minute pentru volume de 20-50 ml, 25 minute pentru 250-500 ml, 35 minute pentru 500-5000 ml. Presiunea nu trebuie sa depaseasca o atmosfera, pentru a nu declansa descompunerea zaharozei sau a altor componente.
Vitaminele, aminoacizii, extractele vegetale, enzimele, unii hormoni (AIA, acidul giberelinic - GA3), antibioticele se sterilizeaza prin filtrare. In acest caz se folosesc filtre de unica folosinta existente pe piata. Solutia sterilizata se adauga in mediul de cultura care a fost autoclavat si racit la 45-50°C cu o pipeta sterila.
Pe tot parcursul prepararii mediului de cultura se va avea in atentie sa se respecte intocmai reteta de mediu aleasa pentru un anumit tip de cultura.
3. Pregatirea materialului vegetal
Pentru eliminarea bacteriilor, ciupercilor si a altor microorganisme existente pe materialul vegetal, este necesara o sterilizare de suprafata, ce trebuie sa fie completa, fara a afecta integritatea materialului vegetal.
De obicei, sterilizarea materialiului vegetal provenit din camp este extrem de dificila. Din acest motiv, se recurge la obtinerea acestuia in laborator, asigurandu-se un mediu aseptic inca din faza de germinare.
O strerilizare standard a materialului vegetal impune urmatorul protocol:
spalari cu apa curenta;
imersia intr-o solutie sterilizanta (hipoclorit de sodiu sau de calciu) timp de 1-30 minute in functie de sterilizantul folosit si de explant;
spalarea cu apa distilata sterila.
De regula contaminarile devin vizibile dupa 7-10 zile. Exista si contaminanti interni care se manifesta mult mai tarziu (dupa cateva subcultivari).
Sterilizarea materialului vegetal se face in hote cu flux laminar. Tot aici se repartizeaza si mediul in vasele de cultura.
4. Initierea unei culturi "in vitro"
Protocolul folosit pentru inceperea unei culturi vegetale "in vitro" presupune urmatoarele etape de lucru:
La hota cu flux laminar se confectioneaza explantele din material vegetal sterilizat, folosind instrumente sterile. Explantul este un fragment de organ sau tesut, detasat din planta de origine (donatoare) si cultivat pe mediul nutritiv artificial.
Inocularea explantelor la suprafata mediului din vasele de cultura. Si aceasta etapa se executa la hota cu flux laminar.
Transferarea culturilor "in vitro" de la hota cu flux laminar, in dulapurile sau camerele climatizate.
La intervale regulate de timp (7-10 zile) se fac subcultivari, adica se transfera calulsurile, lastarii, embrionii etc. pe medii proaspete de cultura.
In functie de scopul urmarit, pot fi realizate mai multe tipuri de culturi.
Tipurile de culturi "in vitro" se clasifica dupa mai multe criterii: dupa natura materialului vegetal (culturi de embrioni, de organe, de calus, de celule in suspensie, de protoplasti), dupa gradul de organizare (culturi organizate: plante intregi, embrioni, organe; culturi neorganizate: calusuri, suspensii; culturi neorganizate/organizate: care permit parcurgerea etapelor explant calus/suspensie embrioni/muguri plante, altfel spus fac posibila dediferentierea si rediferentierea).
II. MICROPROPAGAREA
Multiplicarea vegetativa este aplicata de foarte mult timp la plantele superioare, mai ales in horticultura. Aptitudinea pentru reproducerea asexuata este determinata de persistenta meristemelor pe parcursul intregii vieti a plantelor. Pentru micropropagare (multiplicare) "in vitro" sunt exploatate si alte insusiri:
capacitatea de a forma meristeme in tesuturi dediferentiate (calusuri);
evolutia celulelor somatice intr-un mod similar evolutiei zigotilor (embriogeneza somatica).
Au fost elaborate mai multe sisteme de multiplicare "in vitro":
Multiplicarea prin lastarire axilara.
Multiplicarea prin muguri (lastari) adventivi.
Multiplicarea prin embriogeneza somatica.
Producerea organelor de rezerva.
Multiplicarea prin lastarire axilara
Acest sistem de multiplicare suprima dominanta apicala si accelereaza functionarea meristemelor mugurilor deja formati pe planta, prin adaugarea citochininelor in mediul de cultura. In acest scop se folosesc mai multe tipuri de explante:
varfuri de lastari;
muguri axilari (noduri);
inflorescente.
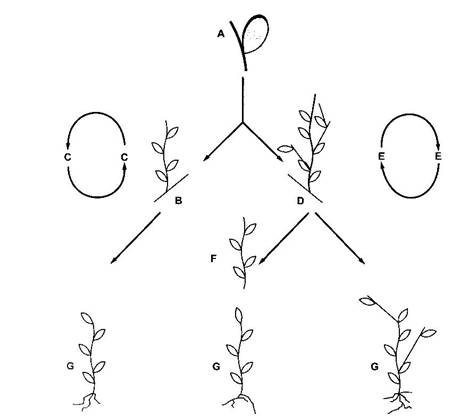
Fig. 13 Etapele multiplicarii prin lastarire axilara
Etapele multiplicarii prin lastarire axilara sunt (fig. 13):
A. Initierea culturii, folosind ca explante, muguri terminali sau axilari, apexuri de lastar, noduri (fragmente de tulpina cu cel putin un mugure axilar).
B. Reactivarea meristemelor si formarea lastarilor pe un mediu adecvat (mediu aditionat cu putina citochinina).
C. Folosirea lastarilor ca surse de noi explante - noduri si apexuri, care, cultivate pe acelasi mediu, vor forma noi lastari.
D. Inducerea lastaririi axilare multiple si formarea tufelor de lastari prin initierea culturii pe un mediu bogat in citochinina.
E. Multiplicarea propriu-zisa, prin divizarea tufelor de lastari si reinitierea culturilor multiplicative.
F. Alungirea lastarilor inainte de inradacinare, atunci cand lastarirea axilara este intensa.
G. Inradacinarea lastarilor "in vitro" sau direct in sol, pentru obtinerea plantelor.
Avantajele acestui sistem de multiplicare sunt:
asigura cea mai mare uniformitate genetica, intrucat nu presupune parcurgerea fazei de calus;
rata initiala a multiplicarii este scazuta, insa aceasta rata creste rapid si se mentine la un nivel constant in decursul unui numar mare de pasaje.
Aplicand acest sistem de multiplicare la crizantema, s-au obtinut 9 x 106 butasi/an pornind de la un singur apex.
1.2. Multiplicarea prin muguri (lastari) adventivi
Acest sistem de multiplicare induce formarea mugurilor adventivi direct pe explante (tulpina, frunza), sau indirect, in calusuri.
Etapele multiplicarii prin inducerea formarii lastarilor adventivi sunt (fig. 14, 15):
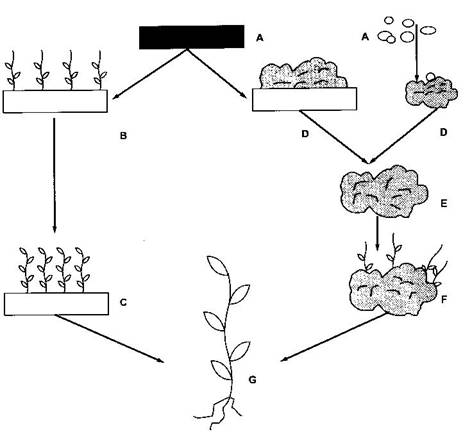
Fig. 14 Etapele multiplicarii prin muguri adventivi
A. Initierea culturilor folosind ca explante fragmente de organe, tesuturi, celule izolate (granule de polen, protoplasti).
B. Inducerea formarii mugurilor adventivi, direct din celulele explantului, pe un mediu de cultura adecvat.
C. Cresterea lastsarilor pe acelasi mediu sau pe un mediu de alungire.
D. Formarea calusului primar, prin inducerea diviziunii si dediferentierea celulelor explantului initial.
E. Subcultivarea calusului pe un mediu de crestere.
F. Regenerarea plantelor prin transferul calusului pe un mediu de inducere a organogenezei (mugurilor). Calusurile se mentin prin pasaje succesive, pana la obtinerea numarului dorit de lastari.
G. Inradacinarea lastarilor "in vitro" (pe un mediu cu auxina, sau pe un mediu fara hormoni), sau direct in sol.
Dezavantajul acestui sistem de cultura consta in riscul aparitiei unor variatii genetice sau epigenetice, datorita parcurgerii fazei de calus. De aceea, respectivul sistem de cultura se recomanda doar speciilor cu o solida stabilitate genetica. Nu se va aplica daca obiectivul principal consta in mentinerea stabilitatii genetice.


Fig. 15 Multiplicarea prin inducerea formarii mugurilor adventivi direct pe explant de frunza la Gloxinia sp. (a-c) si la Streptocarpus sp. (d-e)
1.3. Multiplicarea prin embriogeneza somatica
Aceasta metoda se bazeaza pe capacitatea celulelor somatice de a-si exprima totipotenta "in vitro", comportandu-se asemanator zigotului. Embriogeneza somatica poate fi indusa direct, pe explante, sau indirect, in calusuri ori suspensii celulare.
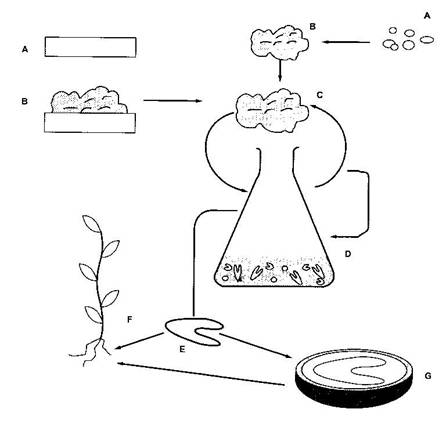
Fig. 16 Etapele multiplicarii prin embriogeneza somatica
Etapele multiplicarii prin embriogeneza somatica sunt (fig. 16):
A. Initierea culturii "in vitro" folosind ca explante: fragmernte de organe, tesuturi, celule izolate.
B. Formarea calusului primar sau microcalusului (din celule izolate).
C. Subcultivarea calusului primar sau a microcalusului pe mediul de crestere.
D. Initierea suspensiilor celulare prin disocierea celulelor calusului in mediul lichid. Ulterior, prin dispersia suspensiilor celulare la suprafata mediului solid, se poate obtine din nou calus.
E. Inducerea embriogenezei somatice in culturile de calus sau de celule in suspensie si formarea embrionilor somatici.
F. Obtinerea plantelor prin germinarea embrionilor.
G. Producerea semintelor artificiale prin incapsularea embrionilor somatici in polimeri biodegradabili.
Avantajele acestui sistem de cultura sunt:
este cea mai eficienta si rapida metoda de micropropagare, pentru ca permite obtinerea a milioane de plante dintr-un volum redus de celule;
permite obtinerea semintelor artificiale prin incapsularea embrionilor somatici, seminte care ar putea concura in privinta pretului de cost, cu semintele obtinute pe cale sexuata.
Dezavantajele acestui sistem de cultura sunt:
variabilitatea somaclonala manifestata de plantele regenerate, limiteaza aplicarea acestui sistem de multiplicare, in cazul in care se urmareste clonarea plantelor;
controlul genetic al variabilitatii somaclonale, permite regenerarea plantelor la un numar limitat de specii si soiuri.
1.4. Producerea organelor de rezerva
In cultura "in vitro" se poate induce formarea organelor de rezerva caracteristice:
bulbili la plantele cu bulbi;
microtuberculi la cartof;
protocorm la orhidee.
Bulbilii se formeaza prin proliferarea mugurilor axilari sau prin formarea mugurilor adventivi pe diferite tipuri de explante (mai ales pe solzi).
Microtuberculii sunt produsi la plante de cartofi libere de virusuri.
La orhidee, protocormul somatic, identic ca structura cu
protocormul provenit din embrion, se dezvolta pornind de la muguri sau
direct pe
2. Etapele generale ale biotehnologiei de micropropagare
Productia comerciala de plante prin micropropagare reclama parcurgerea a patru satdii, dintre care primele trei se desfasoara "in vitro", iar al patrulea stadiu in conditii de sera. Acestor patru stadii le-a mai fost adaugat stadiul 0, in care se constituie stocul de plante care vor fi clonate (fig. 17, 1).
Terminologia adoptata in procesul de producere a plantelor prin micropropagare in toate stadiile, este cea propusa de Murashige. Folosirea exclusiva a acestei terminologii simplifica desfasurarea operatiunilor zilnice, gestiunea, analiza cheltuielilor de productie, permite o comunicare facila cu clientii si cu alte laboratoare similare.
Etapele generale ale biotehnologiei de propagare sunt prezentate in fig. 17 si 18.
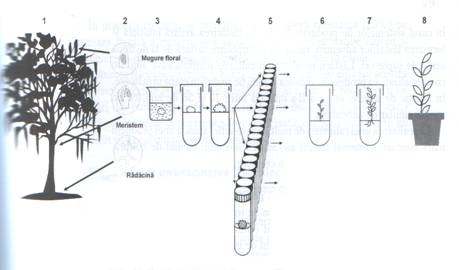
Fig. 17 Etapele biotehnologiei de micropropagare
Etapa I: Initierea unei culturi aseptice si alegerea mediului de cutura (fig. 17, 2-4)
Obiectivele urmarite in aceasta etapa sunt:
o asepsia;
o supravietuirea explantelor;
o reluarea cresterii.
Asepsia presupune:
spalarea explantelor (1-2 ore) cu apa curenta;
imersia tesuturilor intr-o solutie antiseptica (hipoclorit de sodiu sau calciu) aditionata cu un muiant (Tween 20, cateva picaturi/100 ml);
spalarea repetata cu apa distilata steria.
Contaminarile bacteriene si fungice devin vizibile dupa 7-10 zile de la initierea culturilor. Exista contaminanti care nu se manifesta de-a lungul mai multor sunbcultivari. Pentru prevenirea acestui pericol se realizeaza o cultura pe un mediu aditionat cu peptona, cazeina si extract de drojdie, care favorizeaza multiplicarea bacteriilor.
Supravietuirea explantelor si reluarea cresterii sunt conditionate de utilizarea unui mediu de cultura adecvat. De regula se prefera mediul MS.
Meristemele se cultiva pe medii aditionate cu doze mici de auxine si citochinine. Tipurile si dozele hormonilor trebuie alese avand in vedere cresterea lastarului si nu formarea calusului.
Celelalte tipuri de explante sunt inoculate pe un mediu care contine o auxina (de obicei ANA) in doza mica (0,1 mg/l) si o citochinina (BAP) in doza mai mare (1,0 mg/l).
Etapa a II-a: Multiplicarea si alungirea lastarilor (fig. 17, 5-6)
Se considera ca este cea mai importanta etapa, intrucat coeficientul de multiplicare este criteriul economic major in cazul propagarii in scop comercial.
Obiectivul principal este obtinerea unui numar maxim de lastari utilizabili la fiecare subcultura. Acesti lastari trebuie sa aiba anumite dimensiuni care sa permita separarea, de asemenea ei trebuie sa fie foarte uniformi. In functie de specie, etapa a II-a dureaza 10-36 de luni.
Tipurile de citochinina (kinetina, BAP, 2IP) si auxina (AIA, AIB, ANA), precum si concentratiile acestora in mediul de cultura sunt factori capitali in etapa de productie.
Factorii de mediu ce au impact major asupra ratei micropropagarii sunt:
- umiditatea relativa, care in camera de crestere trebuie mentinuta la un nivel destul de inalt (70%), deoarece vasele de cultura nu se inchid etans, pentru a nu se impiedica schimbul de gaze cu atmosfera exterioara;
- lumina are rol important in orientarea procesului de morfogeneza; calitatea luminii furnizate (prin tuburi fluorescente albe) nu variaza in timpul culturii; 9-16 ore de lumina/zi sunt suficiente in aceasta etapa;
- temperatura trebuie sa fie
Etapa a III-a: Inradacinarea lastarilor (fig. 17, 7)
Pentru a se obtine rezultate satisfacatoare in aceasta etapa, se recomanda:
v utilizarea unei auxine numai in perioada de initiere a radacinilor;
v folosirea ca stimulatori GA3, sau polifenoli, dar numai dupa inductia rizogenezei, la inceputul initierii primordiilor radiculare;
v reducerea cantitatii de agar din mediul de cultura;
v diluarea sarurilor anorganice la jumatate din valoarea lor in mediul MS;
v utilizarea absorbantilor (carbunele vegetal);
v reducerea intensitatii luminii;
v cresterea temperaturii la 30°C in perioada de initiere a primordiilor radiculare si reducerea la 25°C in perioada de crestere a radacinilor.
Aceasta etapa dureaza in functie de specie intre 1 si 6 saptamani.
Inradacinarea "in vitro" permite reducerea considerabila a pretului de cost.
Etapa a IV-a: Aclimatizarea plantelor in sol (fig. 17, 8)
Reusita acestei etape este conditionata de substratul de cultura si de conditiile de mediu (umiditate, lumina, temperatura).
Se recomanda ca plantele trecute din "in vitro" in "in vivo" sa fie tratate cu fungicide inca din aceasta etapa, pentru a preveni atacurile patogenilor.
Trebuie avut in vedere ca in aceasta etapa plantele absorb putina apa din cauza sistemului radicular putin dezvoltat, insa pierd usor apa prin cuticula foliara putin dezvoltata. De aceea se iau masuri pentru prevenirea ofilirii plantelor prin acoperirea terenului cu sticla, sau administrarea cetii artificiale timp de 15 zile. Apoi, umiditatea se reduce treptat.
In functie de specie, pentru aclimatizarte se folosesc:
v camere speciale, in care lumina, temperatura si umiditatea pot fi strict controlate;
v incubatoare acoperite cu material plastic, amplasate in sera;
v sectoare de sera echipate cu instalatii de realizare a cetii artificiale;
v instalatii de incalzire a substratului, pentru favorizarea inradacinarii.
Aceasta etapa dureaza 4-16 saptamani.

Fig. 18 Cultura multiplicativa (a); lastari separati pentru alungire (b); inradacinarea lastarilor (c) la Matricaria recutitta; cultura multiplicativa (d); lastari separati pentru crestere si alungire (e, f) la Digitalis lannata
3. Avantajele micropropagarii comparativ cu metodele de inmultire conventionale
Nu necesita un numar mare de plante mama. Cativa muguri sunt suficienti pentru initierea culturilor.
Anual, pe un metru patrat de etajera poate fi obtinut un numar mare de plante.
Se obtine un material sanatos, liber de agenti patogeni.
Rata mare a multiplicarii permite schimbarea rapida a sortimentului.
Stocarea usoara (temperatura de 25°C, durata minima de 4-6 luni) face posibila desfasurarea productiei fara intrerupere, pe durata intregului an.
Materialul inradacinat poate fi usor transportat, fara agar (40 000 de plante cantaresc impreuna cu ambalajul 15 kg).
Volumul redus al materialului vegetal permite crearea bancilor de gene (intr-un frigider cu capacitatea de 200 de litri pot fi conservati cateva mii de pomi clonati).
Permite multiplicarea speciilor cu seminte rare, a celor care germineaza cu dificultate, contribuind la diversificarea sortimentului de plante comercializate.
Face posibila multiplicarea in masa, deoarece numarul plantelor obtinute de la o singura planta mama poate creste la infinit.
Plantele astfel obtinute pot fi stocate la rece, intr-un spatiu limitat, timp de mai multi ani, inainte de a fi transferate in sera sau pepiniera.
Prin micropropagare se asigura introducerea in cultura, in timp mai scurt, a unor noi soiuri care se inmultesc numai pe cale vegetativa. Ameliorarea freziei dureaza 10-11 ani prin folosirea metodelor clasice. Prin cultivarea "in vitro", aceasta lunga perioada se scurteaza la numai 2-3 ani. De asemenea, soiurile noi de vita de vie si de pomi fructiferi pot fi introduse in cultura intr-un timp considerabil mai scurt prin tehnicile de micropropagare.
Unul dintre cei mai mari producatori de plante multiplicate "in vitro" este Olanda (plante ornamentale).
4. Tehnologii utilizate pentru inmultirea "in vitro " la specia Gerbera hybrida
Producerea plantelor "in vitro" se realizeaza din fragmente de capitule foarte tinere sau din meristeme. Obtinerea plantelor dureaza 3-4 luni. Starea lor sanitara este foarte buna.
Plantele sunt libere de boli si daunatori (viroze, bacterioze, micoze), se pastreaza identitatea genotipica si fenotipica a materialului obtinut cu cea de tip parental, se realizeaza rejuvenilizarea plantelor, rezistenta marita la atacul patogenilor si cresterea potentialului productiv.
De asemenea se scurteaza timpul de producere a materialului saditor fata de tehnologia clasica, se obtin cantitati mari intr-un timp mai scurt pe suprafete reduse. Se creeaza o economie importanta de forta de munca si spatii de productie.
Odata insusita tehnica de lucru, ea poate fi practicata de catre orice doritor, fara prea multe eforturi, dar cu suficiente cunostinte de biologie celulara, fiziologie, genetica, asepsie, chimie.
Cel mai cunoscut institut unde se practica tehnologiile de
inmultire "in vitro" la noi se gaseste la Codlea, jud.
Traditia comercializarii florilor cultivate sub sticla dateaza din anul 1880. Aparitia si dezvoltarea serelor de la Codlea a fost favorizata de un climat mai dulce iarna si mai racoros vara, de pozitia geografica si de facilitatile de transport rapid al produselor.
Astazi S.C. Sere Codlea S.A. se prezinta ca o unitate moderna, puternica, care valorifica la scara industriala conditiile exceptionale de clima si traditia cultivarii florilor in regim controlat.
S.C. Sere Codlea S.A. detine 65 ha de sere si 300 h teren arabil. Serele sunt organizate in noua ferme de productie si o ferma de obtinere a materialului saditor din culturi de tesuturi. Suprafata arabila este organizata in 2 ferme de productie. Pe langa cele 12 ferme mai exista 4 sectoare: mecanic, de chimizare, de aprovizionare si transport, de sortare.
Prin existenta complexului de devirozare si micropropagare se realizeaza productii superioare cantitativ si calitativ la culturile de flori si legume. Acest fapt este conditionat de utilizarea unui material saditor de valoare biologica ridicata, sanatos, care sa pastreze fidel caracterele de soi.
S.C. Sere Codlea S.A. produce si comercializeaza material saditor floricol si de cartof, liber de boli si de daunatori, de inalta valoare biologica, obtinut din culturi meristematice "in vitro", in cadrul unitatii special create pentru practicarea culturilor "in vitro".
In cadrul acestei unitati se produc in fiecare an 2,5 milioane de butasi de garoafe (soiuri valoroase, sortiment divers), butasi de gerbera, de crizantema, minituberculi de cartofi, obtinuti din culturi initiale, propagate si clonate "in vitro". Societatea cultiva si flori taiate: gerbera, garoafe, trandafiri, frezia, crizanteme, crini, strelitzia, alstroemeria, crini, cale. Productia anuala se ridica la cca. 20 milioane de flori taiate, 100 000 bucati flori la ghivece, cca. 3 500 t legume de sera, cca. 5 000 t legume de camp si aproximativ 5 milioane bucati material saditor. Aceste productii plaseaza societatea brasoveana in randul marilor producatori europeni de flori.
Mai departe se descriu mai multe etape pentru obtinerea unor butasi de calitate, prin metoda ''in vitro'', la 5 soiuri de Gerbera, ce s-au urmarit atat in faza de butas cat si ca plante mature, dezvoltate in solul serei si in vasele de cultura.
Prepararea mediilor de cultura
Camera de preparare a mediilor de cultura este spatioasa, luminoasa, dotata cu mese acoperite cu faianta, dulapuri cu reactivi, o balanta tehnica, instalatie de vid (pompa de vacuum) pentru filtrarea rapida, frigidere si congelatoare pentru pastrarea substantelor termolabile (hormoni, vitamine) si a unor medii de cultura. Vitaminele se pastreaza in congelator, in sticle din material plastic, portionate in cantitati de cca. 10 ml. Solutiile de hormoni se improspateaza la cel mult doua saptamani.
Alegerea compozitiei mediului de cultura se face in raport de scopul urmarit. Se utilizeaza reteta de mediu stabilita de Murashige-Skoog (1962) (MS).
Pentru multiplicarea Gerberei se lucreaza cu urmatorul mediu de cultura: macroelemente (KNO3, NH4NO3, MgSO4, CaCl2, KH2PO4), microelemente (MnSO4, KI, CoCl2, ZnSO4, CuSO4, H3BO3, Na2MoO4), solutia stoc 51 ( inozitol, NaH2PO4, timina, acid nicotinic, piridoxina, acid indolil acetic ce se mai intalneste sub denumirea de AIA), Fe EDTA, adenina sulfat, tirozina, chinetina, zaharoza si un agent solidificator reprezentat de agar. Pentru mediul de inradacinare se folosesc: macroelemente, solutia stoc 52 (inozitol, tiamina, piridoxina si acid indolil butiric AIB), wuxal. In ambele medii se introduce antibioticul verde malachit.
Trebuie sa se respecte cu strictete cantitatile din retete. Pentru aceasta exista o camera separata, dotata cu balante analitice, cu torsiune si tehnice. Aceasta prezinta o consola, pentru a evita vibratiile. Nu este recomandabil sa se intervina in schimbarea cantitatilor din retetele de solutii anorganice, intrucat se produc modificari in ceea ce priveste proportia diferitilor compusi, alterandu-se echilibrul ionic fixat ca optim din punct de vedere fiziologic, a stabilitatii in timp a pH-ului etc.
In prepararea solutiilor stoc se tine seama de anumite reguli. Dizolvarea substantelor se face numai in apa bidistilata. Fiecare compus se va dizolva intr-o anumita cantitate de apa (proportionala cu numarul ingredientelor ce urmeaza a fi amestecate si cu volumul final al solutiei stoc), dupa care solutiile obtinute (omogene optic) se vor amesteca succesiv, in ordinea indicata in retetar. Atunci cand substanta se dizolva greu, amestecul se va incalzi usor pe baia de apa, agitand. Regulatorii de crestere vor fi solubilizati fiecare in parte. In prepararea mediului de baza fiecare compus in parte (fie solutie stoc, fie ingredient solid) se adauga esalonat, intr-o anumita cantitate de apa bidistilata, cantitate apreciata arbitrar, proportionala cu volumul final al solutiei.
Pentru prepararea mediilor se recomanda a se folosi numai apa deionizata sau bidistilata. Scaderea continutului in apa produce pierderea turgescentei celulare la inceput, apoi moartea tesuturilor prin deshidratare ireversibila. La culturile "in vitro" pierderea apei se poate datora obturarii defectuoase a flacoanelor de cultura sau a umiditatii scazute in camera de vegetatie, care deshidrateaza atat mediul, cat si tesutul. In aceasta situatie, mediul se concentreaza prin pierderea apei, iar gelul cu agar scade in volum si crapa. Acest fenomen provoaca o crestere a concentratiei sarurilor in mediu si necrozarea tesuturilor. Prevenirea acestei situatii se face prin pastrarea in camerele de vegetatie a unei umiditati de 80% si transferarea inoculilor pe mediu proaspat.
Agarul se adauga mediului de cultura dupa introducerea celorlalte ingrediente. Pentru solubilizarea acestuia se procedeaza la topirea lui prin introducerea recipientului cu mediu intr-o baie de apa, agitand continutul. Inaintea autoclavarii se regleaza pH-ul mediului.
Dupa ce s-a preparat mediul acesta se distribuie in recipienti ce au fost sterilizati in prealabil impreuna cu folia de aluminiu. Se trece imediat la autoclavarea recipientilor cu mediu.
Sterilizarea recipientilor de cultura, a mediilor de cultura si decontaminarea endogena a culturilor de tesuturi
Deoarece o serie de microorganisme au spori rezistenti la agentii dezinfectanti sau la o autoclavare de scurta durata, se recomanda presterilizarea la sec (prin caldura uscata) a sticlariei in etuva. Anumite forme de bacili sunt termorezistenti, astfel incat se impune presterilizarea sticlariei intre 40 minute la 120°C, pana la 180 minute la 160°C. Presterilizarea sticlariei la temperaturi ce depasesc 180°C conduce la o degradare a calitatii sticlariei si la eliberarea unor compusi toxici in mediul de cultura.
Obiectele din sticla (pipete, lamele de microscop, capsulele Petri etc) se impacheteaza separat in hartie, se aseaza pachetele in tavi metalice si se sterilizeaza la etuva, reglata astfel incat hartia sa nu se carbonizeze. Folia de aluminiu, prealabil folosirii, se sterilizeaza la etuva sau la autoclav.
Sterilizarea mediilor de cultura se face prin autoclavare la 121°C (echivalent cu presiunea de 1 atm.). Durata mentinerii recipientilor cu medii in autoclav depinde de volumul lichidului si a cantitatii de flacoane introduse in casoletele din autoclav. Durata minima este de 15 minute, iar cea mai uzuala este aceea de 20 minute.
Culturile "in vitro" de Gerbera se caracterizeaza prin manifestarea aparenta a infectiilor endogene latente deja dupa a doua subcultura. Pentru inlaturarea acestui neajuns s-a recurs la adaugarea in mediile de cultura a unui produs comercial-PPM (Plant Prezervativ Mixture) sau a verdelui malachit, obtinand rezultate destul de bune. Pentru a spori eficacitatea acestor produse am experimentat complexarea produsului de decontaminare, utilizand si antibiotice.
PPM-ul este un bioacid conservant cu spectru larg, produs de Plant Cell Technology, Inc. Washington USA.
Scopul utilizarii produsului il constituie eradicarea contaminarilor endogene, care constituie o problema majora pentru culturile " in vitro ".
S-au utilizat pentru experimentare
produsul comercial PPM, verdele malachit si antibiotice (ampicilina,
penicilina, oxacilina si gentamicina) in concentratii de 0,1% si
1%. Au fost selectionate neoplantule de Gerbera apartinand urmatoarelor soiuri: Cris (rosu),
Nela (alb),
Neoplantulele au fost subcultivate pe mediu MS (1962) suplimentat cu: PPM (V1) si verde malachit (V2). Martorul V0 l-a constituit un esantion de mediu MS la care nu s-au adaugat cei doi agenti de decontaminare.
Inainte de a fi subcultivate plantulele de Gerbera au fost imersate in solutiile de antibiotice amintite mai sus. Culturile "in vitro" au evoluat in camera de crestere la o temperatura de 22°C, intensitate luminoasa de 2000 lucsi si o fotoperioada de 16/24 h.. Culturile au fost tinute permanent sub observatie, iar analiza rezultatelor s-a facut dupa o perioada de 30 zile de la data subcultivarii.
Fiecare dintre agentii decontaminanti utilizati in experiment s-a dovedit a fi eficient. S-a obtinut un procent de 96% plante decontaminate in cazul mediului suplimentat cu PPM 1ml/l si un procent de 75% plante decontaminate la cele cultivate pe mediile la care s-au adaugat solutii de verde malachit 0,1%. Procentul de plante contaminate in cazul martorului a fost de 70%. Cele mai bune rezultate (99%) s-au obtinut la varianta PPM/penicilina 1%.
Concluzii - atat PPM-ul cat si verdele malachit utilizate individual au dovedit o buna capacitate de decontaminare. Gradul de decontaminare a fiecaruia dintre cei doi agenti de decontaminare endogena a crescut in cazul in care plantutele au fost imersate in solutii de antibiotice, anterior subcultivarii. Dintre antibioticele experimentate ampicilina a condus la rezultate superioare.
Asepsia materialului vegetal si studiul eficacitatii clorurii mercurice in dezinfectia materialului vegetal
Dezinfectantii trebuie sa fie suficient de puternici astfel incat in scurt timp sa distruga microorganismele aderente la suprafata organelor, dar totodata nu trebuie sa patrunda in profunzimea organelor. O alta conditie pe care trebuie sa o indeplineasca agentii dezinfectanti este aceea de a putea fi indepartati de pe materialul biologic pregatit ca donator de explante, prin spalari succesive cu, apa distilata, sterila.
Gerbera este o planta puternic pubescenta, ceea ce face foarte dificila prima etapa a initierii unei culturi axenice "in vitro" si anume: dezinfectia materialului vegetal.
Ca dezinfectanti au fost recomandati: NaOCl 1,3% + Tween 20 0,1 % (Pierik 1989 si Jerzy 1991) si Ca(OCl)2 5% + Tween 20 0,1% (D.Cachita-Cosma 1981, Oprea 1985).
Scopul lucrarii a fost de a
inlocui acesti dezinfectanti cu HgCl2 0,1% pentru
extinderea gamei de dezinfectanti. Materiealul vegetal a fost constituit
din lastari de Gerbera proveniti de pe plante mama
pregatite pentru lastarire dupa tehnologia clasica.
S-au folosit urmatoarele soiuri de Gerbera:
Red Marlene, Botello, Tzigane (rosii),
S-a urmarit tehnica descrisa de D.Cachita-Cosma 1981, Oprea 1985, Pierik 1989 si Jerzey 1991) pentru culturi de meristeme, butoni florali si petioli de frunza. Ca dezinfectanti s-au folosit Ca(OCl)2 5% + Tween 20 0,1% si HgCl2 0,1%. Inocularea s-a facut in eprubete de sticla (1 ml mediu/vas), pe mediu de initiere pentru fiecare din cele 3 tipuri de culturi (meristeme, capituli florali si petiol foliar) iar pasarea s-a facut la 3-4 saptamani pe flacoane tip ampicilina (5 ml mediu/vas) pe mediu de multiplicare.
Multiplicarea si inradacinarea s-au facut pe mediile descrise de D. Cachita-Cosma iar aclimatizarea s-a facut pe perlit, perlit si turba rosie in parti egale, dupa stimularea rizogenezei cu Radistim. La 2 luni dupa aclimatizare au fost apte pentru a fi livrate ca material saditor pentru sera.
Aplicarea tehnologiei clasice de lastarire la Gerbera s-a desfasurat cu succes. S-au obtinut in medie 26 lastari pe planta mama. Spre deosebire de Ca(OCl)2 care este foarte greu solubil, iar concentratia se poate determina doar prin diferenta dintre cantitatea initiala dizolvata si filtrat, HgCl2 este mai usor solubil, concentratia solutiei finale fiind usor de stabilit. Rata de obtinere a meristemelor viabile, axenice in cazul HgCl 2 0,1% este cuprinsa intre 45,66 si 96,65% (media este de 71,73%) fata de hipoclorit unde am obtinut valori cuprinse intre 0-15%. Gradul de infectie in cazul HgCl2 a fost intre 21,73-43,47% (media de 17,4%) fata de 60-80% in cazul hipocloritului de Ca, iar gradul de necrozare in cazul HgCl2 fost intre 4,3-32,6% (media de 10,87%) fata de hipoclorit care a avut intre 20-60%.
De asemenea s-a incercat obtinerea
de plante via calus din petiol de
Propagulele de Gerbera diferentiate din meristeme, cel putin la primele pasari, prezinta caractere de plante sanatoase, in timp ce propagulele provenite via calus din capituli florali 80-90% prezinta zone de necroza, iar cele provenite din petioli de frunza 40-60% prezinta aceleasi caracteristici. Acest fapt ne determina, in urma rezultatelor obtinute, sa preferam cultura de meristeme de Gerbera desi rata de multiplicare 1 via calus este de cel putin 5 ori mai mare decat cea pentru meristeme (media de multiplicare 1 la meristeme este de 2,15%).
Concluzii - HgCl2 s-a dovedit a fi mai eficient decat hipocloritul de Ca, ducand la o crestere a ratei de prindere a meristemelor de cel putin 5 ori mai mare in cazul HgCl2 . In urma rezultatelor obtinute putem sa adaugam la lista dezinfectantilor folositi pentru initierea de culturi "in vitro" de Gerbera si HgCl2 0,1%.
Propagulele diferentiate din meristeme sunt practic axenice la primele multiplicari, in timp ce propagulele provenite din petioli foliar si capituli florali prezinta in proportii variabile contaminari bacteriene. Rata de multiplicare 1 pe acelasi tip de mediu scade progresiv de la rosu la galben spre alb iar rata de multiplicare in sistem industrial scade progresiv de la soiurile portocalii la rosii spre alb. In acest sens trebuie urmarita evolutia propagulelor de diverse culori pe medii cu balante ionice, de vitamine si hormoni-usor modificate pentru o apropiere cat mai mare a valorilor ratelor medii de multiplicare.
Procedee de multiplicare "in vitro" la Gerbera
S-au prelevat explante din lastari de Gerbera, fortati sa se dezvolte din mugurii dorminzi prezenti pe rizomi. Pentru aceasta s-au indepartat frunzele de pe rizomi si s-au fasonat radacinile, dupa care rizomii au fost plantati in perlit, in sera. Dupa aproximativ trei saptamani, din mugurii latenti existenti pe tulpinile subterane s-au dezvoltat niste tulpinite juvenile. Apexurile acestor lastari au fost prelevate si apoi sterilizate cu hipoclorit de calciu 5% cu adaos de Tween 20, timp de 25 minute, dupa care s-a trecut la spalarea repetata cu apa sterila a acestora. Explantele de cca. 1 mm prelevate din apexul acestor lastari au fost inoculate pe urmatorul mediu de cultura: macroelemente, microelemente, si Fe EDTA dupa Murashige - Skoog, plus Na2PO4· H2O 85 mg/l, tiamina 30mg/l, acid nicotinic 10 mg/l, piridoxina 1mg/l, mezo-inozitol 100 mg/l, adenina 80 mg/l, L-tirozina 100 mg/l, zaharoza 45 g/l, agar 10 g/l, AIA 0,5 mg/l si chinetina 10 mg/l.
Regimul din camera de crestere la care au fost supusi inoculii a constat dintr-o fotoperioada de 16 h lumina/24 h cu o intensitate luminoasa de 2500 lucsi si temperatura de 24°C. La aproximativ o saptamana de la inoculare , tesuturile au inceput sa prolifereze, iar dupa cca. 4 saptamani din inoculi s-au diferentiat numerosi mugurasi care, in decurs de inca 2-3 saptamani, au crescut, generand colonii de plantule cu frunzulite petiolate, lungi de 1-2 cm. Propagulii separati din colonia mama au fost subcultivati repetat, repicand fragmente de colonie, constand dintr-o zona bazala cu calus pe care erau inserate 2-3 frunzulite, pe un mediu de cultura similar celui din cultura primara.
Multiplicarea "in vitro" a Gerberei se realizeaza usor prin acest procedeu, cu conditia ca in mediu sa existe o concentratie scazuta de auxina (ANA 1-0,1 mg/l) si o concentratie ridicata de citochinina, respectiv 2 mg/l BA. Cultivarea "in vitro" a propagulilor de Gerbera pe medii lipsite de regulatori de crestere, conduce la o slaba capacitate organogena. Daca se urmareste realizarea in scurt a cat mai multe neoplantule, subcultivarea propagulior se recomanda a fi facuta pe medii lipsite de citochinine, dar cu 1mg/l ANA, pentru a stimula procesele de rizogeneza.
Plantele generate "in vitro ", in general, se acomodeaza fara pierderi la conditiile mediului septic, iar in cca. 6 luni de la transferarea plantelor in mediul natural, acestea infloresc.
O alta cale pentru multiplicarea " in vitro " a Gerberei este aceea elaborata de Pierik si colaboratorii (1973, 1975) in care se foloseste calatidiul fragmentat. In acest scop se aleg inflorescentele care prezinta, in anteza completa, numai 2-3 circumferinte din inflorescente, respectiv cele situate in exteriorul calatidiului; florile batrane si cele foarte tinere sau imbobocite diferentiaza slab. Sezonul potrivit pentru recoltarea inflorescentelor este din martie pana in octombrie, desi se remarca un declin regenerativ in lunile iunie-iulie. Inflorescentele sunt fasonate prin indepartarea florilor de pe calatidiu si scurtarea bracteelor involucrului. Pedunculul se scurteaza la cca. 1,5 cm. Pentru o dezinfectare eficienta, calatidiile fasonate se introduc intr-un bac din material plastic perforat care se scufunda in alcool etilic 70%, timp de 30 secunde, apoi acestea se transfera in hipoclorit de sodiu 1,5%, timp de 95 minute. In final materialul vegetal se spala de cateva ori cu apa distilata sterila, timp de 45 minute. In procesul de dezinfectare se produce un proces de inchidere a calatidiilor.
Se sectioneaza apoi calatidiile in conditii aseptice. Planul de sectionare este perpendicular pe suprafata receptaculului. Explantele rezultate, sferturi de calatidiu, sunt introduse in mediul de cultura, amplasate astfel incat inoculul sa fie cufundat cu suprafetele sectionate in mediul de cultura, iar partea externa, convexa, a inflorescentei, sa fie situata in aer.
Mediul de cultura este cel utilizat de Pierik si colab. (1973) cu adaos de GA3 in concentratie de 0,1 mg/l , pH-ul mediului fiind de 5,7. S-au folosit eprubete de 20 cm/2,5 cm, obturate cu dopuri de vata si folie de aluminiu. In primele 30 de zile eprubetele cu inoculi au fost tinute la intuneric, in dulapuri termostate, la temperatura de 27°C, apoi au fost trecute la lumina continua de 3 300 lucsi, timp de 30 zile. Temperatura camerei climatice a fost de 25-27°C, iar noaptea de 22-23°C. Pe lotul de inoculi pe mediu lipsit de giberelina au au aparut dupa 30 zile cate 2-3 neoplantule. La 2 luni neoplantulele au fost pasate pe mediu rizogen. Prezenta giberelinei in mediul de cultura a inhibat procesul de neoformare a plantutelor.
Pentru procedeul de multiplicare "in vitro " din muguri caulinari se aleg plantele donatoare, se fasoneaza rizomii de la plantele adulte, dupa parcurgerea fazei de anteza. Se indeparteaza total de pe rizomi, frunzele cu petiol si florile, precum si o parte din radacini, apoi rizomii sunt plantati in ghivece cu perlit, in sera. Dupa cca. 3 saptamani se declanseaza cresterea mugurilor caulinari. Se recolteaza in vederea prelevarii, lastarii juvenili.
Dezinfectia lastarilor se face timp de 25 minute cu o solutie de hipoclorit de calciu 5% cu adaos de Tween 20 0,1%, dupa care se procedeaza la spalarea repetata. Inocularea: se preleva apexuri de 1 mm care sunt inoculate in eprubete de 12 cm/1,6 cm. Mediul de cultura este cel utilizat de Murashige si colaboratorii (1974) cu adaos de chinetina 10 mg/l si auxina 0,5 mg/l, cu un pH de 5,7. Conditiile de cultura: 16 h lumina de 2 500 lucsi, temperatura de 24°C.
Dupa o saptamana apexurile incep sa prolifereze, iar la 4 saptamani se formeaza colonii de plantute. La 6 saptamani plantutele aveau 2 cm inaltime, cu frunzulite lung petiolate. Subcultivarea se face de cateva ori, pe acelasi mediu cu o concentratie a auxinei de 0,1 mg/l si 2 mg/l.
Din propagulele inradacinate s-a reusit sa se obtina plantule complet conformate, care au suportat cu succes transformarile din vitro in mediu septic de viata.
Aclimatizarea si influenta substratului de cultura asupra dezvoltarii plantelor de Gerbera aclimatizate
Dupa ce a stat in camera de crestere Gerbera se planteaza pe parapeti. Ca substrstrat de inradacinarea se foloseste perlitul care se dezinfecteaza in prealabil cu Brasicol. Pentru favorizarea inradacinarii este indicat sa se foloseasca Radistim.
Se uda si se acopera cu material plastic sau textil, formand mici tunele. Temperatura aerului si a solului trebuie sa fie cuprinsa intre 18-20°C. O alta operatie de ingrijire este fertilizarea foliara.
Dupa o luna de zile butasii de Gerbera se transplanteaza la ghivece, intr-un amestec de pamant, turba, nisip, faina de oase, pH-ul fiind de 5,6. Pentru a se asigura o prindere buna a butasilor, se va uda in jurul lor. In decurs de 3 luni plantele isi dezvolta puternic radacinile, formand baloti. Din acest moment sunt apte pentru a fi plantate in sol si in vase de vegetatie.
Pentru imbunatatirea calitatii plantelor de Gerbera aclimatizate s-a facut un studiu privind folosirea mai multor substraturi de cultura si in final, alegerea substratului adecvat.
Materialul vegetal folosit in
experimentare: plante de Gerbera
aclimatizate, avand 4 saptamani de la transferul "ex vitro ". S-au
folosit in paralel urmatoarele tipuri de substraturi: perlit, perlit
si turba rosie in proportie de 1/1, turba rosie,
pamant de
Aspect comparativ din cultura:
dezvoltare mijlocie in cazul perlitului, dar si in cazul folosirii
amestecului de perlit cu turba, dezvoltare slaba pe turba
si foarte buna pe amestec de
Aspect comparativ al dezvoltarii plantelor de Gerbera: pe turba plantele s-au dezvoltat slab, pe turba si perlit dezvoltarea a fost medie, iar cele mai dezvoltate plante au fost cele plantate in amestec de pamant.
Sistemul radicular s-a dezvoltat foarte puternic in perlit, mijlociu in amestecul de turba cu perlit si slab in substratul de turba rosie.
Plantele de Gerbera crescute pe substrat de perlit au avut o rata a supravietuirii de cca. 75%, au prezentat o foarte buna dezvoltare a sistemului radicular, a fost favorizata de gradul ridicat de aerisire a perlitului. La o luna de zile plantele au inceput sa se etioleze puternic datorita carentelor minerale ce nu au putut fi contracarate numai prin fertilizari.
Amestecul perlit/turba rosie a determinat pentru plantele de Gerbera o evolutie usor similara celei a perlitului, in privinta ratei de supravietuire. Sistemul radicular a fost usor mai slab-dezvoltat ca urmare a caracterului compact al substratului, dar plantele nu au mai manifestat caracteristicile de etiolare.
Turba rosie simpla, prin caracterul puternic compactizant, a determinat o rata de supravietuire de 40%. La acest aspect a concurat infectia ulterioara cu Phytophtora sp., in conditiile unui pH scazut (sub 5) si a lipsei oxigenarii.
Amestecul de pamant de
Concluzii - pentru succesul culturii de Gerbera dupa aclimatizare trebuie urmarit cu strictete nu numai pH-ul solutiei solului dar si gradul de aerisire al substratului, pentru mentinerea unei cat mai bune stari fitosanitare si nu in ultimul rand al iluminarii corespunzatoare a culturii.
Ca urmare a folosirii celor 4 variante de substrat, cele mai bune rezultate au fost obtinute pe amestecul de pamant de frunze, in aceleasi conditii de pH, iluminare, temperatura, umiditate atmosferica si fertilizare.
Avantajele inmultirii ''in vitro''
Plantele sunt libere de boli si daunatori (viroze, bacterioze, micoze), se pastreaza identitatea genotipica si fenotipica a materialului obtinut cu cea de tip parental, se realizeaza rejuvenilizarea plantelor, rezistenta marita la atacul patogenilor si cresterea potentialului productiv.
De asemenea se scurteaza timpul de producere a materialului saditor fata de tehnologia clasica, se obtin cantitati mari intr-un timp mai scurt pe suprafete reduse. Se creaza o economie importanta de forta de munca si spatii de productie.
Odata insusita tehnica de lucru, ea poate fi practicata de catre orice doritor, fara prea multe eforturi, dar cu suficiente cunostinte de biologie celulara, fiziologie, genetica, chimie, asepsie.
5. MICROPROPAGAREA "IN VITRO" LA FREESIA
Dupa Bajaj si Pierik (1974) un cultivar nou de freesia poate fi multiplicat in cca. 8-10 ani intr-un numar de exemplare suficient de mare pentru comercializare, o planta producand, anual, aproximativ 5-6 tuberobulbi.
La noi in tara, reproducand metoda descrisa de Pierik si Steegemans (1975), Cachita si Lazar (1983) apoi Mirghis si Lacatus (1983) au realizat multiplicarea "in vitro" a freesiei utilizand boboci.
Pentru studierea capacitatii regenerative a explantelor de freesia, functie de natura acestora si de faza de dezvoltare in care se afla plantele in momentul recoltarii, respectiv al inocularii, a fost intreprins un experiment comparativ (Cachita si Lazar, 1983, 1984). Intr-o prima etapa au fost recoltate explante nodale, prelevate de la nodul imediat inferior inflorescentei, fasonat astfel incat sa cuprinda o portiune de cca. 2 mm. de deasupra si de sub nod; in paralel, s-au prelevat boboci din apexul inflorescentei, respectiv bobocul terminal si primul boboc subiacent.
Intrucat la inoculii provenind din bobocul terminal al inflorescentelor, aflate in plina anteza, capacitatea regenerativa a fost mai mare, intr-un al doilea experiment s-au recoltat boboci de la inflorescente tinere, avand o lungime de 3- 3,5 mm. Bobocii de la baza inflorescentei prezentau cca. 4- 5 mm. lungime si 2- 3 mm. latime, corola nefiind inca evidenta. La inoculare s-a tinut seama de pozitia ocupata de boboc pe axul inflorescentei.
Materialul biologic a fost dezinfectat timp de 30 de minute in solutie de hipoclorit de calciu 5%, cu adaos de Tween 20. Dupa spalari repetate in apa distilata sterila, s-a trecut la prelevarea si dimensionarea explantelor.
In comparatie cu indicatiile lui Bajaj si Pierik (1975) in aceste experiente au fost efecutate modificari cantitative si calitative in ceea ce priveste reteta mediului de cultura, microelementele, vitaminele, Fe EDTA, s-a scazut concentratia de agar agar si de zaharoza. De asemenea nu s-a utilizat hidrolizatul de caseina si a fost modificata radical balanta hormonala. Reteta de mediu, conform recomandarilor lui Pierik si Bajaj, avea pH-ul 6 si continea, ca auxina, sarea de potasiu a aciduluibetaindolil acetic (AIA), si citochinina (6- ( benzilamino)- 9 ( 2- tetrahidropiranil )- 9 H purina (PBA).
Substratul de cultura, de compozitie originala, la un prim experiment, a constat din: mediu de baza, macroelemente (Murashige- Skoog, 1962), microelemente (Heller), FeEDTA 43 mg/l, vitamine (piridoxina si acid nicotinic, cate 1 mg/l si tiamina 10 mg/ l, mezo- inozitol 100 mg/l, zaharoza 20 g/l, Difco Bacto Agar 7 g/l ). Nivelul pH-ului a fost de 5,8. La mediul de baza s-au adaugat urmatorii regulatori de crestere : mediu de baza lipsit de hormoni (V0); acid α naftilacetic (ANA), 1 mg/l+ benziladenina (BA)- 10 mg/l (V1); ANA- 1 mg/l + BA- 5 mg/l (V2); ANA- 0,1 mg/l, + BA- 5 mg/l (V3); acid β indolilacetic (AIA)- 1 mg/l + BA- 1mg/l + acid giberelic (GA3)- 1 mg/l (V4).
Intr-un al doilea experiment, mediul de baza a fost constituit din macroelemente, microelemente si FeEDTA dupa Murashhige- Skoog (1962), vitamine (tiamina- 0,4 mg/l, acid nicotinic si piridoxina cate 0,2 mg/l,), glicina- 0,8 mg/l, mezo- inozitol 100 mg/l, zaharoza- 30 mg/l si agar 6 g/l. Ca hormoni s- au folosit BA- 2,5 mg/l, iar pH-ul a fost ajustat la valoarea de 5,6.
In primul experiment au fost respectate conditiile recomandate in literatura (timp de 8 saptamani inoculii constand din boboci au fost mentinuti la intuneric, la temperatura de 23 °C, dupa care au fost trecuti la lumina continua); in cel de al doilea experiment, dupa 8 saptamani de intuneric au urmat doua saptamani de lumina si apoi un regim de 16 ore lumina/ 24 ore.
Din aceste experiente a reiesit ca explantele nodale de freesia au diferentiat, de regula, cate 1 lastaras. Sporadic s-a observat si formarea a cate 1- 2 radacini. Regenerarea a 2- 3 lastarasi per un inocul s-a obtinut mai ales la V2. Capacitatea regenerativa a explantelor cultivate pe mediul cu AIA + BA + GA3 (V3) a fost scazuta, sub nivelul inregistrat la inoculii crescuti pe mediu de baza (V0), lipsit de reglatori de crestere.
Bobocii terminali, situati in apexul inflorescentelor si cei subapicali, au dovedit o capacitate regenerativa si de organogeneza diferentiata, dependenta de pozitia ocupata de boboc in inflorescenta si de natura reglatorilor de crestere, prezenti in substratul de cultura.
Pe mediul de baza, lipsit de hormoni (V0), bobocul a crescut mult, dar nu a diferentiat.
In cazul cand mediul a continut BA, dupa trecerea eprubetelor la lumina, procesul de diferentiere si de organogeneza s-a desfasurat foarte rapid. Atat timp cat bobocii au fost tinuti la intuneric florile au crescut, ovarul s-a marit si pe suprafata lui s- au format numeroase excrescente, etiolate. Dupa trecerea inoculilor la lumina continua, excrescentele de pe ovar s- au inverzit, s- au alungit si treptat au luat nastere formatiuni cu aspect pergamentos. Ulterior, din interiorul acestora au aparut frunzele.
In partea bazala a inoculilor, s-au diferentiat radacinute. Bobocii apicali au prezentat o capacitate regenerativa net superioara celei remarcate la inoculii proveniti din bobocii subapicali, in functie de gradul de avansare a procesului de anteza.
In cazul in care s-au prelevat boboci din intreaga inflorescenta, s-a constatat ca cea mai ridicata capacitate regenerativa au prezentat-o bobocii din treimea superioara a inflorescentei. De regula, la inflorescentele care nu au avut boboci in faza avansata de anteza, pozitiile 3 si 4 de sub apexul inflorescentei, au prezentat cea mai ridicata capacitate organogena. Bobocii prea tineri, sau cei aflati in faza prea avansata de anteza, au o capacitate de diferentiere scazuta, generand lent, eventual 1- 2 tulpinite.
Mediul de cultura optim este cel descris anterior, cu 2,5 mg/l BA. Inoculii constand din boboci (respectiv butoni florali) trebuie pastrati o perioada la intuneric- cca. 8 saptamani- dupa care vor fi trecuti la lumina continua sau in regim de lumina 16 ore din 24 ore.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Lucrari pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








