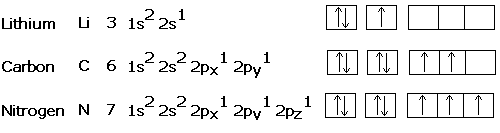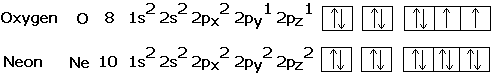| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Configuratia electronica a atomilor |
Configuratia electronica a atomilor
Configuratia electronica a atomilor
Configuratia electronica reprezinta repartizarea electronilor pe straturi, substraturi si orbitali
Electronii tind sa aiba energie cat mai maca, adica sa ocupe locuri cat mai aproape de
nucleu. Aceasta tendinta este limitata deoarece un strat poate fi ocupat de un numar
determinat de electroni.
Electronul distinctiv este electronul prin care atomul unui element se deosebeste de atomul elementului precedent in sistemul periodic.
Reguli de ocupare cu electroni a straturilor si substraturilor
1) Intr-un orbital se pot gasi maxim 2 electroni cu spin opus ( principiul lui Pauli);
2)Electronul distinctiv tinde sa ocupe orbitalul liber de energie minima
3)Un substrat format din mai multi orbitali , se ocupa cu cate un electron fiecare orbital si apoi
electronii se cupleaza( regula lui Hund )
Ordinea ocuparii cu electroni a straturilor si substraturilor este
: 1s; 2s; 2p; 3s; 3p;4s;3d;4p;5s;4d;5p;6s;4f;5d;6p;7s;5f;6d;7p
Substratul 3d are energie mai mare decat substratul 4s si se va completa cu electroni mai intai substratul 4s. La fel substraturile 4d, 5d se vor completa dupa substraturile5s, respectiv 6s. Substratirile 4f si 5f au energii mai mari decat 6s respectiv 7s si se vor completa cu electroni dupa acestea.
Configuratiile electronice ale elementelor.
|
Z |
Denumire |
Simbol |
Configuratie electronica |
||||
|
|
Hidrogen |
H |
1s1 |
||||
|
|
Heliu |
He |
1s2 = [He] |
||||
|
|
Litiu |
Li |
[He] 2s1 |
||||
|
|
Beriliu |
Be |
[He] 2s2 |
||||
|
|
Bor |
B |
[He] 2s22p1 |
||||
|
|
Carbon |
C |
[He] 2s22p2 |
||||
|
|
Azot |
N |
[He] 2s22p3 |
||||
|
|
Oxigen |
O |
[He] 2s22p4 |
||||
|
|
Fluor |
F |
[He] 2s22p5 |
||||
|
|
Neon |
Ne |
[He] 2s22p6 =[Ne] |
||||
|
|
Sodiu |
Na |
[Ne] 3s1 |
||||
|
|
Magneziu |
Mg |
[Ne] 3s2 |
||||
|
|
Aluminiu |
Al |
[Ne] 3s23p1 |
||||
|
|
Siliciu |
Si |
[Ne] 3s23p2 |
||||
|
|
Fosfor |
P |
[Ne] 3s23p3 |
||||
|
|
Sulf |
S |
[Ne] 3s23p4 |
||||
|
|
Clor |
Cl |
[Ne] 3s23p5 |
||||
|
|
Argon |
Ar |
[Ne] 3s23p6 = [Ar] |
||||
|
|
Potasiu |
K |
[Ar] 4s1 |
||||
|
|
Calciu |
Ca |
[Ar] 4s2 |
||||
|
|
Scandiu |
Sc |
[Ar] 4s23d1 |
||||
|
|
Titan |
Ti |
[Ar] 4s23d2 |
||||
|
|
Vanadiu |
V |
[Ar] 4s23d3 |
||||
|
|
Crom |
Cr |
[Ar] 4s13d5 |
||||
|
|
Mangan |
Mn |
[Ar] 4s23d5 |
||||
|
|
Fier |
Fe |
[Ar] 4s23d6 |
||||
|
|
Cobalt |
Co |
[Ar] 4s23d7 |
||||
|
|
Nichel |
Ni |
[Ar] 4s23d8 |
||||
|
Cupru |
Cu |
[Ar] 4s13d10 |
||||
|
|
Zinc |
Zn |
[Ar] 4s23d10 |
||||
|
|
Galiu |
Ga |
[Ar] 4s23d104p1 |
||||
|
|
Germaniu |
Ge |
[Ar] 4s23d104p2 |
||||
|
|
Arsen |
As |
[Ar] 4s23d104p3 |
||||
|
|
Seleniu |
Se |
[Ar] 4s23d104p4 |
||||
|
|
Brom |
Br |
[Ar] 4s23d104p5 |
||||
|
|
Kripton |
Kr |
[Ar] 4s23d104p6 |
||||
|
|
Rubidiu |
Rb |
[Kr] 5s1 |
||||
|
|
Strontiu |
Sr |
[Kr] 5s2 |
||||
|
|
Ytriu |
Y |
[Kr] 5s24d1 |
||||
|
|
Zirconiu |
Zr |
[Kr] 5s24d2 |
||||
|
|
Niobiu |
Nb |
[Kr] 5s14d4 |
||||
|
|
Molibden |
Mo |
[Kr] 5s14d5 |
||||
|
|
Technetiu |
Tc |
[Kr] 5s24d5 |
||||
|
|
Ruteniu |
Ru |
[Kr] 5s24d6 |
||||
|
|
Rodiu |
Rh |
[Kr] 5s24d7 |
||||
|
|
Paladiu |
Pd |
[Kr] 5s24d8 |
||||
|
|
Argint |
Ag |
[Kr] 5s14d10 |
||||
|
|
Cadmiu |
Cd |
[Kr] 5s24d10 |
||||
|
|
Indiu |
In |
[Kr] 5s24d105p1 |
||||
|
|
Staniu |
Sn |
[Kr] 5s24d105p2 |
||||
|
|
Stibiu |
Sb |
[Kr] 5s24d105p3 |
||||
|
|
Telur |
Te |
[Kr] 5s24d105p4 |
||||
|
|
Iod |
I |
[Kr] 5s24d105p5 |
||||
|
|
Xenon |
Xe |
[Kr] 5s24d105p6 = [Xe] |
||||
|
|
Cesiu |
Cs |
[Xe] 6s1 |
||||
|
|
Bariu |
Ba |
[Xe] 6s2 |
||||
|
|
Lantan |
La |
[Xe] 6s25d1 |
||||
|
|
Ceriu |
Ce |
[Xe] 6s24f2 |
Dupa cum se observa, configuratiile 1s2 (dublet) si ns2np6 (octet, n=2-7) sunt configuratii stabile de gaz inert(nobil0.
Exemplificarea aplicarii regulii lui Hund:
Tema; Traduceti din limba engleza textul de mai jos.
Explicati configuratiile anormale ale Cr si Cu pe baza stabilitatii mai mari a configuratiilor d5 si d10(configuratii semistabile)
When two electrons occupy the same orbital, they not only have different spins (Pauli exclusion principle), the pairing raises the energy slightly. On the other hand, a half filled subshell and a full filled subshell lower the energy, gaining some stability. Bearing this in mind, you will be able to understand why we have the following special electronic configurations
|
Cr [Ar]4s1 3d5 |
<=All s and d subshells are half full |
|
Cu [Ar]4s1 3d10 |
<=Prefers a filled d subshell, leaving s with 1 |
|
|
|
|
Nb [Kr]5s1 4d4 |
<=5s and 4d energy levels are close |
|
Mo [Kr]5s1 4d5 |
similar to Cr above |
|
Tc [Kr]5s2 4d5 |
(not special, but think of Hund's rule) |
|
|
|
|
Ru [Kr]5s1 4d7 |
<= Only 1 5s electron |
|
Rh [Kr]5s1 4d8 |
<= in both |
|
Pd [Kr]5s0 4d10 |
<= Note filled 4d and empty 5s |
|
Ag [Kr]5s1 4d10 |
<= partial filled 5s, but filled d |
Tema: Rezolvati aplicatiile din manual,pag. 15-16, testul de evaluare de la pag.16-17 si identificati elementele mentionate la Coltul celor curiosi,pag. 18.
Tese grila:
Sunt particule fundamentale: I:electronii;II:protonii; III:mezonii; IV:neutronii : A)numai I si II; B)numai I si IV; C)numai I, II si IV; D) I, II, III si IV .
Numarul de masa al unui atom se poate calcula insumand: A) numarul de electroni cu numarul de protoni; B) numarul de protoni cu numarul de electroni si cu numarul de neutroni; C) numarul de electroni cu numarul de mezoni; D) numarul de neutroni cu numarul de protoni.
Izotopii au in nucleu acelasi numar de: A)protoni;B)neutroni;C)nucleoni;D)electroni.
Simbolul izotopului uraniului care are in nucleu 92 protoni si 143 neutroni este: A)23592U; B)235143U; C)14392U; D) 92 143U .
Izotopul carbonului pe baza caruia se poate determina vechimea unor fosile este: A)11C; B)12C; C)13C; D)14C.
Numarul maxim de electroni necuplati dintr-un substrat de tip nd este egal cu A)1; B)3; C)5; D)7.
Stratul electronic 5 se noteaza cu litera: A)N; B)O; C)P; D)Q.
Substraturile aceluiasi strat se deosebesc prin: I:energia electronilor; II:numarul maxim de electroni; III:forma orbitalilor; IV:numarul de orbitali de acelasi fel: A) I,II,III si IV ; B) numai II,III si IV; C) numai I, II si IV; D) numai I, III si IV.
Sunt definite corect ,dintre notiunile de mai jos: I:Orbitalii = regiuni ale spatiului din jurul nucleului in care se pot gasi electronii cu probabilitate mare; II:Miscare de spin = miscarea de rotatie a electronului in jurul nucleului; III:Electron distinctiv = electronul prin care atomul unui element se deosebeste de atomul elementului precedent din sistemul periodic; IV:Electronii de valenta = electronii pe care atomul ii poate ceda , accepta sau pune in comun pentru a atinge configuratie stabila de octet:A) I,II , III si IV ; B)numai I si III ; C)numai I , III si IV ; D) numai I , II si IV.
Orbitalii de tip f incep sa se completeze la elementele din perioada: A)3;B)4;C)5;D)6.
Numarul maxim de electroni din stratul N este: A)2; B)8; C)18; D) 32.
Numarul de elemente din perioada a 4-a este: A)2; B)8; C)18; D) 32.
La elementele din perioada a 4-a se completeaza succesiv cu electroni substraturile: A)4s;4p;4d;4f; B)4s;3d;4p; C)4s;2f;3d;4p; D)3d;4s; 4p.
La ocuparea cu electroni a straturilor si substraturilor se respecta,dintre urmatoarele reguli: I:Electronul distinctiv tinde sa ocupe in atom locul vacant de energie minima;II:Ocuparea cu electroni a unui nou strat poate incepe numai dupa ce toti orbitalii din stratul anterior au fost complet ocupati cu electroni; III:Intr-un orbital nu pot exista decat maximum doi electroni de spin opus; IV:Un orbital nu poate fi ocupat cu doi electroni decat dupa ce toti orbitalii substratului respectiv au fost ocupati cu cate un electron. A)I;III;IV; B)I,II,IV; C)I,II,III; D) I,II,III,IV.
Principiul lui Pauli se enunta astfel: A) Electronul distinctiv tinde sa ocupe in atom locul vacant de energie minima. B) Un orbital nu poate fi ocupat cu doi electroni decat dupa ce toti orbitalii substratului respectiv au fost ocupati cu cate un electron. C) Intr-un orbital nu pot exista decat maximum doi electroni de spin opus. D) Ocuparea cu electroni a unui nou strat poate incepe numai dupa ce toti orbitalii din stratul anterior au fost complet ocupati cu electroni.
Regula lui Hund se enunta astfel A) Electronul distinctiv tinde sa ocupe in atom locul vacant de energie minima. B) Un orbital nu poate fi ocupat cu doi electroni decat dupa ce toti orbitalii substratului respectiv au fost ocupati cu cate un electron. C) Intr-un orbital nu pot exista decat maximum doi electroni de spin opus. D) Ocuparea cu electroni a unui nou strat poate incepe numai dupa ce toti orbitalii din stratul anterior au fost complet ocupati cu electroni.
Configuratia electronica a elementului Sc(Z=21) este: A)1s2;2s2;2p6;3s2;3p6;4s2;4p1; B)1s2;2s2;2p6;3s2;3p6;3d3; C)1s2;2s2;2p6;3s2;3p6;4s2;3d1;D) 1s2;2s2;2p6;3s2;3p6;4s1;3d2 .
Configuratia electronica a elementului Cr(Z=24) este: A)1s2;2s2;2p6;3s2;3p6;4s1;3d5; B)1s2;2s2;2p6;3s2;3p6;4s2;3d4; C)1s2;2s2;2p6;3s2;3p6;3d6; D) 1s2;2s2;2p6;3s2;3p6;4s2;4p4 .
Numarul de elemente dintr-o serie completa de metale tranzitionale este: A)6;B)10;C)14;D)egal cu numarul grupei secundare.
In substratul 4f isi plaseaza electronul distinctiv elementele care au numarul atomic Z cuprins in intervalul A)58-71; B)57-70; C)49-62; D)47-60
La elementul cu Z=57 (La) electronul distinctiv se plaseaza intr-un orbital din substratul: A)4f; B)6s; C)6p; D)5d.
Au un substrat nd complet ocupat cu electroni ,dintre atomii elementelor: I: Br(Z=35); II:Zn(Z=30);III:Cu(Z=29);IV:Ca(Z=20) : A) numai II; B) numai I si II; C) numai I,II si III; D) I,II,III,IV.
Numarul de straturi electronice complet ocupate care se gasesc in invelisul electronic al elementului cu Z=104 este egal cu: A)4;B)5;C)6;D)7.
Seria care contine numai ioni cu configuratie de gaz inert este: A) Mg2+ ; S2 ;K+ ;Ba2+ ; B) O2 ; S2 ; Cr 3+ ; Ge4+. C) Cl ;Fe3+ ; Al 3+ ;Br D) O2 ; K+ ; Zn 2+ ;Mg2+
Sunt definite corect ,dintre notiunile de mai jos:I:Izotopii = specii chimice cu acelasi numar de protoni,dar cu numere de masa diferite; II:Energia de ionizare = energia degajata la formarea ionilor pozitivi din atomi, in stare gazoasa; III.Elementul chimic = specia de atomi cu acelasi numar de nucleoni; IV:Configuratia electronica = modul de distribuire a electronilor unui atom pe straturi si substraturi; A)I, II , III si IV B)numai I, II si IV ; C)numai I , III si IV ; D) numai I si IV.
Elementul ai carui atomi au acelasi numar de electroni pe straturile M si N, iar pe stratul O cu doi electroni mai putin decat pe stratul L are numarul atomic: A)84;B)54;C)52;D)34.
Un izotop are numarul de masa de forma A = 100 x + 10 y + z si numarul atomic de forma Z = 10 z + y. Suma x + y + z este egala cu 17, iar numarul de neutroni este egal cu 118. Elementul este plasat in sistemul periodic in blocul de elemente de tip A)s; B)p; C)d; D)f.
( S.Nenciulescu, N.Negoita, I.Popa, . -Culegere de teste grila de chimie anorganica pentru admiterea la Universitatea Pitesti, 1998)
Exersitii si probleme de dificultate mai mare (selectie olimpiada)
Alegeti raspunsul correct din cele cinci variante propuse la fiecare intrebare: Pentru intrebarile cu raspuns numeric (marcate cu asterisc)prezentati si calculele facute.
.Ionii cu structura atomului de argon sunt: a) Mg2+, Cl-, Ca2+, S2-; b) K+, Cl-, S2-, Ca2+; c) Sc3+, S2-, Cr3+, Ca2+; d) Cl-, S2-, Ca2+, Al3+; e) alta varianta.
Se dau speciile atomice: Br-, Cl-, S2-, O2-, P3-, K+, Ar, Mg2+, Al3+, Ca2+, Kr. Sunt izoelectronice perechile: a) Ar, Cl-, S2-, Ca2+, P3-, K+; b) O2-, Mg2+, Al3+, Br-; c)Br-, Kr, Ar, ; d) P3-, K+, Kr; e) nici un raspuns corect.
Elementul care are cate x electroni pe straturile M si N iar pe stratul O cu 3 electroni mai putin decat pe stratul L este: a) Br; b) I; c) Sn; d) Sb; e) Te
Numarul de masa al izotopului care contine 38 neutroni si 1 electron in substratul 4p este: a) 71; b) 70; c) 68; d) 69 ; e) 72
(*)Configuratia electronica a metalului X este: K xe-, L ye-, M ye-, N --> xe-. 74 g de baza a metalului X reactioneaza cu 100 g solutie H2SO4 de concentratie 49%. Masa de baza reactionata si masa totala de solutie H2SO4 necesara neutralizarii complete a bazei este: a) 74g baza, 100g solutie; b) 148g baza, 50g solutie; c) 37g baza, 200g solutie; d) 3,7g baza, 100g solutie; e) alta varianta
Speciile chimice care au 10 electroni in substratul 3d sunt: a) Cu, Cu+, Cu2+; b) Zn, Zn2+, Cu, Cu+, Cu 2+, Ga3+; c) Zn, Cu, Ca; d) Zn, Ca; e) Zn, Zn2+, Cu, Cu+, Ga3+, Ge4+.
(*)Elementele E1 si E2 au ionii E1+ si E2- izoelectronici cu argonul. Masa de solutie de acid de concentratie 21,9% care se obtine din 6 moli sare E1E2 prin tratare cu solutie de H2SO4 de concentratie 80% este: a) 0,5kg; b) 500g; c) 2 kg; d) 1000 g ; e) variantele a) si b)
Masa molara a oxidului X2O5 este 142 g/mol si atomul X are 3 electroni in substratul 3p. Numarul de neutroni pe care-i contine nucleul atomului X este a)31 n0; b) 30 n0; c) 15 n0; d)16n0; e) alta varianta.
Proportiile in care se gasesc izotopii 36Li si 37Li in elementul natural, daca masa atomica a litiului este 6,93 sunt:a) 93%; 7%; b) 10%; 90%; c)7%; 93%; d) 90%; 10%; e) alta varianta
Elementul A are numarul atomic cu 3 mai mic decat al unui element B al carui ion negativ divalent este izoelectronic cu atomul gazului rar din perioada a 3-a. Elementele A si B sunt: a) B si O; b) Al si S; c) Cl si Ca; d) Ga si Se; d) alta varianta
Raportul dintre volumul atomului si volumul nucleului pentru atomii a carui raport dintre raza atomului si raza nucleului este 2,155x105, este: a) 1016; b) 1015; c) 4,644x106; d) 4,644x1010; e) nici un raspuns corect.
Referitor la elementele perioadei a 4-a afirmatia corecta este: a ) au maximum 32 electroni pe stratul 4; b) au maximum 18 electroni pe stratul 4; c) au maximum 8 electroni pe stratul 4; d) au maximum 2 electroni pe stratul 4; e) alta varianta
Diferenta dintre masele atomice ale elementelor X si Y este egala cu sarcina nucleara a elementului Y. Numerele atomice ale elementelor X si Y sunt: a) 12 si 8; b)16 si 24; c) 31 si 39; d) 18 si 10; e) alta varianta.
Intre numerele atomice ale elementelor chimice A, B si C exista relatiile: 2(ZC+ZA) = ZB/2 + 16 ; ZB-2ZA = ZC/4 + 4; ZC -2 = 2√9. Referitor la elementele A, B, C este corecta afirmatia: a) raza atomica a lui B este mai mica decat raza atomica a lui A; b) C are 8 electroni de valenta; c) A este metalul alcalino-pamantos din perioada a 2-a; d) A, B si C sunt situate in aceeasi perioada a sistemului periodic; e) ionii elementelor B si C sunt izoelectronici.
Pentru elementele chimice X, Y, Z cu sarcinile nucleare x-2, x, x+3, suma sarcinilor nucleare este 22. Referitor la elementele X, Y, Z este incorecta afirmatia: a) Z are configuratie stabila de octet pe ultimul strat; b) X are electronul distinctiv plasat intr-un substrat de tip p; c) rX >rY >rZ; d) Y este izoelectronic cu X-2; e) Y are 3 substraturi si 5 orbitali.
Nu este corecta afirmatia referitoare la orbitalii de tip p:a). sunt in numar de 3 b). apar in stratul K si se regasesc in toate celelalte straturi exterioare c). pot cuprinde maxim 6 electroni d). au simetrie bilobala e). apar in stratul L
(*)80% din masa corpului unui copil care cantareste 27 kg este apa. Numarul de neutroni care participa la formarea apei din corpul copilului este:a). 5,80∙1024 b). 7,22∙1023 c) 7,22∙1025 d). 5,78∙1027 e). 2,70∙1023
(*)2 moli amestec echimolecular de hidrogen si oxigen contin:a). 4 g H b). 16 g O c) 94,11% O d). 10% H e). 1 g H
Cati electroni de tip p si cati de tip d se gasesc in invelisul electronic al elementului cu Z = 29 ? a). 6, 10 b). 18, 6 c). 12, 10 d). 12, 9 e). 15, 14
Se indeparteaza electroni din orbitali d la formarea cationilor: a) Cu+, Na+, Zn2+ b) Mg2+, K+, Co2+ c) Fe2+, Co2+, Ni2+ d) Co2+, Cr3+, Sc3+ e) Fe3+, Cr3+, Cu2+
Isi pierde mai greu un electron prin ionizare: a) B fata de Be b) Ar fata de Cl c) Cr fata de Mn d) Si fata de P e) Ag fata de Pd
Care dintre elementele urmatoare C, N, Ne, P, Cl, Zn, Ni, Fe, Cr, Co contin in structura lor subnivele semiocupate cu electroni?a) N, P, Cr b) N, P, Ni c) P, Cr, Fe d) Cr, C, Cl e) N, P, Co
Se indeparteaza electroni din orbitali d la formarea cationilor: a) Cu+, Na+, Zn2+ b) Mg2+, K+, Co2+ c) Fe2+, Co2+, Ni2+ d) Co2+, Cr3+, Sc3+ e) Fe3+, Cr3+, Cu2+
Formula hidrurii elementului a carui izotop are 12 protoni si 12 neutroni in nucleu este: a) EH3; b) EH; c) EH2; d) EH4; e) H2E
(*)Masa de NaCl rezultata din reactia clorului cu sodiul daca pe ultimele doua straturi electronice ale tuturor atomilor de clor care intra in reactie graviteaza 1,806x1023 electroni, este: a) 2,34 g; b) 1,17 kg; c) 1,17g ; d) 0,585 g; e) 5,85 g
(*) Un halogen X2 reactioneaza cu 11,7g metal M al carui ion monovalent este izoelectronic cu argonul si formeaza 22,35g sare. Masa de X2 care participa la reactie este: a) 1,065g Br2 b) 10,65g Cl2; c) 10,65g Br2; d) 21,3g Cl2; e) alta varianta
Referitor la la ioni afirmatia corecta este: a) anionii sunt ioni cu sarcina pozitiva; b) cationii sunt ioni cu sarcini negative; c) ionii sunt specii atomice cu acelasi numar de protoni dar cu numar de neutroni diferit; d) ionii negativi au raza mai mica decat a atomului din care provine; e) ionii sunt specii atomice cu numar diferit de protoni si de electroni.
(*) Volumul solutiei de NaOH 0,5M necesar pentru a neutraliza 2,56 kg solutie HI 20% este: a. 4 L b. 8 L c. 2 L d. 6 L e. 10 L
(*)Intr-un vas de reactie de 1 L, pentru obtinerea HI se introduc 8 moli hidrogen si 5 moli iod. Stiind ca randamentul de transformare a iodului este 40%, volumul amestecului gazos la sfarsitul reactiei este:a. 291,2 L b. 183,6 L c. 201,6 L d. 264,32 L e. 246,4 L
O proba de carbon contine 43,365 · 1023 protoni. Alegeti afirmatia incorecta:a) proba de carbon contine 4,3365 · 1024 electroni b) proba de carbon contine 7,2275 · 1023 atomi de carbon c) izotopul cu acelasi numar de protoni si 5,782 · 1024 neutroni este utilizat in arheologie.d) izotopul ce contine acelasi numar de protoni si 43,365· 1023 neutroni este utilizat in arheologie; e) masa probei este 14,4 grame.
Despre compusul X2YZ3 se cunosc urmatoarele: configuratia electronica a elementului X contine doar doi orbitali cu forma sferica;configuratia electronica a elementului Y, situat in aceeasi perioada cu elementul X contine 3 substraturi ocupate cu acelasi numar de electroni; substratul 2p al elementului Z este ocupat cu electroni in proportie de 66,67 %.Este incorecta afirmatia: a) compusul X2YZ3 se descompune la temperatura formand 2 oxizi b) compusul X2YZ3 reactioneaza cu HCl cu efervescenta c) compusul X2Z se formeaza prin sinteza directa din elemente d) elementul X se aseamana pe diagonala cu Mg e) compusul X2YZ3 nu se descompune la temperatura
(*)La amestecarea a
(*)La amestecarea a
(*)Solutia de piatra vanata (CuSO4∙5H20) se foloseste in tratamentul vitei de vie. Care este concentratia procentuala a solutiei rezultate prin dizolvarea a 0,4 moli piatra vanata in 400 g apa?a. 20% b. 40% c. 10% d. 6,4% e. 12,8%
(*)In cenusa planetelor se afla 14 ÷ 25% K2O. Masa de KOH care se obtine la dizolvarea in apa a unui kilogram de cenusa care contine procentul maxim de K2O este: a. 0,297 kg b. 2,97 kg c. 29,7 g d. 2,97 moli e. nici un raspuns
(*)Masa de calcar natural cu 80% carbonat de calciu, necesar pentru a obtine 37 kg de var stins este: a. 31,25 kg; b. 28 kg; c. 70 kg; d. 50 kg; e. 62,5 kg
(*)Daca procentul de calciu in CaCl2∙nH2O este 27,21%, valoarea lui n este:a. 1 ; b. 3; c. 4 ; d. 2; e. 5
(*)Clorura unui metal
trivalent care contine 20,22% metal participa la urmatoarele
reactii: MCl3![]() ; A + NaOH
; A + NaOH![]() B ; Continutul
procentual in sodiu al substantei B este: a. 20% ; b. 19,49%; c. 15%; d.
17,2 %;e. nici un raspuns corect
B ; Continutul
procentual in sodiu al substantei B este: a. 20% ; b. 19,49%; c. 15%; d.
17,2 %;e. nici un raspuns corect
(*)In ce raport de masa trebuiesc amestecate solutiile A de concentratie 20 % si B de concentratie 70 % pentru a rezulta o solutoe de concentratie 50 %?a)A : B = 3 : 2; b)A : B = 2 : 3; c)A : B = 2 : 7; d)A : B = 7 : 2;e)A : B = 1 : 1
(*)Se amesteca 154 g solutie BaCl2 20% cu 98 g solutie H2SO4 16,4 %. Concentratia procentuala a solutiei rezultate este: a)3,61 % HCl, 11,53 % BaSO4;b)10,3 % BaCl2, 4,85 % H2SO4; c)2,04 % HCl; d)4,28 % HCl; e)raspunsurile a - d nu corespund
*)Culoarea turnesolului in solutia obtinuta in urma reactiei dintre 5 g solutie HCl 10 % cu 5 g solutie soda caustica 10 %: a)rosu ; b)violet ; c)albastru; d)orange; e)raspunsurile a - d nu corespund
(*)Se introduc 4,6 grame sodiu in 200 g solutie NaOH cu 80 % O. . A. concentratia procentuala a solutiei initiale de NaOH este 18,2 %.; B. prin adaugarea Na metalic concentratia procentuala a solutiei de NaOH scade cu 19,35 %.; C. prin adaugarea Na metalic concentratia procentuala a solutiei de NaOH creste cu 19,35 %..Sunt adevarate afirmatiile: a) A ;b) B ;c) C; d) A si B; e) A si C
(*)Apa de mare are o concentratie in NaCl de 0,46 mol/l. Cantitatea de NaCl care se obtine din 10 l apa de mare este:a. 26,91 g b. 269,1 g c. 2,691 kg d. 4,6 g e. nici un raspuns
(*)Sulfatul de magneziu administrat intramuscular sau intravenos in solutie 20% are actiune sedativa. Ce cantitate de MgSO4 7H2O se dizolva in apa pentru a prepara 150 g solutie 20%.a. 61,5 g b. 30 g c. 60 g d. 31,5 g e. 40 g
Intre elementele Ca, F si H se pot forma compusii ionici: a. CaH, FH b. HF, HCa c. CaH2, CaF2 d. HF, CaH e. nici un compus ionic
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Analize pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||