
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Determinarea caldurii de formare a cristalohidratului din sare dehidratata |
Determinarea caldurii de formare a cristalohidratului din sare dehidratata
Determinarea caldurii de formare a cristalohidratului din sare dehidratata
Scopul lucrarii: Determinarea caldurii de hidratare a CuSO4.
Aparatului si reagentii: termostat, calorimetru, termometrul lui Beckmann, cintar analitic, mojar, cintar tehnic, secundamer, CuSO4 si CuSO4 * 5H2O.
ASPECTE TEORETICE
Caldura de hidratare Hhidr. reprezinta cantitatea de caldura schimbata intre sistem si mediul exterior la formarea unui mol de cristalohidrat solid din sarea solida anhidra si apa, in conditii constante.
De exemplu, pentru sulfat de cupru, in reactia
CuSO4 + H2O = CuSO4· 5H2O ∆Hdiz.(CuSO4(s)) (1)
Caldura de
hidratare poate fi determinata pe o cale indirecta, utilizind legea
de baza in termochimie, descoperita de G.I.Hess in anul 1840, conform
careia, efectul termic al procesului nu depinde de calea de parcurgere a
lui, insa depinde de starea
substantelor in momentele initial si final.
Cu ajutorul acestei
legi pot fi calculate efectele termice ale transformarilor,
efectuarea experimentala carora este imposibila.
In cazul precautat se determina calorimetric caldurile de dizolvare ale CuSO4 si CuSO4 * 5H2O, adica efectele termice ale proceselor de dizolvare:
CuSO4(s) + H2O = CuSO4 (aq) ∆Hdiz(CuSO4(s)) (2)
CuSO4 · 5H2O(S) + (n-5) H2O = CuSO4(aq) ∆Hdiz(CuSO4 · 5H2O (s)) (3)
n - fiind un numar mare de moluri de apa care contribuie la obtinerea unei solutii apoase diluate. Raportul intre cantitatile substantei dizolvate si a solventului este mai mare de l:250-300, atunci dilutia de mai departe nu influenteaza asupra marimii caldurii de dizolvare.
Conform legii lui Hess aceste doua procese (2) si (3) se pot combina liniar cu scopul de a determina efectul procesului termic de hidratare (1):
∆Hhidr.CuSO4(s) = ∆Hdiz.(CuSO4(s)) - ∆Hdiz.(CuSO4 * 5H2O(s)) (4)
Schema calculului termic poate fi exprimat astfel:
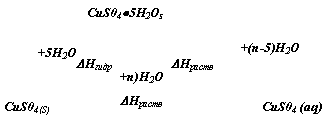
Efectuarea experimentala a lucrarii.
Utilizind un calorimetru adiabatic (cu izolare termica) se determina caldurile (integrale) de dizolvare ale unui mol de sulfat de cupru anhidru si de sulfat de cupru cu 5 molecule de apa intr-o cantitate anumita de apa.
Pentru determinarea caldurii de dizolvare este necesar cunoasterea constantei calorimetrice, care prezinta cantitatea de caldura necesara pentru incalzirea sistemului cu l° C, si care in acest caz:
Qp = ∆Hdiz. = Cp∆T (6),
unde ∆T - este variatia de temperatura inregistrata la dizolvarea unei cantitati de sare ms cunoscute intr-o anumita cantitate de apa.
In calorimetru se toarna 300 ml de apa. Se cintareste 8 g de CuSO4·5H2O fin maruntit. Deoarece dizolvarea cristalohidratului de sulfat de cupru este condus de absorbtia caldurii, iar dizolvare sulfatului de cupru dehidratat - de eliminarea caldurii, cu scopul de a economisi timpul, meniscul mercurului in capilarul termometrului lui Beckmann se stabileste in regiunea valorii 2,0-2,4.
La fel cum s-a procedat in lucrarea de laborator Nr. l, se determina variatia temperaturii in perioadele initiala, principala si finala. Din graficul ∆T = f(τ) se calculeaza caldura integrala de dizolvare (Valoarea corespunzatoare unui mol de sare) pentru concentratia data:
Hdiz. = QP/ns = Cp∆T/ns = K(∆T/ns) (7),
unde ns = ms/Ms;
ns - fiind numarul de moli, iar Ms - masa molara a sarii.
9 - 10 g de cristalohidrat de sulfat de cupru fin maruntit intr-un mojar de portelan si incalzit prin amestec pina la obtinerea unui praf de culoare alba al sarii anhidre, se raceste in exicator. Sarea anhidra se cintareste in cantitatea necesara, calculata reiesind din 8 g de CuSO4 · 5H2O.
Paralel se determina variatia temperaturii in etapa initiala a unei noi portiuni de 300 g de apa, se varsa cantitatea cintarita de sare si in continuare se determina variatia temperaturii cum e descris in lucrarea Nr. 1. Caldura integrala se calculeaza dupa formula (7). Cunoscind valorile caldurilor integrale de dizolvare ale CuSO4 (S), se poate calcula caldura de hidratare a sarii anbidre, conform ecuatiei (4;5).
|
Tabelul rezultatelor obtinute. Intervalul de timp a masurarilor τ = 0,5 minute.
|
Lichidul Studiat |
Variatia temperaturii |
|||||||||||||||
|
Apa |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Solutie CuSO45H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Solutie CuSO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Darea de seama pe marginea lucrarii:
Se prezinta:
- Scopul, continutul pe scurt al lucrarii, esenta lucrarii.
Graficul variatiei temperaturii in functie de timp.
Se calculeaza efectul termic de hidratare a sarii anhidre.
Intrebarile pentru pregatirea catre lucrarea de laborator Nr. 2
Definitia caldurii de dizolvare. Cum se poate determina?
Cum se poate determina caldura de hidratare?
Legea lui Hess.
Consecintele legii lui Hess.
In care cazuri se foloseste legea fundamentala a termochimiei ?
Ce procese au loc la dizolvarea unei sari cristaline si care este mecanismul?
In ce consta metoda calorimetrica de determinare a caldurii de hidratare a unei sari anhidre?
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2026 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Lucrari pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








