
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Izomeria spatiala (stereoizomeria) - izomeria geometrica (cis-trans), izomeria de conformatie, izomeria optica |
Izomeria spatiala (stereoizomeria) - izomeria geometrica (cis-trans), izomeria de conformatie, izomeria optica
Izomeria spatiala (stereoizomeria)
Formulele clasice de structura arata modul in care sint legati atomii intr‑o molecula, dar nu dau nici o indicatie asupra asezarii relative a atomilor in spatiu, adica asupra configuratiei moleculelor. Stereochimia completeaza cunostintele despre structura combinatiilor organice prin faptul ca indica elementele geometrice relative la molecula, forma, simetria si dimensiunile ei; ea explica existenta izomeriei spatiale sau a stereoizomeriei.
Izomeria spatiala este o forma de izomerie la care doua substante avind aceeasi compozitie si structura, difera prin pozitiile relative in spatiu ale unor atomi constituenti (sau grupe constituente) din molecula. Izomeria spatiala este de doua tipuri: izomeria geometrica si izomeria optica.
1. Izomeria geometrica (cis-trans)
Cind in molecula unei combinatii chimice doi atomi de carbon sint uniti printr‑o legatura dubla, sistemul devine partial rigid, ceea ce are drept urmare impiedicarea rotatiei libere. Astfel, pentru doi substituenti la atomii de carbon cu dubla legatura, devin posibile doua pozitii - cind ei se vor afla de aceeasi parte a planului legaturii duble - deci la distanta minima unul de altul (izomerul cis-) sau cind se vor afla in parti opuse - la distanta maxima (izomerul trans-).
Un exemplu de substanta care are doi izomeri, unul cis- si altul trans-, este 1,2-dicloroetilena, CHCl CHCl:
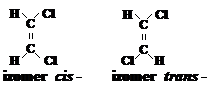
Acest fel de stereoizomerie este denumita izomerie geometrica sau izomerie cis-trans (Baeyer, 1888).
2. Izomeria de conformatie
Izomeria de conformatie este un tip de stereoizomerie care apare in cazurile combinatiilor organice si care prezinta aceeasi configuratie, dar se diferentiaza prin pozitia substituentilor in jurul unor legaturi s. Izomerii se numesc conformeri sau rotameri. Prin conformeri se inteleg diferitele pozitii spatiale ale atomilor intr-o molecula organica care, prin rotatie in jurul unei simple legaturi, pot fi trecute una in locul alteia. Datorita faptului ca unghiul de rotatie (torsiune), cel putin teoretic, poate avea orice valoare cuprinsa intre 0 si 360 , pentru molecula data, exista un numar practic nelimitat de conformeri. Energia interna a acestora este insa diferita, deoarece conformerii se deosebesc prin distantele interatomice si unghiurile de torsiune. In functie de aceste unghiuri, conformerii pot fi clasificati in doua categorii mari: conformeri intercalati si eclipsati. Conformerii eclipsati au unghiuri de torsiune de 0, 120 sau 240 si au toti substituentii atomilor de carbon cu simpla legatura la distanta minima reciproca. Ca exemple pot servi conformatiile eclipsate a 1,2‑dibromo‑1,2‑dicloroetanului (fig. 1.1):

Conformerii intercalati au un unghi de torsiune 60, 180, 300 si au toti substituentii atomilor simplei legaturi la distanta maxima reciproca (fig. 1.2).
Rotatia in jurul legaturii s comporta variatii ale energiei, datorita interactiunilor electronice si sterice din molecula. Ca urmare, din numarul teoretic nelimitat de conformatii posibile, molecula le va adopta pe acelea care ii asigura o energie interna minima, corespunzatoare unei geometrii moleculare optime. Orice deviere de la aceasta duce la marirea energiei interne prin aparitia unei tensiuni conformationale. In general, conformatiile eclipsate au o energie mai mare decit cele intercalate. Diferenta de energie dintre ele denumita tensiune de torsiune (Pitzer) nu este in mod obisnuit prea mare si, in consecinta, poate fi furnizata de energia termica a moleculelor. Conformatiile trec in consecinta unele in celelalte la temperaturi in jurul celei ambiante.

Totusi, marea majoritate a moleculelor se afla la un moment dat in conformatia de energie minima care este una dintre conformatiile intercalate. Celelalte conformatii intercalate sint populate cu un numar atit mai mic de molecule cu cit energia lor este mai ridicata. Conformatiile eclipsate sint doar momente de tranzitie intre doua conformatii intercalate.
Stabilitatea relativa a conformatiilor cit si corelarea intre conformatiile moleculelor si proprietatile lor este studiata de analiza conformationala. De exemplu, s-a dovedit ca in seria alcanilor sau altor derivati ai alcanilor cea mai favorizata conformatie este cea in care toate legaturile C-C si C-H sint intercalate, ceea ce corespunde asezarii zig-zag a tuturor atomilor de carbon din catena moleculara:
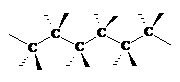
In stare cristalina, astfel de molecule cu catena in zig-zag sint aranjate in straturi paralele la distanta minima unele de altele. In stare topita sau in solutie, majoritatea moleculelor ramin in aceasta conformatie mai stabila.
In seria cicloalcanilor pentru ciclurile cu 6 atomi cum este, de exemplu, ciclohexanul, ciclul poate adopta conformatie neplana lipsita complet de tensiuni angulare (in care se pastreaza valoarea unghiului de valenta a atomilor de carbon hibridizati sp3 egal cu 109 28 Se observa cu usurinta posibilitatea existentei a doua conformatii neplane lipsite de tensiune angulara, care sint cunoscute in prezent sub denumirea de conformatie scaun si baie (barca).
|

Ambele forme sint lipsite de tensiuni angulare, dar difera prin tensiunile conformationale. Astfel, in timp ce forma scaun este practic lipsita de tensiuni conformationale avind toate legaturile intercalate, forma baie are unele legaturi eclipsate (C1-C2 cu C3-C4 si C1-C6 cu C4-C5) si altele intercalate (C1-C2 cu C5-C6, C1-C6 cu C2-C3, C3-C4 cu C5-C6, C4-C5 cu C2-C3). Din acest motiv molecula este in ansamblu mai bogata in energie - cu 24,6 kJ/mol - si deci mai putin stabila. Forma baie prezinta ca urmare fenomenul de pseudorotatie si este o forma flexibila, spre deosebire de forma scaun care este rigida. Tinind cont de faptul ca diferentele de energie dintre diversele conformatii ale ciclohexanului nu sint foarte mari, la temperatura obisnuita exista un echilibru conformational intre forma scaun - baie si respectiv forma scaun inversata, care in cazul ciclohexanului nesubstituit este echivalenta cu prima:
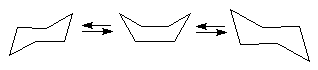
Datorita stabilitatii mult mai mari a formei scaun, ciclohexanul si marea majoritate a derivatilor sai se gasesc in aceasta conformatie la temperatura obisnuita. Calculul termodinamic simplu indica faptul ca la circa 10 molecule in conformatie scaun exista doar una in conformatie baie .
Dintre cele 12 legaturi C-H in conformatia scaun, sase care pot fi considerate aproximativ paralele cu axa de simetrie se denumesc axiale, iar celelalte care sint perpendiculare acestei axe se denumesc ecuatoriale:

Atomii de hidrogen in pozitie ecuatoriala sau axiala se afla unii fata de altii in ciclohexanul nesubstituit la o distanta de 0,25 nm. Deci atomii de hidrogen din pozitiile 1,3 diaxiale sint relativ apropiati in spatiu cea ce da nastere unor tensiuni van der Vaals (interactiuni 1,3 diaxiale). Micsorarea acestei tensiuni se poate realiza printr-o oarecare aplatizare a ciclului cu marirea concomitenta a unghiului de valenta la 112O, ceea ce duce la indepartarea atomilor de hidrogen din pozitia 1,3 diaxiala dar in acelasi timp la o marire a tensiunii angulare si conformationale. Se ajunge de fapt la o situatie de echilibru in care energia globala de tensiune este minima. In cazul derivatilor monosubstituiti ai ciclohexanului, interactiunile 1,3 diaxiale vor fi mai puternice, motiv pentru care substituentii prefera pozitia ecuatoriala. Trecerea conformerului axial in cel ecuatorial se face prin inversia ciclului.
3. Izomeria optic a
Acest tip de izomerie este determinat la compusii organici de asimetria lor moleculara. Sint considerate asimetrice acele molecule care nu se pot suprapune peste imaginea lor in oglinda (sint nesuperpozabile). Prezenta acestei particularitati structurale la un compus organic oarecare este pusa in evidenta prin studiul comportarii sale in lumina polarizata: substantele care prezinta asimetrie moleculara rotesc planul de polarizare a luminii polarizate. Din acest motiv ele sint numite optic active si prezinta izomerie optica. Orice substanta optic activa apare intotdeauna sub forma unei perechi (cel putin) de structuri numite antipozi optici sau enantiomeri (din limba greaca: enantios - opus, meros - parte). Deoarece compozitia si proprietatile fizico-chimice sint riguros identice pentru ambii termeni ai unei perechi de enantiomeri, deosebirea dintre ei se stabileste tot din comportarea fata de lumina polarizata. Enantiomerul care roteste planul de polarizare spre dreapta sau in directia acelor unui ceasornic este denumit dextrogir si notat cu semnul ( ); cel care roteste planul de polarizare spre stinga sau in sens opus acelor unui ceasornic este denumit levogir si notat cu semnul (-). Din valoarea unghiului de rotatie, a, se calculeaza pentru substantele optic active o constanta a , numita rotatie specifica si care in cazul solutiilor este: a tD 100 a l c, unde l este lungimea stratului de solutie strabatut de raza luminoasa (in decimetri) si c - concentratia substantei in solutie (g/cm3), a - valoarea unghiului de rotatie determinat (grade), t - temperatura, D - denota ca rotatia a fost determinata pentru linia D a sodiului (lungimea de unda 589 nm). Cei doi enantiomeri ai unei substante optic active au aceeasi putere rotatorie (rotesc cu acelasi unghi a planul de polarizare), insa in sens opus ( a, ‑a). Din acest motiv amestecul echimolecular al celor doi enantiomeri este optic inactiv, prin compensarea reciproca a unghiurilor de rotatie. Un astfel de amestec este numit racemic si se noteaza cu simbolul (
De cele mai dese ori asimetria moleculara apare la substantele care au atomi de carbon asimetric. Un atom de carbon este asimetric atunci cind are patru liganzi (atomi sau grupe de atomi legate de el) diferiti intre ei. In acest caz, datorita structurii tetraedrice a atomului de carbon, rezulta o pereche de aranjamente spatiale (enantiomeri) care se comporta intre ele ca obiectul si imaginea sa in oglinda, sau ca mina stinga si mina dreapta. Astfel de molecule nu pot fi suprapuse cu imaginea lor in oglinda cum nu poate fi suprapusa mina dreapta si stinga. Ele se numesc hirale (grec. Heir - mina), iar atomul de carbon asimetric - centru hiralic (fig. 1.3).
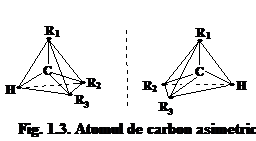
Prezenta intr-o molecula organica a unui atom de carbon asimetric determina hiralitatea moleculara si genereaza o pereche de enantiomeri, ( ) si (-). De exemplu in cazul acidului 2‑cloropropanoic CH3 CHCl COOH, atomul de carbon din pozitia 2 este asimetric. El are patru substituenti: ‑H, ‑CH3, ‑COOH si ‑Cl. Din acest motiv, compusul respectiv exista in doua forme enantiomere, levogir si dextrogir (fig. 1.4)

Enantiomerii au aceleasi proprietati fizice si chimice, deosebindu-se intre ei numai prin semnul unghiului de rotatie; amestecul lor echimolecular va fi un racemic (lipsit de activitate optica).
Compusii organici optic activi, ce contin un atom de carbon asimetric, sint foarte numerosi; cei raspinditi in natura apar ca enantiomeri distincti, fie numai cel ( ), fie numai cel ( ), ca in cazul hidroxiacizilor, aminoacizilor etc. Produsii de sinteza insa sint in majoritatea cazurilor amestecuri racemice.
Reprezentarea substituentilor in jurul atomului de carbon asimetric se poate face in doua moduri diferite. Astfel, configuratia unei molecule este demonstrata ca imagine in oglinda a celeilalte molecule (fig. 1.4). Dar pentru simplificarea prezentarii izomerilor s-a convenit folosirea unor formule de proectie (Fischer) care reprezinta proiectarea tetraedrilor pe planul ce trece prin atomul de carbon asimetric (fig. 1.5).
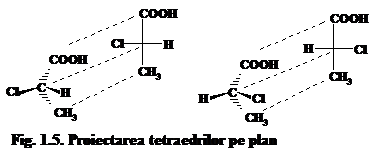
Pentru proiectare tetraedrul este aranjat de fiecare data asa incit catena hidrocarbonat sa fie pe linia verticala si grupa functionala superioara in partea de sus. Gruparile proiectate pe linia verticala in realitate vor fi situate dupa planul de proiectie, iar cele de pe liniile orizontale - in fata lui. Cind se face uz de formulele de proiectie, acestea pot fi translate pentru suprapunere una cu alta numai in planul desenului. Rotatia lor la unghiul de 180 si 360 se admite. Prin rotatie in plan la 90 si 270 se ajunge la formula de proiectie a enantiomerului.
Diferentierea enantiomerilor se poate face cel mai simplu prin determinarea sensului si valorii unghiului de rotatie a planului de polarizare. Insa nu exista o legatura simpla intre sensul rotatiei si dispunerea in spatiu a atomilor moleculelor respective. Acest lucru reiese foarte sugestiv si din faptul ca prin oxidarea ( )‑gliceraldehidei se obtine acidul (-)‑gliceric, desi nu este afectata configuratia atomului asimetric:

Pentru abordarea problemei E. Fischer (1890-1900) alege drept compus standard ( )‑glucoza, mai exact configuratia celui de-al cincilea atom de carbon din ( )‑glucoza. El considera prin conventie ca in formula de proiectie la acest atom de carbon grupa OH se afla in dreapta. In cercetarile ulterioare H. Rozanov (1906) a gasit ca ( )‑glucoza nu este standardul cel mai potrivit. El alege ( )‑gliceraldehida, atribuindu-i conventional configuratia cu hidroxilul in dreapta in formula proiectiva:
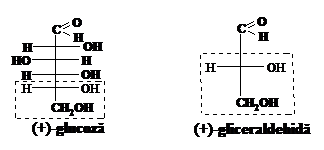
Toate substantele care erau inrudite cu ( )‑gliceraldehida au fost considerate ca facind parte din seria D, iar cele inrudite cu (‑)‑gliceraldehida din seria L. Pentru specificarea configuratiei se noteaza prin literele D si L in fata denumirii seria din care fac parte, cum ar fi de exemplu:
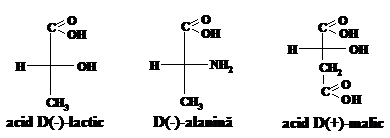
Toate moleculele hirale din seria D se prezinta in formula de proiectie cu atomul de carbon cel mai oxidat in partea de sus si grupa functionala in dreapta.
Specificarea D, L a configuratiei este deci posibila numai dupa cunoasterea configuratiei relative a moleculei respective fata de ( )‑gliceraldehida prin efectuarea unor cercetari experimentale de stabilire a inrudirii configurative. Necatind la aceasta ea ramine uzuala pentru hidroxiacizi, aminoacizi si hidrati de carbon pina in zilele de azi. De notat ca pentru specificarea D,L a configuratiei hidroxiacizilor si aminoacizilor se ia in consideratie primul atom de carbon asimetric, iar a hidratilor de carbon - ultimul carbon asimetric.
Izomeria optica a unor compusi cu mai multi atomi de carbon asimetrici. Substantele care contin in molecula un singur atom de carbon asimetric, de exemplu acidul lactic, acidul malic, 2-pentanolul etc., se prezinta sub forma de doi izomeri optic activi, care pot forma un amestec racemic. Sint insa si substante care au mai multi izomeri optici, datorita prezentei a cel putin doi atomi de carbon asimetrici in molecula ei. Cu cit numarul atomilor de carbon asimetrici este mai mare, cu atit numarul izomerilor optic activi si inactivi este mai mare. Pentru a exemplifica, sa examinam cazul general cel mai simplu si anume al unei substante cu doi atomi de carbon asimetrici, notati C1 si C2 precedati de semnul ( ) sau ( ), dupa semnul de rotatie. La asemenea substanta exista urmatoarele posibilitati de aranjare:
|
I |
II |
III |
IV |
|
C1 |
-C1 |
C1 |
-C1 |
|
C2 |
-C2 |
-C2 |
C2 |
Combinatiile I si II sint optic active: ambii atomi de carbon conditioneaza rotatia planului de polarizare in acelasi sens. Aceste combinatii sint enantiomeri. La combinatiile III si IV un atom de carbon conditioneaza rotatia intr-un sens, iar celalalt in sens opus. Activitatea optica a substantei este determinata prin diferenta activitatilor optice ale celor doi atomi de carbon. Aceste combinatii sint intre ele de asemenea enantiomeri. Prin urmare, la o substanta cu doi atomi de carbon asimetrici exista patru izomeri, care formeaza cite doua perechi de enantiomeri. Fiecare pereche de enantiomeri poate forma un racemic; asadar, pe linga cele doua perechi de enantiomeri, mai rezulta si doi racemici. Substantele I si III si substantele II si IV nu sint enantiomeri, ci sint intre ele diastereoizomeri.
La substantele cu un numar mai mare de atomi de carbon asimetrici, numarul stereoizomerilor este si mai mare. S-a constatat ca la o substanta cu n atomi de carbon asimetrici, in molecula pot exista 2n izomeri optici. Numarul racemicilor respectivi este de 2n-1. Astfel, pentru o substanta cu patru atomi de carbon asimetrici, exista 24 16 izomeri si 23 8 racemici.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Documente online pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








