
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Subiectele rezolvate la OLIMPIADA de CHIMIE-etapa judeteana, clasa a VIII-a |
Subiectele rezolvate la OLIMPIADA de CHIMIE-etapa judeteana, clasa a VIII-a
Subiectul I. Pot fi toate raspunsurile adevarate, doua, unul sau nici unul: 30 p
Sulfatul de magneziu, administrat intramuscular sau intravenos, in solutie, are actiune sedativa si anticonvulsiva. Concentratia procentuala a solutiei obtinute prin dizolvarea a 49,2 g MgSO4∙7H2O in 150,8 g de apa este:
a) 15,91% ; b)32,62%; c) 24,6% .
Intr-un aparat de respirat pentru scafandrii care contine superoxid de potasiu, KO2, are loc reactia:
4KO2(s) + 2H2O(g) + 4CO2(g) → 4KHCO3(s) + 3O2(g).
Numarul de molecule de oxigen care se formeaza la expirarea a 0,0484 g CO2 /min sunt:
a) 4,968∙1021 molecule; b) 1,242∙1020 molecule; c) 4,968∙1020 molecule.
In trei baloane diferite I, II, III se afla hidrogen, azot si oxigen. In functie de proprietatile enumerate mai jos, stabileste ce gaz se afla in fiecare balon:
I - nu arde, dar intretine arderea; II - arde, dar nu intretine arderea; III - nu arde, nu intretine arderea.
a) I. hidrogen b) I. azot c) I. oxigen
II. oxigen II. oxigen II. hidrogen
III. azot III. hidrogen III. azot
Intr-un vas care contine 200 g apa se adauga 2,3 g sodiu metalic si apoi 200 g solutie HCI 7,3%. Solutia finala va fi:
a) acida; b) bazica; c) neutra;
Urmatoarea succesiune de culori: roscat → verde → albastru → negru, corespunde urmatoarelor substante :
a) Fe(OH)3, NiCl2, CuSO4.5H2O, CuS;
b) Cu, CuCl2, CuSO4, FeS;
c) Cu, CuCl2, [Cu(NH3)4](OH)2, CuO.
Sunt posibile reactiile dintre :
a) solutie de clorura de aluminiu si solutie de hidroxid de sodiu ;
b) hidroxid de zinc si solutie de hidroxid de sodiu ;
c) solutie de sulfat de cupru si o sarma de argint .
In 60 g solutie de H2SO4 4,9% se dizolva SO3 si concentratia solutiei creste la 12,25%. Cantitatea de SO3 dizolvat este:
a) 4 g; b) 0,05 moli; c) 5,025 g.
Contin 6,022 ∙ 1023 electroni:
a) 1,8 g H2O;
b) 2 g C;
c) 0,0625 moli S.
Un cui de fier de
a) 0,8 g de cupru; b) 0,6 g de cupru; c) 0,075 g de cupru;
18,25 g de acid clorhidric pur reactioneaza cu o solutie ce contine 18,5 g de baza. Baza neutralizata este :
a) Zn(OH)2; b) Mg(OH)2; c) Ca(OH)2.
Item |
a |
b |
c
|
||||
|
|
F |
F |
F |
||||
|
|
F |
F |
A |
||||
|
|
F |
F |
A |
||||
|
|
A |
F |
F |
||||
|
|
A |
F |
A |
||||
|
|
A |
A |
F |
||||
|
|
A |
A |
F |
||||
|
|
A |
A |
A |
||||
|
|
F |
A |
F |
||||
|
|
F |
A |
F |
Subiectul II - 30 p
Un amestec de NaOH si KOH cu masa de 15,2 g, in care cele doua baze se gasesc in raport molar de 1:2, se neutralizeaza cu o solutie de H2SO4 de concentratie 49 %. Se cere:
a) compozitia in procente de masa a amestecului de baze;
b) masa solutiei de H2SO4 necesara neutralizarii totale a bazelor;
c) concentratia procentuala a solutiei rezultate;
d) cantitatea de SO3 ( g, moli ) necesara pentru a obtine solutia de H2SO4;
e) compozitia in procente molare si procente de masa a amestecului de saruri obtinute;
f) concentratia procentuala a solutiei obtinute prin amestecarea a 200 g oleum (20% SO3) cu solutia
initialade H2SO4.
a) ![]()
nNaOH / nKOH=a / 2a
mamestec=a∙40 + 2a∙56
15,2=40a +112a
a = 0,1
0,1moli NaOH 0,1moli∙ 40g/mol=4g NaOH
0,2moli KOH 0,2moli∙56g/mol=11,2g KOH
Total:15,2g baze
![]()
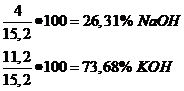
b)
2moli NaOH------98g H2SO4--------142g Na2SO4
0,1moli NaOH------md1 -------------x g Na2SO4
md1=4,9 g H2SO4
2moli KOH ----------98g H2SO4----------174g K2SO4
0,2moli KOH--------md2 ----------y g K2SO4
md2=9,8g H2SO4
Total H2SO4 : 14,7g (md)
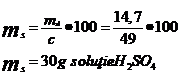
c ) x=7,1g Na2SO4
y=17,4g K2SO4
ms final = mbaze + ms acid sulfuric
ms final =15,2g + 30g
ms final = 45,2g
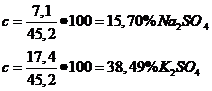
d) ![]()
1mol SO3 ---------98g H2SO4
z moli SO3---------14,7g H2SO4
z=0,15 moli SO3
m=12g SO3
e) Total saruri obtinute: 24,5 g
-procente de masa: -procente de moli:
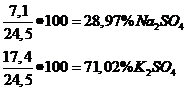
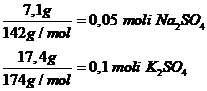
total moli: 0,15
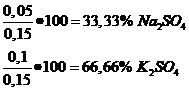
f)
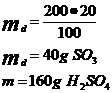
![]()
80g SO3---------98g H2SO4
40g SO3---------wg H2SO4 w=49g H2SO4
Total H2SO4=209 g
![]()
cf=97,26%
SUBIECTUL III -30p
![]() O proba care contine clorat de potasiu impurificat cu
carbonat de calciu, formeaza la calcinare un amestec solid ce
reprezinta 60% din masa probei initiale (toate reactiile sunt
totale). Calculeaza:
O proba care contine clorat de potasiu impurificat cu
carbonat de calciu, formeaza la calcinare un amestec solid ce
reprezinta 60% din masa probei initiale (toate reactiile sunt
totale). Calculeaza:
a) raportul molar al componentilor probei;
b) volumul total
al gazelor degajate(c.n.) la calcinarea a
c) concentratia procentuala a componentilor solutiei obtinute la trecerea amestecului gazos prin 200 g solutie NaOH 6%. (NOTA: se formeaza sare neutra).
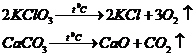
Notez:
a-masa KClO3 x-masa KCl
b-masa CaCO3 y-masa CaO
2∙ 122,5g KClO3 ---------2∙ 74,5g KCl 100g CaCO3--------56g CaO
a g KClO3 -----------x g KCl b g CaCO3--------y g CaO
![]()
![]()
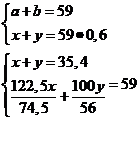 x=29,8g
KCl ; y=5,6g CaO ; a=49g KClO3 ; b=10g CaCO3
x=29,8g
KCl ; y=5,6g CaO ; a=49g KClO3 ; b=10g CaCO3
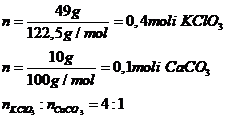
b) 2moli KClO3-----------3∙ 22,4 l O2 1mol CaCO3---------22,4 l CO2
0,4moli KClO3-----------z l O2 0,1moli CaCO3 -------w l CO2
z=13,44 l O2 w=2,24 l CO2
Total gaze: 15,68 l
c)![]() mapa
din NaOH=188g
mapa
din NaOH=188g
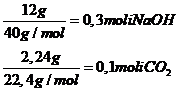 NaOH -este in exces
NaOH -este in exces
CO2+2NaOH→Na2CO3+H2O
1mol CO2 ------------2∙ 40g NaOH -----106g Na2CO3---------18g H2O
0,1moli CO2----- ----- ----o g NaOH--------pg Na2CO3---------rg H2O
o=8g NaOH consumat in reactie
mNaOH exces= 12g-8g =4g p=10,6g Na2CO3 solutie r=1,8g H2O rezultata din reactie
![]()
![]()
msol.finale=10,6g + 4g + 188g + 1.8g
msol.finale=204g
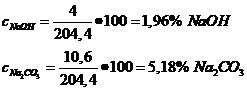
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Lucrari pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








