
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Reactii cu formare de combinatii putin disociate |
Reactii cu formare de combinatii putin disociate
In solutie apoasa, practic toate sarurile dizolvate sunt total disociate. Exista insa si exceptii si anume: sarurile mercurice din categoria halogenurilor si pseudohalogenurilor (deci ale hidracizilor) cu toate ca sunt solubile, nu sunt decat foarte putin disociate. Exceptie face florura mercurica.
Aceste saruri se formeaza din anionii respectivi si o sare oxigenata a mercurului bivalent, fiindca acestea sunt puternic disociate:
![]()
![]()
![]()
Cianura mercurica a fost printre primele substante folosite in tratamentul antisifilitic datorita tocmai disociatiei reduse. Ionul (CN-), cat si ionul Hg2+ sunt toxici pentru om dar si pentru bacterii. Din cauza disociatiei extrem de reduse, actiunea toxica a cianurii mercurice nu este vatamatoare pentru om, este insa suficienta pentru a distruge bacteriile.
Observatie. CN- - doza de 1 mg/kg este mortala fiind otrava rezobtiva. Se acumuleaza in organism. Organismul poate distruge o cantitate de toxic si pentru aceasta organismul nu sufera dar peste aceasta cantitate devine toxic, survenind moartea.
In aer, daca exista peste 0,3 mg/l - moartea survine in cateva minute, in timp ce concentratia de 0,03 mg/l poate fi suportata un timp foarte lung, fara nici un neajuns.
HCN este un toxic celular. El se
combina cu enzimele de oxidare din celule. Acestea contin fier care
formeaza cu CN-
combinatii complexe ce nu mai au activitate catalitica. Deosebit de
sensibile la acest efect sunt celulele creierului mare care comanda
respiratia
Expunerea cronica la mercurul din aer, chiar la concentratii scazute de
g/m3, determina tulburari ale sanatatii. Ionul mercuric este mai toxic decat cel mercuros deoarece este mai solubil in apa. Nivelul admis pentru sarurile anorganice este in general mai mic de 2ppb.
5. Reactii de oxido-reducere sau cu schimb de electroni
Reactiile de oxido-reducere, numite prescurtat reactii redox, sunt extrem de numeroase si, de aceea, pot constitui, pentru chimistul analist, o sursa importanta in ce priveste instituirea de diverse metode de analiza.
Intr-o reactie chimica, o substanta este oxidata atunci cand sarcina pozitiva creste, si redusa cand sarcina pozitiva scade. Adica se poate spune ca oxidarea este o pierdere de electroni iar reducerea poate fi definita ca o primire de electroni. Substanta care primeste e- este oxidanta (ea se reduce), iar cea care cedeaza e- este reducatoare (se oxideaza).
Reactiile care definesc oxidantii si reducatorii se pot scrie:
Ox + ne- D Red
Red - ne- D Ox
Acestea constituie un sistem redox.
De exemplu, fierul metalic este reducator, intrucat este susceptibil sa cedeze electroni oxidandu-se:
Fe - 2e-D Fe2+
Fe - e- D Fe3+
De asemenea, si alte metale pot fi reducatoare.
In realitate, exista urmatoarea reactie generala, ca urmare a asociatiei celor doua sisteme:
ox1 + red2 D red1 + ox2
la echilibru avem:
![]()
In general, reactiile de oxido-reducere sunt reactii reversibile si pentru ele este valabila legea actiunii maselor. Exista insa si reactii ireversibile, ca de exemplu arderile.
In toate echilibrele redox se produc schimburi de electroni. Concentratia in electroni nu poate fi masurata direct dar pot fi pusi in evidenta fizic prin efectele pe care le provoaca. De exemplu, daca intr-o solutie apoasa a unei sari ferice in amestec cu o sare feroasa se introduce un electrod inert de platina (un electrod se numeste inert daca nu este atacat de componentii solutiei), ionii de Fe2+ au tendinta de a trece in Fe3+, cedand un electron electrodului. Invers, ionii Fe3+ au tendinta de a trece in Fe2+, luand un electron de la electrodul inert. Daca prima tendinta este mai mare decat a doua, electrodul se va incarca cu electricitate negativa si invers.
Apare astfel intre electrod si solutie o diferenta de potential. Valoarea acestui potential in volti este data de formula lui Nernst (care a dedus-o pentru prima data in 1889):
![]()
in care E0 - constanta; R - const.gazelor (8,31.107 erg/grad); T - temperatura absoluta; n - numar electroni care intra in reactia de oxido-reducere; F - faraday (96487 coulombi/echiv.gram).
In sistemul prezentat mai sus, ionul feric este oxidantul iar cel feros reducatorul.
In cazul general al unei astfel de solutii, potentialul de oxido-reducere este:
![]()
pentru temperatura de 20sC si trecand la logaritm zecimal, ecuatia devine:
![]()
Cand [oxidant] = [reducator], rezulta:
![]()
deci E = E0.
Acest E0 este potentialul normal sau standard al sistemului redox considerat. Nu are valoare absoluta, ci se determina in raport cu un electrod de referinta. Acesta este electrodul normal de hidrogen: E = EsH = 0.
Electrodul de H2 este tocmai electrodul standard de H2 care are potentialul zero prin definitie.
|
(Celula: placuta de Pt, in solutie cu o concentratie de H+ de 1 mol/l in care se barboteaza H2 pur la 1 at.).
Potentialul unui sistem redox se poate afla astfel prin masurarea diferentei de potential dintre electrodul inert introdus intr-o solutie a unui cuplu oxido-reducator si un electrod de hidrogen. In conditii standard se obtine astfel potentialul standard al sistemului analizat.
Potentialul de oxido-reducere este influentat de:
a) precipitare, care prin modificarea concentratiei unuia dintre componenti poate aduce cu sine variatia potentialului de oxido-reducere a unui sistem;
b) formarea de combinatii complexe determina o modificare a concentratiilor substantelor in sistem si se manifesta astfel printr-o variatie a potentialului de oxido-reducere;
c) pH-ul influenteaza potentialul de oxido-reducere in urmatoarele cazuri:
efectul indirect prin dependenta formarii precipitatelor sau complecsilor de pH;
ionizarea diferitelor substante depinde de pH, acesta influentand disocierea lor, deci va influenta astfel potentialul redox (de exemplu H2S sau a unui acid slab);
unele sisteme au nevoie de H+ pentru a lega atomii de oxigen din formula oxidantului. Deci potentialul este evident functie de concentratia de H+, deci de pH.
Exemple:
![]() D
D ![]()
![]() D
D ![]()
Viteza reactiilor de oxido-reducere este influentata de o serie de factori:
natura reactantilor si diferenta de potentiale respective;
temperatura mediului de reactie (de exemplu, acidul percloric:
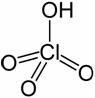
devine oxidant la temperatura sa de fierbere -200sC.
cresterea concentratiei. Astfel, HClO4, H2SO4, HNO3 sunt oxidanti numai in solutii concentrate;
concentratia
ionilor de H+ (de exemplu,
![]() este oxidant numai in
mediu acid, O2 din
molecula trebuie sa gaseasca ioni H+ pentru a forma apa).
este oxidant numai in
mediu acid, O2 din
molecula trebuie sa gaseasca ioni H+ pentru a forma apa).
6. Reactii de dismutatie
Aceste reactii se mai numesc si de disproportionare sau de autooxidare. Aceste reactii sunt tot reactii cu schimb de electroni , dar electronii se schimba intre atomii sau moleculele de acelasi fel sau intre atomi diferiti dar din aceeasi molecula. In aceste reactii, un element se oxideaza iar altul, din aceeasi molecula, se reduce. Schema lor generala este urmatoarea:
2Am+ D A(m+n)+ +A(m-n)+
Cel mai cunoscut exemplu este dizolvarea Cl2:
Cl + H2O ═ HCl + HClO
Alte exemple, des intalnite, sunt date de metalele nobile care pot avea mai multe trepte de valenta. Deseori, treapta inferioara se auto-oxido-reduce la treapta superioara, mai stabila si la metalul elementar:
3Au+ ═ Au3+ +2Au
Hg ═ Hg2+ +Hg
Descompunerea hidrogenului arseniat si a hidrogenului stibiat sunt, de asemenea, reactii de dismutatie, dar aici electronii se schimba intre atomi diferiti dar apartinand aceleiasi molecule:
2H3As = 3H2 + 2As
2H3Sb = 3H2 + 2Sb
7. Reactii catalitice
Legea actiunii maselor defineste pozitia echilibrului unei reactii chimice reversibile, nu spune insa nimic asupra vitezei cu care se stabileste acest echilibru. Reactiile totale au (de obicei) viteze de reactie foarte mari. In cele mai multe cazuri, echilibrul se stabileste aproape instantaneu. La reactiile reversibile insa lucrurile nu se petrec la fel. Astfel, un amestec de H2 si O2 nu este un sistem stabil fiindca la orice temperatura H2 reactioneaza cu O2 rezultand H2O. Viteza de reactie este insa foarte mica si in conditiile obisnuite de presiune si temperatura echilibrul nu s-ar stabili decat dupa miliarde de ani. La fel, reactia dintre alcoolul etilic si acidul acetic, care duce la formarea esterului respectiv ajunge, in conditii normale, la echilibru doar dupa cativa ani:
C H -OH + CH3COOH D CH3COOC2H5 + H2O
Timpul necesar pentru stabilirea echilibrului poate fi insa modificat. Acesta este cazul reactiilor catalitice. Se numesc reactii catalitice reactiile care isi modifica viteza de reactie in prezenta unui catalizator, care nu se consuma in reactie.
Exemple:
H + O2 in prezenta negrului de Pt reactioneaza in cateva secunde trecand in H2O
HCl
C H OH + CH3COOH ═ CH3COOC2H5 + H2O in cateva minute
Catalizatorii actioneaza in conditii optime la anumite temperaturi si valori de pH.
Substantele care singure nu au nici un efect dar in prezenta catalizatorilor maresc activitatea acestora, se numesc promotori.
Substantele care impiedica activitatea catalizatorilor sunt inhibitori sau otravuri.
Cand reactiile au loc intr-o singura faza cu toti componentii, avem cataliza omogena (de exemplu in solutie).
Cataliza heterogena este cea in care catalizatorul se afla in alta stare decat reactantii (exemplu Pt solida - praf si H2, O2 gaze).
Reactiile catalitice sunt foarte sensibile si in prezent se utilizeaza tot mai mult in reactiile analitice cantitative.
8. Reactii induse
Sunt reactiile la care timpul de stabilire a echilibrului este modificat din cauza altei reactii. De exemplu, oxidarea acidului oxalic cu permanganat de potasiu si acid sulfuric:
5(COOH)2 + 2KMnO4 + 3H2SO4 = 10CO2 + 2MnSO4 +K2SO4 + 8H2O
La inceput si la rece, reactia are loc foarte incet, dar daca dupa un timp se mai adauga KMnO4, el se decoloreaza foarte repede. Aceasta se intampla din cauza ca reactia principala este indusa de reactia interna:
Mn + 4Mn2+
 5Mn3+
5Mn3+
ce nu poate avea loc la inceput deoarece in solutie nu exista Mn2+. La randul lui, Mn3+ format oxideaza acidul oxalic, reducandu-se din nou la Mn2+.
Un exemplu curent in chimia analitica de reactii induse sunt precipitarile. Astfel, prezenta ionului Ba2+ dintr-o solutie va conduce si la precipitarea Ca2+ cu H2SO Acestea sunt precipitari induse sau coprecipitari. Cauzele precipitarilor induse pot fi multiple: ocluzii, adsorbtie, solutii solide, cristale mixte etc.
La fel cum exista precipitari induse, exista si solubilizari induse.
De exemplu, hidroxidul de cobalt, Co(OH)3 este insolubil in cianura de potasiu, KCN, in timp ce Ni(OH)3 este solubil. Un amestec al acestor hidroxizi se va dizolva insa usor.
La reactiile induse redox se deosebesc doua faze:
incubatie - in care se realizeaza conditiile de reactie pentru reactia fundamentala;
inductie - cand reactia are loc cu viteza foarte mare.
Uneori exista si o perioada finala, cand combinatiile intermediare formate in perioada principala de inductie se transforma in cele care corespund sfarsitului reactiei.
Multe reactii induse creeaza probleme in analize determinand, de exemplu, precipitari, dizolvari nedorite, dar altele sunt folosite cu succes in scopul recunoasterii unor ioni si sunt foarte sensibile.
CHIMIE ANALITICA CANTITATIVA
Chimia analitica cantitativa are ca scop (principal) determinarea cantitatilor diferitilor constituenti (compusi, elemente, grupuri de elemente) dintr-o substanta.
Clasificarea metodelor folosite in chimia analitica
Intr-o analiza chimica cantitativa, marimea masurata poate sa depinda direct sau mai putin direct de concentratia sau de masa componentului analizat. Metodele chimice de analiza cantitativa folosesc, pentru determinare, reactii care conduc la procese cantitative, adica reactii practic totale. In aceste cazuri, cantitatea de constituent ramasa nereactionata este sub limita detectabila. In functie de raportul dintre metoda si cantitate, metodele se impart in:
1) Metode directe (sau absolute, independente).
Aceste metode se bazeaza pe functii analitice simple, bine cunoscute si in a caror expresie matematica sunt cuprinsi parametri chimici sau fizici specifici usor de masurat.
Aceste metode se numesc si absolute, independente pentru ca raportul marime masurata-masa se cunoaste exact si nu necesita etalonare.
Se mai numesc si metode chimice deoarece rolul principal in aceste determinari il ocupa reactiile chimice.
Metodele chimice se impart in:
a) gravimetrie - cantitatea de constituent se afla din masa produsului de reactie rezultat;
b) titrimetrie - cand cantitatea de constituent se afla cu ajutorul volumului de reactiv consumat.
Atunci cand constituentul cautat se poate pune in libertate sub forma gaz, sau daca din reactia stoichiometrica rezulta un gaz, vom avea - daca masuram volumul gazului eliberat - gazvolumetrie si daca masuram masa, avem gazgravimetrie.
2) Metode indirecte (metode relative, neindependente)
Aceste metode nu masoara direct masa (volumul) componentului ci o marime fizica dependenta de masa si la care (in mod obisnuit) raportul dintre marimea masurata si masa sau concentratia constituentului trebuie determinat cu ajutorul etaloanelor.
Intrucat aceste metode necesita, pe langa balanta si biureta, folosirea unor instrumente de masura sunt denumite si metode instrumentale. Printre acestea putem aminti:
electrochimia;
polarografia;
spectrofotometria (vizibil, UV, IR, RMN);
cromatografia.
Etapele operationale ale unei analize chimice cantitative
Efectuarea unei analize chimice cantitative decurge in cinci etape importante:
I. Fixarea scopului analizei si alegerea metodei;
II. Prelevarea probei, adica selectarea unei probe corespunzatoare din materialul ce se analizeaza;
III. Trecerea constituentului dorit intr-o forma adecvata pentru masurare;
IV. Masurarea;
V. Calcularea si interpretarea rezultatelor masuratorilor.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2026 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








