
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Seria activitatii chimice a metalelor - reactia cu oxigenul |
Seria activitatii chimice a metalelor - reactia cu oxigenul
|
|
Metalele sunt substante monoelementare care au proprietati fizice caracteristice: conductibilitate termica si electrica, au luciu metalic, ductile si maleabile, si solide la temperatura obisnuita (cu exceptia mercurului).
In tabelul periodic al elementelor 80 % sunt metale.
Reactia dintre metale si acizii anorganici
depinde de asezarea, in functie de hidrogen, in seria
activitatii chimice.
Seria activitatii chimice a metalelor
Seria activitatii (reactivitatii) principalelor
metale este redata, in ordine
descrescatoare, in sirul de mai jos.
K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H2 Cu Bi Sb Hg Ag Pt Au
Reactivitatea metalelor creste de la Au la K
Seria de activitate a metalelor. Prin verificari experimentale s-a constatat ca unele metale pot lua locul altor metale din solutiile apoase ale sarurilor lor.
Ex:
![]()
Din cercetarea proprietatilor chimice ale diferitelor metale s-a constatat ca acestea nu manifesta aceeasi activitate chimica; unele sunt foarte active ( K, Na, Ca ), iar altele foarte putin active ( Ag, Pt, Au ). Pe baza comportarii diferite a metalelor , Beketov si Volta au intocmit un tabel in care metalele sunt asezate dupa activitatea lor chimica descrescatoare: K, Na, Ca, Mg, Al, Zn, Fe, Pb, H, Cu, Hg, Ag, Pt, Au.
Aceasta aranjare este cunoscuta sub numele de seria de activitate a metalelor (seria tensiunilor electrochimice).
Activitatea chimica a unui metal este strans legata de structura atomului, si anume de capacitatea pe care o are de a ceda mai usor sau mai greu electronii de valenta (electronii de pe stratul exterior).S-a dovedit experimental ca metalul cedeaza cu atat mai usor electronii de valenta, cu cat este situat mai la stanga hidrogenului in seria tensiunilor electrochimice.
Reactia cu oxigenul. Prin combinarea metalelor cu oxigenul iau nastere oxizii bazici.
Oxidarea metalelor este cu atat mai energica cu cat sunt asezate mai la stanga hidrogenului in seria tensiunilor.
Sodiul,potasiul si calciul se oxideaza la temperatura obisnuita; din aceasta cauza, sodiul si potasiul se pastreaza in vase cu petrol, iar calciul, in glicerina; celelalte metale ( Mg, Al, Zn, Fe, Pb, de exemplu) se oxideaza in aer numai la cald.
Metalele situate in dreapta hidrogenului, in seria de activitate (Cu, Hg), se oxideaza in aer numai la temperatura inalta ,iar ultimele metale din dreapta hidrogenului (Ag, Pt, Au) nu se oxideaza in aer nici la temperatura inalta. Din aceasta cauza de exemplu, argintul (Ag), platina (Pt) si aurul se numesc metale inoxidabile, in timp ce toate celelalte metale sunt obisnuite.
Stabilitatea oxizilor este cu atat mai mare cu cat caldura degajata in reactia respectiva este mai mare.
Comportarea chimica a metalelor depinde de asezarea lor in seria tensiunilor fata de hidrogen. Astfel , metalele asezate inaintea hidrogenului il pot inlocui din compusi, deoarece atomii acestor elemente cedeaza electronii mai usor decat atomii de hidrogen. Cu cat metalul este asezat mai departe de hidrogen, adica mai la inceputul seriei de activitate, cu cat inlocuieste hidrogenul mai energic. De exemplu, potasiul, sodiul si calciul deplaseaza hidrogenul din apa la temperatura obisnuita, magneziul, din apa incalzita la fierbere (100˚), iar fierul descompune apa in stare de vapori la incandescenta.
Metalele situate dupa hidrogen, in seria de activitate, se diferentiaza de cele situate inaintea hidrogenului, in sensul ca nu il inlocuiesc intrucat atomii lor pierd mai greu electronii decat atomii de hidrogen. De exemplu, cuprul, argintul, aurul nu reactioneaza cu apa in nici o conditie. In acelasi fel se comporta metalele si fata de acizi.
Reactia dintre metale si acizi. Metalele asezate in stanga hidrogenului in seria de activitate il pot inlocui pe acesta din acizi, adica reactioneaza cu acizii diluati, punand hidrogenul in libertate.
Ex:
![]()
![]()
Metalele din dreapta hidrogenului sunt atacate numai de acizii oxidanti concentrati (HNO3, H2SO4 ). Acestia oxideaza mai intai metalul, iar oxidul rezultat reactioneaza cu o noua cantitate de acid; in acest caz, in locul hidrogenului, ca produs secundar, se formeaza apa:
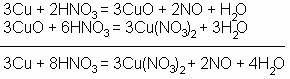
Alte metale, care sunt asezate in seria de activitate mult dupa hidrogen, nu sunt atacate de nici un acid, ci doar de "apa regala" (care este un amestec de 3 parti HCL si o parte HNO3).
Cu halogenii (F, Cl, Br, I), metalele se combina direct cu formare de halogenuri: energia de combinare este foarte mare la metalele alcaline (Li, Na, K, Rb, Cs), chiar cu explozie, in timp ce ultimele metale din serie, dupa hidrogen, platina si aurul nu sunt clorurate decat cu apa regala.
Reactia dintre oxizi si baze (hidroxizi). In mod asemanator se comporta si unele metale fata de hidroxizi. Astfel, aluminiul, staniul, plumbul, zincul reactioneaza cu hidroxizii alcalini, cu formare de saruri si degajare intensa de hidrogen.
Reactia dintre metale si saruri. In aceste reactii se tine seama tot de seria de activitate a metalelor, cunoscand ca fiecare metal inlocuieste metalele care urmeaza dupa el in aceasta serie din sarurile respective.
De exemplu:
![]()
![]()
|
Exemple de metale
Fierul. Fierul este metalul cel mai raspandit de pe Pamant si, in afara de aluminiu, este si metalul cel mai abundent in scoarta terestra. Se gaseste sub forma de combinatii, constituind aproximativ 4,7% din scoarta pamantului, mai ales sub forma de oxizi, sulfuri si carbonati. Se gaseste in cantitati mici in stare nativa ca: fier teluric(pamantesc),care se gaseste in rocile de la suprafata pamantului, fier meteoric sau cosmic, care se gaseste in pietrele meteorice amestecat cu nichel, cobalt, carbon etc.
Cele mai raspandite si importante minerale de fier sunt: magnetitul,Fe3O4 , care este oxidul cel mai bogat in fier, hematitul Fe2O3, limonitul 2Fe2O3 . 3H2O, siderita FeCO3 si pirita cubica FeS2 .Oxizii de fier amestecati cu argila poarta numele de ocru.
De asemenea, fierul se mai gaseste in unele ape feruginoase, sub forma de carbonat acid de fier, Fe (HCO3)2 ; in cantitate mica in regnul animal legat sub forma complexa cu porfirina, alcatuind hemina, materie coloranta a sangelui.
Fierul este un metal alb-cenusiu, lucios, cu densitatea 7,86 g/cm³, care se topeste la 1535˚-1539˚ si are punctul de fierbere la 3000˚. El isi pierde luciul (rugineste rapid) in aer umed sau in apa care contine oxigen dizolvat. El este moale, maleabil si ductil si, de asemenea, prezinta puternice proprietati magnetice (este "feromagnetic").
Fierul prezinta, in functie de temperatura, patru stari alotropice : α, β, γ, δ. Fierul obisnuit (fier α) are un aranjament cubic centrat intern - fiecare atom este in centrul unui cub format din opt atomi inconjuratori. La 912˚C, fierul α sufera o tranzitie la o alta forma alotropica, fierul γ, care aranjamentul cu fete centrate. La 1400˚C apare o alta tranzitie, la fier δ, care are aceeasi structura cubica centrata intern, ca si fierul α.
Fierul are proprietati magnetice atat timp cat actioneaza asupra lui un camp magnetic. Pe aceasta proprietate se bazeaza intrebuintarea fierului la confectionarea electromagnetilor necesari pentru generatoarele de curent bazate pe fenomenul de inductie, motoare electrice, transformatoare electrice etc.
Prin incalzire la incandescenta in aer, fierul da nastere la oxidul fero-feric Fe3O4 :
![]()
De asemenea, la incandescenta reactioneaza cu vapori de apa, trecand in Fe3O4 , cu degajare de hidrogen:
![]()
Fierul se combina usor la cald cu clorul, cu bromul sau cu iodul,formand halogenura ferica respectiva:
![]()
Tot la cald, fierul formeaza cu fosforul, carbonul si siliciul combinatii cu caracter de aliaje, dintre care cea mai importanta este cementita , Fe3C.
Fierul se dizolva usor in acizii diluati ca : clorhidric, sulfuric, azotic, cu formarea sarurilor respective si cu degajare de hidrogen :
![]()
![]()
![]()
Cu acizii oxidanti concentrati (HNO3, H2SO4 ) fierul prezinta fenomenul de pasivitate datorita unui strat protector de oxizi care se formeaza la suprafata sa.
Ruginirea fierului si masuri pentru preintampinarea ei. Fierul este stabil in aer uscat, dar in aer umed sau in apa care contine dioxid de carbon rugineste, adica se acopera cu un oxid hidratat. Stratul de rugina format la suprafata metalului este poros si se desprinde usor, de aceea oxidarea fierului continua in adancime, pana la transformarea integrala a fierului in rugina. Acest fapt antreneaza o mare pierdere de fier, fapt pentru care se cauta sa se protejeze fierul prin diferite metode.
Aluminiul. Aluminiul este al treilea element ca raspandire, dupa oxigen si silicat, dar o mare parte din el nu poate fi extrasa economic. A fost descoperit de F.Wöhler (1827). El formeaza 7,5% din scoarta Pamantului si se gaseste sub forma de compusi. Majoritatea aluminiului este combinata cu elemente de care nu poate fi separat cu usurinta. Argila contine aproximativ 25% aluminiu in greutate, metalul fiind combinat cu siliciu si oxigen in compusi ce se numesc silicati de aluminiu.
Principalul minereu din care se extrage aluminiul este bauxita, care este bogata in alumina hidratata - oxid de aluminiu combinat cu apa. Aluminiul se obtine din bauxita prin electroliza. Procesul are loc la o temperatura de 1000˚C. Metalul care se formeaza in stare topita, este turnat in matrite.
Aluminiul se corodeaza extrem e repede la aer, acoperindu-se cu un strat subtire, dar tare de oxid. Acesta protejeaza metalul argintiu de continuarea coroziunii. De aceea este folosit la multe articole, de la folii pentru gatit pana la tocuri de fereastra si panele de protectie pentru cladiri.
Datorita densitatii sale mici (doar o treime din cea a otelului) aluminiul si alte aliaje din aluminiu sunt folosite pentru fabricarea unor piese usoare pentru aeronave.
Cuprul. In stare naturala cuprul se gaseste in regiunea Lacului Superior din S.U.A, dar si in Rusia, China. Minereurile principale de cupru sunt: calcopirita, calcozina (sulfura cuproasa), cupritul (oxid cupros), azuritul (bicarbonat bazic de cupru) si malachitul, care este un carbonat bazic de cupru de culoare verde.
Metoda folosita pentru extractia cuprului depinde de natura minereului. Daca cuprul se gaseste in stare libera, el poate fi separat prin sfaramarea minereului in bucati mici si amestecarea sa cu apa. Cuprul, fiind relativ greu, se depune pe fund.
Cuprul metalic are culoare rosie, caracteristica, densitatea 8,93 g/cm³, temperatura de topire 1083˚ si cea de fierbere 2310˚. Cuprul are conductibilitate electrica si termica mari, urmand dupa argint, si o rezistenta mecanica mai mare decat alte metale neferoase. Din punct de vedere chimic este un metal putin activ, desi se combina direct cu oxigenul, sulful, halogenii si alte elemente.
Incalzit in aer sau in oxigen la 300˚, cuprul se oxideaza si da oxid cupric CuO, iar la temperatura mai inalta da oxid cupros Cu2O. Se combina cu halogenii chiar la temperatura normala.
In aerul umed si in prezenta dioxidului de carbon, cuprul se acopera cu un strat verde cunoscut sub numele de cocleala si care este foarte toxic. Pentru acest motiv, vasele confectionate din cupru se cositoresc.
Din cauza conductibilitatii termice si electrice bune, a maleabilitatii si a rezistentei mari la rupere, cuprul este mult intrebuintat in industrie, ocupand al doilea loc dupa fier. Din cupru, mai mult sau mai putin pur, se construiesc diferite aparate industriale: cazane, cuve pentru evaporare, cazane pentru distilare etc.
Argintul. Argintul se gaseste in stare nativa, dar cantitatea cea mai mare se extrage din compusii sai. Minereuri mai importante de argint sunt: argentitul, kerargentitul. De asemenea, argintul se mai gaseste ca insotitor in minereurile de plumb. Se obtine din galene argentifere prin mai multe procedee.
Argintul este un metal alb-stralucitor, "argintiu", se topeste la 960,8˚C si fierbe la 1950˚C. Are densitatea 10,5 g/cm³. Dintre toate metalele argintul este cel mai bun conducator de caldura si electricitate. Este foarte maleabil si ductil, urmand dupa aur. Argintul este foarte moale; de aceea nu se intrebuinteaza pur, ci se aliaza cu cuprul.
Argintul este un metal putin activ:aceasta reiese din asezarea lui in seria tensiunii metalelor. El nu se oxideaza in aer nici la cald. Innegrirea obiectelor de argint, care se observa adeseori, se datoreaza actiunii hidrogenului sulfurat din aer, cu care da sulfura de argint.
Aliajele de argint servesc la fabricarea instrumentelor medicale, a bijuteriilor si a monedelor. Cantitati mari de argint se intrebuinteaza la fabricarea oglinzilor, in fotografie, la argintarea diferitelor obiecte, la confectionarea sigurantelor
Reactii exemple:
|
3Cu |
|
8HNO3 |
|
3Cu(NO3)2 |
|
NO↑ |
|
4H2O |
|
cupru |
|
acid azotic |
|
azotat de |
|
monoxid |
|
apa |
|
|
||||||||
|
Cu |
|
2H2SO4 |
|
CuSO4 |
|
SO2↑ |
|
2H2O |
|
cupru |
|
acid |
|
sulfat de |
|
dioxid de sulf |
|
apa |
|
|
|
|
|
|
|
|
|
|
|
Zn |
|
2HCl |
|
ZnCl2 |
|
H2↑ |
|
|
|
zinc |
|
acid |
|
clorura de |
|
hidrogen |
|
|
|
|
||||||||
|
Fe |
|
H2SO4 |
|
FeSO4 |
|
H2↑ |
|
|
|
fier |
|
acid sulfuric diluat |
|
sulfat de fier |
|
hidrogen |
|
|
Din SAC se desprind urmatoarele reguli:
- orice metal din SAC
poate scoate din compusi, metalele care se afla dupa el in serie
Fe + CuSO4 ---> FeSO4
+ Cu
- niciun metal din SAC nu poate scoate din compusi metalele
care se afla in seri in fata lui
Cu + FeSO4- = nu are loc
- orice
metal din SAC , care se afla in fata hidrogenului, poate scoate hidrogenul din
apa si acizi
2Na + 2H2O ---> 2
NaOH + H2
Zn +2 HCl---> ZnCl2
+ H2
- niciun metal din SAC ,care se afla dupa hidrogen , nu poate scoate hidrogenul din apa si acizi
Metalele situate in dreapta hidrogenului, in seria de activitate (Cu, Hg), se oxideaza in aer numai la temperatura inalta ,iar ultimele metale din dreapta hidrogenului (Ag, Pt, Au) nu se oxideaza in aer nici la temperatura inalta. Din aceasta cauza de exemplu, argintul (Ag), platina (Pt) si aurul se numesc metale inoxidabile, in timp ce toate celelalte metale sunt obisnuite.
Comportarea chimica a metalelor depinde de asezarea lor in
seria tensiunilor fata de hidrogen. Astfel , metalele asezate inaintea
hidrogenului il pot inlocui din compusi, deoarece atomii acestor elemente
cedeaza electronii mai usor decat atomii de hidrogen. Cu cat metalul este asezat mai departe de hidrogen, adica mai la inceputul
seriei de activitate, cu cat inlocuieste hidrogenul mai energic. De exemplu,
potasiul, sodiul si calciul deplaseaza hidrogenul din apa la temperatura
obisnuita, magneziul, din apa incalzita la fierbere (100°), iar fierul
descompune apa in stare de vapori la incandescenta.
Metalele situate dupa hidrogen, in seria de
activitate, se diferentiaza de cele situate inaintea hidrogenului, in sensul ca
nu il inlocuiesc intrucat atomii lor pierd mai greu electronii decat atomii de
hidrogen. De exemplu, cuprul, argintul, aurul nu reactioneaza cu apa in nici o conditie. In acelasi fel se
comporta metalele si fata de acizi.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








