
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Scaderea de catre enzime a energiei de activare a reactiilor. |
Scaderea de catre enzime a energiei de activare a reactiilor.
Toate reactiile chimice sunt insotite de variatii ale energiei. In reactiile care au loc in lumea nevie, variatiile de energie se urmaresc in mod curent prin variatia caldurii (entalpiei); dupa cum ele elibereaza sau absorb caldura sunt 'exoterme' respectiv 'endoterme'. Daca reactiile au loc in conditii de temperatura si presiune constanta, parametrul termodinamic urmarit este altul, respectiv variatia energiei libere, notata AG. In cazul reactiilor care au loc in organismele vii superioare, la care cei doi parametri sunt constanti, se urmareste, de asemenea, variatia energiei interne. Daca AG in cursul reactiei este negativa (ceea ce corespunde eliberarii de energie), reactia este 'exergonica'; invers, reactia este 'endergonica'.
In cazul reactiilor exergonice, care constituie obiectul discutiei ce urmeza, energia medie a moleculelor reactantilor este mai mare decat energia medie a produsilor de reactie. Deoarece produsii de reactie sunt mai stabili decat reactantii, s-ar putea crede ca reactiile in care se elibereaza energie sunt si spontane. Totusi, cu foarte rare exceptii, desfasurarea acestor reactii este conditionata de furnizarea unei anumite cantitati de energie; abia dupa ce au fost 'amorsate' ele devin eliberatoare de energie. De exemplu, oxidarea glucozei cu O2 este o reactie in care se elibereaza energie; totusi glucoza rezista contactului permanent cu acest element luni de zile, chiar si ani, daca reactia nu este declansata prin furnizarea unei cantitati de energie.
Energia furnizata reactiei are rolul de a mari numarul de ciocniri intre reactanti, inclusiv a celor eficace; este vorba de ciocniri din care rezulta 'complexe de tranzitie' stari prin intermediul carora au loc transformarile substratelor in produsi de reactie. Aceasta energie este cunoscuta sub numele de 'energie de activare' si este definita ca 'energia necesara pentru ca toate moleculele dintr-un mol de reactant sa atinga starea de tranzitie'. Ea se exprima, evident, in Kj/mol sau Kcal/mol si este specifica fiecarei reactii.
In laborator sau industrie, energia de activare necesara reactiilor este furnizata sub forma de caldura. Imposibilitatea ca reactiile chimice din organismele vii sa fie influentate de caldura este compensata de catre enzime, care, asemanator tuturor catalizatorilor, scad energia de activare. Cu cat un catalizator scade mai mult energia de activare a reactiei pe care o catalizeaza cu atat el este mai eficace adica asigura o viteza mai mare acelei reactii.
Enzimele scad foarte mult energia de activare in raport cu catalizatorii chimici. Reactia -de descompunere a apei oxigenate poate servi ca exemplu in acest sens:
2H2O2 2H2O + O2
In absenta catalizatorilor energia de activare are valoarea de 18Kcal/mol; ea este de 11,7 Kcal/mol in prezenta catalizatorului de platina coloidala si de numai 2 Kcal/mol in prezenta catalazei, enzima cu specificitate absoluta pentru aceasta reactie (Fig. 1.). Asa se explica capacitatea catalitica deosebit de mare a catalazei: o singura molecula din aceasta enzima descompune 5 x 106 molecule de apa oxigenata intr-un minut, in conditii optime. Exista si enzime care asigura viteze de reactie de ordinul 1010 - 1012 in raport cu reactiile corespunzatoare necatalizate.
Scaderea de catre catalizatori a energiei de activare este consecinta cursului diferit pe care acestia il imprima reactiei. Se stie ca orice reactie catalizata decurge si in absenta catalizatorului dar cu viteza foarte mica. In acest caz substratul (S) se transforma direct in produs de reactie (P).
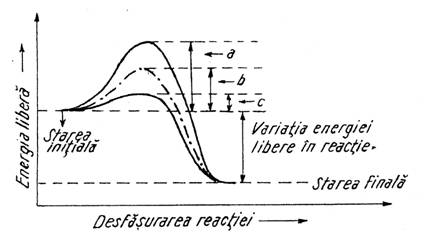
Fig. 1. Energia de activare pentru descompunerea apei oxigenate:
a) fara catalizator; b) in prezenta Pt coloidale; c) in prezenta catalizei.
In cazul reactiilor catalizate, inclusiv prin enzime, transformarea nu este directa ci prin intermediari. De exemplu intre enzima (E) si substrat se formeaza un complex ES din care apoi rezulta P si se reface E:
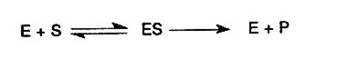
In conformitate cu cele afirmate mai inainte, energia de activare pentru transformarea lui S din ES in P este mult mai mica decat la transformarea directa a lui S in P.
In Fig. 1. este reprezentat si faptul ca intr-o reactie exergonica declansata prin furnizarea energiei de activare, se elibereaza o cantitate de energie care este suma energiei de activare + variatia energiei libere specifice (diferenta intre energia medie a reactantilor si a produsilor).
Desigur ca in organismele vii, alaturi de reactiile exergonice, au loc numeroase reactii endergonice. Ele sunt posibile prin faptul ca exista enzime specializate, care, pe langa scaderea energiei de activare, asigura si transferul energiei libere necesare de la reactii exergonice. Desfasurarea acestor reactii este prezentata in capitolul 'Energetica biochimica'.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Analize pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








