
| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Analiza continutului de micotoxine corelata cu contaminarea micotica |
Analiza continutului de micotoxine corelata cu contaminarea micotica
Obiectivele cercetarii
Analiza continutului de micotoxine corelata cu contaminarea micotica
Identificarea factorilor fizico-chimici care influenteaza biosinteza de micotoxine
2. Studiu documentar
Dintotdeauna consumatorul a fost preocupat ca alimentele puse la dispozitia lui sa fie sigure din punct de vedere igienico-sanitar, sa nu ii provoace imbolnaviri.
Astazi, aceasta cerinta a devenit tot mai insistenta, intrucat consumul de alimente pregatite pe scara industriala a crescut foarte mult si deoarece, tot mai des, consumatorul afla ca alimentele sunt cauza multor imbolnaviri, uneori a unor decese; consumatorul este asadar vizat ca nu in toate cazurile, alimentele consumate sunt de o calitate igienico-sanitara corespunzatoare.
Contaminarea produselor alimentare cu mucegaiuri (fungi), ridica aspecte importante legate de pierderea inocuitatii alimentului. Dupa ce a fost sesizat, acest fapt a stat la baza normarii prezentei mucegaiurilor in alimente, sub forma numarului maxim de mucegaiuri admis la gramul de aliment.
Atentia deosebita acordata mucegaiurilor este datorata caracteristicilor anumitor specii de fungi de a elabora si elibera in aliment metaboliti secundari numiti micotoxine, care au o structura chimica mai mult sau mai putin cunoscuta, dar si capacitatea dovedita de a modifica structuri normal biologice. Micotoxinele, ca metaboliti ai anumitor tipuri de mucegaiuri au astfel efecte nocive atat asupra sanatatii omului, cat si asupra animalului care consuma alimente contaminate cu acestea . Micotoxinele pot fi continute de sporii mucegaiurilor, in intregul fung si pot fi excretati in alimentele care reprezinta un substrat de crestere pentru mucegaiuri.
Contaminarea cu mucegaiuri a alimentelor si prezenta de micotoxine in alimente reprezinta o problema de sanatate publica, in conditiile in care acestea pot afecta si generatiile viitoare (sunt teratogene). Aflatoxinele au fost primele micotoxine descoperite si datorita toxicitatii lor ridicate, au fost foarte rapid studiate. Era inceputul anilor saizeci cand potentialul analitic calitativ si cantitativ era suficient de ridicat pentru a permite studiul aflatoxinelor in alimentatie si ca evaluarea riscurilor sa poate fi realizata.
Materiale si metodica
3.1. Determinarea continutului de micotoxine in cereale
Pentru analiza s-au folosit trei soiuri de grau si trei soiuri de orz recoltate in anul 2007, procurate de la SCDA Braila. Continutul de micotoxine in cereale a fost analizat cu ajutorul cromatografiei in strat subtire, metoda folosita incepand cu anul 1990 pentru analiza micotoxinelor. Pentru cromatografia in strat subtire limita de detectie pentru dozarea aflatoxinelor este de 2 ppb, iar cea pentru tricotecine limita este de 50 ppb. De obicei, acesta metoda este urmata de un test ELISA sau prin cromatografie lichida de inalta performanta (HPLC) in cazul in care furnizeaza un raspuns pozitiv. S-a aratat ca cromatografia in strat subtire poate fi aplicata in egala masura si in cazul analizei tricotecinelor, in particular a deoxinivalenolului (DON) si al zearalenonei. (ZON).
1. Principiul metodei
Extractia micotoxinelor in solventi organici si separarea lor prin cromatografie in strat subtire, identificarea micotoxinelor separate in lumina ultravioleta la lungimile de unda de 254 nm si 366 nm fata de substanta etalon si confirmarea prezentei micotoxinelor identificate in spoturi prin reactii de derivatizare.
a) Aparatura
- camera de vizualizare in ultraviolete cu filtre de 254 nm si 366 nm;
placi pentru cromatografie in strat subtire gata preparate cu strat de silicagel 60G de 0.3 mm grosime
tanc pentru cromatografie sau camera cromatografica in forma de U ( vas paralelipipedic din sticla);
- balanta tehnica, etuva, agitator mecanic, exsicator, omogenizator, baie de apa, rotavapor, micropipeta de 20 μl, microseringa de 5 μl, cilindri gradati de 50 ml, 100 ml, 250 ml, sablon pentru aplicarea spoturilor pe placa, hartie de filtru.
b)Reactivi
- acetona, alcool, apa oxigenata, sulfat de sodiu anhidru, aflatoxinele: B1, B2,G1,G2, ochratoxina A, zearalenona, sistem de solventi e developare : toluen -acetat de etil acid formic in proportie de 6:3:1 (V/V/V).
Modul de lucru
Degresarea, extractia si purificarea probei
Se cantaresc 100 g din proba fin macinata , se introduc intr-un pahar Erlenmeyer de 400 ml, se adauga 200 ml solvent de degresare, se agita 30 minute la agitator magnetic dupa care se decanteaza. Degresarea se mai poate face lasand proba in repaus 2 h agitandu-se manual din cand in cand. Peste proba degresata se adauga 250 ml solvent de extractie si se lasa 6-8 h in cazul in care extractia se face lent, 3 minute cand se foloseste omogenizatorul sau 20-30minute cand se foloseste agitatorul magnetic. Se filtreaza extractul pe hartie de filtru pe care s-a pus in prealabil 10 g sulfat de sodiu anhidru pentru retinerea urmelor de apa. Reziduul astfel obtinut se evapora la sec pe o baie de apa termoreglabila la 60-65˚C sau la rotavaporator.
Aplicarea spoturilor pe placa cromatografica
Pe placa cromatografica pregatita, se marcheaza linia de start la 2 cm de la marginea placii si linia pana la care trebuie sa migreze frontul solventului care se situeaza la 15 cm fata de linia de start.
Developarea
In tancul de developare se introduce amestecul de solventi de developare pana la o inaltime de max. 5 mm. Partea interioara a tancului se captuseste cu hartie de filtru care sa imbiba cu solventii de developare pentru a a sigura o atmosfera saturata cu vaporii developantului si pentru a evita evaporarea acestuia de pe placa in timpul developarii. Dupa executarea acestor operatii tancul se inchide, se lasa 20 . 30 min. Se inchide etans cu capacul si se lasa la developat pana cand frontul solventului a atins linia marcata la 15 cm de linia de start. Se scoate placa, se usuca la temperatura camerei timp de cateva minute.
Identificarea micotoxinelor
Pe placa cromatografica se examineaza la lumina ultravioleta si se incercuiesc, zonele cu fluorescenta asemanatoare cu a etaloanelor si se pulverizeaza cu solutie de derivatizare. Dupa pulverizare, placa cromatografica se introduce in etuva timp de 2..3min., la o temperatura de 60˚C. Se examineaza din nou placa la lumina ultravioleta si daca fluorescenta a suferit modificari similare celor din etaloane se confirma prezenta micotoxinei in proba analizata.
3.2. Identificarea factorilor care influenteaza biosinteza de micotoxine
Alaturi de cresterea fungica, contaminarea cerealelor cu micotoxine este un proces care incepe in camp si continua in timpul recoltarii, uscarii si depozitarii (CAST, 2003). O multitudine de factori afecteaza productia sau prezenta micotoxinelor pe camp si la depozitarea alimentelor de aceea izolarea fungilor micotoxicogenici nu indica neaparat prezenta micotoxinelor (Hussein and Brasel, 2001). Prezenta micotoxinelor si gradul de contaminare cu micotoxine in general, depinde de factorii geografici, de sezon si de conditiile in care cerealele cresc, sunt recoltate si eventual depozitate (EHC, 1979). Pe deasupra, cresterea (cu sau fara simptome vizuale) este un proces anterior productiei micotoxinelor, iar factorii care determina cresterea fungica ( activitatea apei, continutul de umiditate, uscarea rapida, temperatura, timpul, compozitia masei de cereale, deteriorarea mecanica a cerealelor, O2 si CO2 disponibili, numarul de fungi, interactiunea cu alte microorganisme) sunt implicati si in productia de micotoxine. Factorii mentionati anterior sunt schematizati in figura 1.
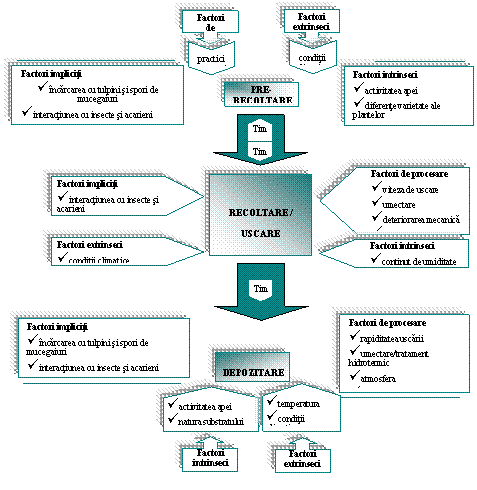
|
Figura 1. Factori care influenteaza pierderile determinate de contaminarea cu fungi filamentosi inregistrate la depozitarea cerealelor (sursa Magan si Aldred, 2007)
3.2.1. Analiza efectului factorilor fizici asupra productiei de micotoxine (aflatoxine)
Dintre factorii fizici care favorizeaza aparitia aflatoxinelor, s-a testat efectul temperaturii si al activitatii apei, pe sisteme model ( medii de cultura cu agar) si cereale.
Pregatire inocul
Pentru experimente, s-a folosit Aspergillus flavus 148 procurat de la USAMV Bucuresti. Mucegaiul a fost inoculat pe must de malt cu agar, termostatat 5 zile la temperatura de 25◦C , iar sporii au fost suspendati in apa distilata sterila cu 0.005% Tween 80. Suspensia a fost centrifugata pentru a indeparta sporii de hife. Folosind ser fiziologic steril, s-a obtinut o suspensie cu 106 spori/mL. Numararea sporilor din suspensie s-a realizat cu ajutorul camerei de numarare Thoma. Suspensia a fost pastrata la temperatura de 4◦C inainte de a fi folosita.
Medii de cultura
mediu pe baza de cereale;
cereale.
Mediu pe baza de cereale s-a obtinut prin fierberea a 30g de cereale macinate cu 1L de apa, timp de 30 minute. Amestecul a fost apoi filtrat si adus la 1L cu apa S-a adaugat 1,5% agar si s-a termostatat la 121◦C timp de 15 minute.
Pentru a determina influenta activitatii apei asupra productiei de aflatoxine in mediu s-a adaugat glicerina, si s-au obtinut valori ale activitatii apei cuprinse intre 0.78-1.
In cazul cerealelor, pentru modificarea valorii activitatii apei s-au realizat izoterme de sorbtie care s-au obtinut prin plasarea cerealelor timp de 21 zile, in medii cu umiditate relativa crescuta (solutii saturate de sare: KI, NaCl, NH4Cl, KNO3, K2SO4, KCl, (NH4)2 SO4 (Labuza si altii, 1975). Pentru fiecare proba in parte s-a determinat umiditatea prin uscare la etuva la 130◦C timp de 90minute, iar activitatea apei a fost determinata cu analizorul de activitate a apei Fast Lab achizitionat prin contractul CEEX 103, etalonat cu solutii saturate de sare.
Inoculare si termostatare
Mediile de cultura cu valori diferite ale activitatii apei au fost inoculate cu o suspensie de Aspergillus flavus (106spori/mL ) si termostate la temperatura de 16, 25◦C. timp de 7, 14, 21,28, 35 zile.
Dupa umectare, boabele au fost sterilizate cu radiatii UV si apoi contaminate cu o suspensie de Aspergillus flavus (106spori/mL ). Dupa contaminare, boabele de cereale au fost plasate cu cutii cu solutii de glicerol si apa cu aceeasi umiditate cu a boabelor si au fost termostatate la temperaturi de 16, 25◦C.
3.2.2. Analiza efectului factorilor chimici asupra productiei de micotoxine (aflatoxine)
Metodele chimice de prevenire a contaminarii cu mucegaiuri si productia de micotoxine constau in folosirea de conservanti cu efect antifungic. Un bun agent antifungic trebuie sa satisfaca o serie de conditii: sa prezinte un spectru antifungic larg; sa fie lipsit de toxicitate pentru om; sa fie eficient la concentratii reduse, sa nu modifice insusirile produsului (gust, miros, culoare, etc.); sa fie ieftin.
Actiunea fungistatica a compusilor chimici este datorata unor legaturi ireversibile cu enzimele microorganismelor, care anuleaza activitatea enzimatica a acestora, actiune prin care este incetinita cresterea microbiana, ceea ce prelungeste intervalul de timp pana se produce alterarea microbiana a produsului.
Screening-ul efectului ant fungic al unor compusi chimici
Pentru a testa proprietatile antifungice ale compusilor chimici (propionat de calciu, uree, acid citric, sulfat de cupru, acid lactic ) au fost facute initial studii preliminare. In placi petri sterile, s-a adaugat cate 1mL suspensie de spori (107 spori/mL) de Aspergillus flavus si mediu de cultura MEA (extract de malt cu agar) cu diferite concentratii de compusi chimici. Placile au fost termostatate la 28◦C, 3 zile. Dupa perioada de termostatare, s-au numarat coloniile si s-a evaluat caracterul antifungic al fiecarui compus chimic. Concentratiile compusilor chimici care au redus cu 20-25% numarul coloniilor au fost folosite in continuare in lucru.
Evaluarea compusilor chimici asupra cerealelor.
Peste 100 grame cereale, cu activitatea a apei de 0.92, pe baza rezultatelor preliminarii obtinute la screening, s-au adaugat concentratii diferite de substante chimice. Probele au fost sterilizate cu radiatii UV, timp de 10 minute.. Dupa sterilizare, probele au fost inoculate cu 1 mL suspensie de spori (107 spori/mL) de Aspergillus flavus si incubate la 28◦C, 14 zile. Dupa 14 zile, din fiecare proba s-au prelevat cate 1g proba reprezentativa pentru a determina numarul de spori, restul de proba a fost folosita pentru analiza aflatoxinelor.
Numararea sporilor si analiza aflatoxinelor
Proba prelevata pentru numararea sporilor a fost introdusa intr-un balon cu 9 mL ser fiziologi steril. Dupa o omogenizare timp de doua minute la 100 rotatii/minut, din fiecare proba s-au facut insamantari pe PCA, si dupa 3 zile de termostatare la 28◦C s-au numarat coloniile si rezultatul a fost exprimat in log ufc/g.
Pentru analiza aflatoxinelor din fiecare proba s-a prelevat un esantion reprezentativ si au fost facute extractii, pentru a pune in evidenta prezenta sau absenta aflatoxinelor.
Rezultate
In urma analizei celor sase probe alese pentru identificarea continutului de micotoxine prin cromatografie in strat subtire, nu a fost obtinut nici un rezultat pozitiv ( nu au existat pe placa cromatografica alte godeuri care sa migreze si sa prezinte fluorescenta in afara godeului corespunzator standardului).
Izotermele de sorbtie obtinute pentru grau si orz la temperaturile de 16 si 25◦C, au forma sigmoidala (fig. 1, fig.2 ).
Relatiile dintre activitatea apei si umiditate prezentate in figurile 1 si 2 au fost folosite pentru obtinerea cerealelor cu valori ale activitatii apei cuprinse intre 0.8 si 1.
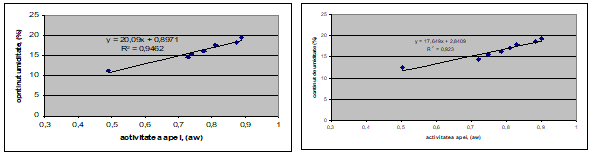
a b
Figura 1. Izoterme de sorbtie , temperatura 16◦ C: a) orz b) grau
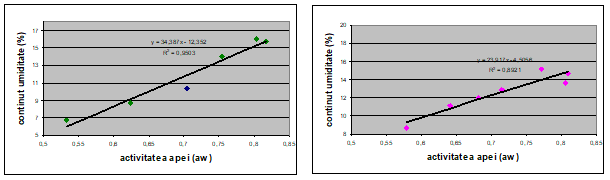
a b
Figura 1. Izoterme de sorbtie , temperatura 25◦ C: a) orz b) grau
Dupa perioada de termostatare, din probe a fost determinat continutul de aflatoxina B1. Intre probele analizate au fost obtinute valori apropiate ale continutului de aflatoxina pentru aceleasi valori ale activitatii apei si temperatura. In probele cu valori ale activitatii apei mai mici de 0.78 s-a observat o rata de crestere foarte scazuta iar nivelul de micotoxine a fost foarte scazut (3.45 μg/g dupa 35 zile de termostatare).
Cantitati foarte mari de aflatoxine au fost detectate in probele cu o valoarea a activitatii apei mai mare de 0.9 (23.5 μg/g dupa 35 zile de termostatare).
Dintre compusii chimici folositi pentru a studia efectul antifungic, propionatul de calciu (0,05- 0.3%), sulfatul de cupru (0,06-2%), uree (0,2-1,5%), acid lactic (0,1-1%), acid citric (0,1-1,5), propionatul de calciu, sulfatul de cupru si ureea au inhibat complet cresterea mucegaiului (tabel 1). Ceilalti compusi au avut un efect fungic moderat. Toti compusii chimici au fost folositi apoi pentru a testa efectul lor asupra productiei de micotoxine (dupa inoculare, cerealele au fost termostatate la 25◦C, timp de 14 zile). Pentru analiza micotoxinelor, s-a folosit cromatografia in strat subtire, urmand ca in cazul probelor pozitive (tabel 1) sa se foloseasca metoda cromatografica HPLC (cromatografie lichida de inalta performanta) pentru a determina continutul de aflatoxine din fiecare proba.
Tabel 1 Efectul unor compusi chimici asupra cresterii lui Aspergillus flavus si productiei de aflatoxine
|
Compus chimic |
Concentratie (%) |
Log ufc*/g |
Procent inhibare |
Aflatoxine (pozitiv /negativ)** |
|
Control |
|
|
|
|
|
Uree (m/m) |
|
± 0,015 ± 0,022 ± 0,012 ± 0,008 |
|
|
|
Acid lactic (v/m) |
|
± 0,029 ± 0,008 |
|
|
|
Acid citric (v/m) |
|
|
|
|
|
Propionat de calciu (m/m) |
|
|
|
|
|
Sulfat de cupru (m/m) |
|
|
|
|
ufc - unitati formatoare de colonii
pozitiv (+) ; negativ (-)
Concluzii
Activitatea apei si temperatura au un rol foarte important in cresterea fungica si productia de aflatoxine. Acest lucru ne sugereaza faptul ca pentru a evita cresterea mucegaiurilor si producerea de micotoxine este necesar sa se realizeze un control adecvat al conditiile de mediu, in special a temperaturii , activitatii apei si interactiunea dintre ele.
Cerealele pot fi un substrat foarte bun pentru cresterea lui Aspergillus flavus si productiei de aflatoxine.
Substantele chimice pot inhiba cresterea mucegaiurilor si productia de micotoxine dar aceasta metoda este din ce in ce mai putin folosita, o atentie deosebita acordandu-se in ultimul timp, metodelor de procesare minima (impulsuri de lumina, dioxid de carbon la presiune inalta, tratament cu plasma, ambalare in atmosfera controlata, etc), pentru a distruge sporii de mucegai cu potential toxicogen.
Bibliografie
1. Baranyi, J., Gibson, A. M., Pitt, J., Eyles, M. J., Roberts, T. A., 1997. Predictive models as means of measuring the relatedness of some Aspergillus species. Food Microbiology 14, 347-351.
2. Brown, R. L., Cotty, P. J., Cleveland, T. E., 1991. Reduction in aflatoxin content of maize by atoxigenic strains of Aspergillus flavus. Journal of Food Protection 54, 623-626.
3. Hell, K., Cardwell, K. F., Poehling, H. -M., 2003. Relationship between management practices fungal infection and aflatoxin for stored maize in Benin. Journal of Phytopathology 151, 690-698.
4. Labuza, T. P., 1975. Interpretation of sorption data in relation to the state of constituent water. In: Water relations in foods. Duckworth, R. (ed.). Academic Press, New York. pp. 155-172.
5. Miller, J. D., 1995. Fungi and mycotoxins in grain: implications for stored product research. Journal of Stored Products Research 31, 1-16.
6. Pardo, E., Lagunas, U., Sanchis, V., Ramos, A. J., Marin, S., 2005b. Influence of water activity and temperature on conidial germination and mycelial growth of ochratoxigenic isolated of Aspergillus ochraceus on grape juice synthetic medium. Predictive models. International Journal of Food Microbiology 106, 25-31.
7. Pardo, E., Malet, M., Marin, S., Sanchis, V., Ramos, A. J., 2006. Effects of water activity and temperature on germination and growth profiles of ochratoxigenic Penicillium verrucosum isolates on barley meal extract agar. International Journal of Food Microbiology 106, 25-31.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2026 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Lucrari pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








