| Afaceri | Agricultura | Comunicare | Constructii | Contabilitate | Contracte |
| Economie | Finante | Management | Marketing | Transporturi |
Instalatii
|
|
Qdidactic » bani & cariera » constructii » instalatii Tehnologii de cultivare intensiva a microalgelor - cultivarea algelor in conditii de laborator si de masa |
Tehnologii de cultivare intensiva a microalgelor - cultivarea algelor in conditii de laborator si de masa
Tehnologii de cultivare intensiva a microalgelor
Cultivarea algelor in conditii de laborator
Dupa cum s-a mentionat, cultivarea algelor in laborator are deja o traditie care depaseste 130 ani. Initial, aceasta preocupare a fost legata in principal de studiile referitoare la fiziologia plantelor in general, la nutritia minerala si fotosinteza in special. Treptat, algologia experimentala s-a dezvoltat puternic, devenind un domeniu important al biologiei vegetale in ansamblul sau.
In prezent, se pot distinge mai multe categorii, respectiv etape de lucru in realizarea culturilor de laborator, dupa cum urmeaza:
Culturi brute;
Culturi monoalgale;
Culturi pure (“axenice”), lipsite de bacterii, ciuperci sau protozoare;
Culturi intensive.
Culturile brute reprezinta prima etapa de cultivare a algelor in laborator; in esenta, ele sunt reprezentate de probe (fragmente) preluate dintr-o biocenoza naturala si transferate in conditii de laborator. Aici, proba respectiva se poate diviza in mai multe parti, la fiecare fiind apoi adaugate anumite substante nutritive sau chiar medii complete, in functie de specificul biocenozei initiale si de scopurile urmarite. Se recomanda ca o portiune din proba initiala sa fie fixata, urmand a oferi informatii referitoare la compozitia initiala a comunitatilor de alge.
Ulterior, aceste culturi brute, care, de regula contin mai multe specii (dar nu toate speciile existente initial in algocenoza respectiva), servesc drept sursa pentru izolarea unor specii de alge, ce urmeaza a deveni “culturi monoalgale”.
Pentru izolarea algelor dintr-o cultura bruta (ori chiar dintr-o proba “vie” colectata direct dintr-un ecosistem natural) se folosesc mai multe metode, dintre care amintim:
Separarea unor celule/colonii din populatii naturale cu ajutorul unor tuburi capilare din sticla, foarte subtiri, care preiau numai o mica parte din comunitatea initiala, uneori chiar numai cateva celule, cenobii sau colonii;
Utilizarea metodei dilutiilor succesive, prin care este redusa foarte mult densitatea numerica a comunitatii initiale de alge, realizandu-se totodata o “dispersare” in spatiu (in mediul nutritiv respectiv) a populatiilor de alge. Se poate ajunge (pe baza cunoasterii densitatii numerice initiale) la situatia prezentei unei singure celule in 1 ml, de exemplu; prin inocularea mai multor vase de cultura continand medii sterile se poate ajunge, dupa un numar de repetitii, la obtinerea unor culturi monoalgale (“pure algologic”);
Utilizarea unor medii nutritive selective, adaptate cerintelor unui anumit grup de alge (exista medii speciale pentru diatomee, pentru cianoficee, pentru euglenoficee etc);
Folosirea unor dispozitive micromanipulatoare, care permit prelevarea, sub microscop, a unor celule/colonii precise (fie din probe luate din natura, fie din culturi brute, pe medii lichide sau pe medii cu agar) si trecerea lor in conditii de cultura;
Centrifugare fractionata (care permite - in oarecare masura - eliminarea bacteriilor);
Tehnica inocularii in agar adanc si separarea speciilor pe baza miscarilor foto- si geotactice etc.
Culturile monoalgale
Culturile care contin o singura specie de alge reprezinta cea de a doua etapa in dezvoltarea culturilor de laborator. Ele constituie rezultatul separarii dintr-o “policultura”, pe baza uneia sau mai multora dintre tehnicile de izolare enumerate mai sus, a unei singure specii de alge.
Trebuie sa precizam ca, pentru multe directii de investigare, utilizarea culturilor monoalgale nu poate asigura nivelul de precizie si rigurozitate stiintifica necesar. Astfel, in majoritatea proceselor care pot constitui obiectul studiului experimental (fotosinteza, nutritia minerala, eliberarea unor substante ectocrine, rata de inmultire, productivitatea culturii etc), prezenta in mediul de cultura a unor organisme straine, precum bacteriile, micromicetele sau chiar unele protozoare poate determina interferente majore si, in final, alterarea semnificativa a datelor obtinute.
Pe de alta parte, prin consumul complementar de nutrienti, prin elaborarea propriilor ectocrine sau a altor exometaboliti, organismele asociate algelor pot determina modificarea conditiilor de nutritie si de viata ale algei respective si, in final, scurtarea duratei de existenta/folosire a culturii.
In general, se poate considera ca, in conditiile cultivarii la scara mare a algelor, sub cerul liber, in scopul obtinerii de biomasa, culturile de alge pot fi monospecifice, dar nu sunt, de regula, axenice.
Culturile axenice (pure nu numai algologic, ci si bacteriologic).
Aceste culturi de laborator cuprind numai o singura specie de alge, si nu contin bacterii, ciuperci sau protozoare. Ele sunt singurele care pot oferi informatii stiintifice de valoare maxima in cadrul unor cercetari aprofundate de fitofiziologie, biochimie vegetala sau de biotehnologie.
Pentru obtinerea unor culturi axenice se folosesc, in prima instanta, metodele de izolare deja prezentate mai sus. Pentru purificarea culturilor monoalgale, in primul rand prin indepartarea bacteriilor, se folosesc unele metode specifice, precum:
“spalarea” culturilor monoalgale cu solutii diluate sterile;
tratarea cu ultrasunete sau cu raze ultraviolete;
spalarea algelor cu solutii dezinfectante, la anumite dilutii (fenol, hipoclorit, benzalconium clorid, anumiti detergenti);
tratarea algelor din culturile monoalgale cu antibiotice, bacteriostatice sau micostatice.
Volumul de munca foarte mare pe care il implica trierea si intretinerea culturilor pure poate fi redus, conservandu-le in stare vie, timp indelungat, prin liofilizare, la intuneric, sau la temperaturi joase, in luminostate speciale. Dupa diferiti autori, aceste metode de pastrare a algelor determina slabe influente genetice (sau chiar nici una) asupra materialului biologic.
Culturile intensive
Cresterea intensiva a algelor in conditii de laborator vizeaza in principal cercetari ce necesita obtinerea, relativ rapid, a unor cantitati destul de mari de biomasa, fie elaborarea unor procedee biotehnologice aplicabile in acvacultura la scara mare.
Instalatii de cultivare
Pentru culturile brute sau cele monoalgale, cel mai adesea se utilizeaza asa numitul sistem de “cultura statica”. Practic, vasele de cultura (care pot fi eprubete, baloane Erlenmeyer de diferite capacitati, etc), cu mediile nutritive respective, sunt lasate in repaus relativ in apropierea unei surse convenabile de lumina, procedandu-se uneori la agitarea periodica, manuala, a culturii. In timp, se preleveaza probe pentru examinarea la microscop a algelor, pentru determinarea continutului de clorofila etc.
Tot sistemul de culturi “statice” se utilizeaza si in cazul colectiilor permanente de culturi de alge.
Pentru culturile intensive se utilizeaza aparate speciale, numite uneori “reactoare”, adesea extrem de complicate.
In aceste echipamente se asigura si se regleaza unii parametri importanti ai mediului de crestere, precum:
temperatura
intensitatea luminii si regimul de iluminare;
agitarea/barbotarea suspensiei de alge (cu dispozitive mecanice, sau prin introducerea sub presiune a aerului, eventual imbogatit cu dioxid de carbon);
turbiditatea generala a suspensiei de alge in mediul lichid;
pH-ul mediului;
compozitia chimica a mediului de crestere etc.
Anumite sisteme de crestere intensiva permit recoltarea partiala a biomasei algale produse, atunci cand turbiditatea prea mare a suspensiei determina reducerea productiei de biomasa.
In prezent, odata cu dezvoltarea semnificativa a sistemelor de automatizare bazate pe tehnicile informatice si pe aparitia unor sensori fizici sau chimice de mare sensibilitate, cultivarea intensiva a algelor in laboratoarele avansate a cunoscut un progres remarcabil.
Dintre dispozitivele utilizate curent pentru culturi intensive de laborator amintim numai cateva, nu fara a preciza ca varietatea lor este cu totul remarcabila, ca rezultat al conceptiei de elaborare, a scopurilor pentru care au fost concepute si, nu in ultimul rand, datorita mijloacelor materiale ce au stat la indemana cercetatorilor.
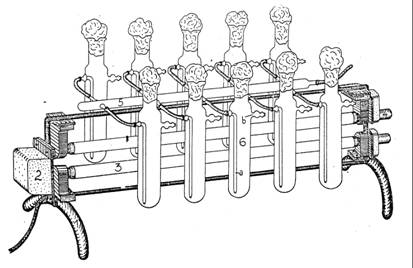
Tuburile verticale, confectionate din sticla sau din diferite materiale plastice (plexiglas etc), au dimensiuni si volume foarte variate. Ele sunt amplasate de regula in apropiere si paralel cu tuburi fluorescente care asigura energia luminoasa necesara fotosintezei. In unele variante constructive, se folosesc tuburi cu diametru mai mare, in interiorul carora este amplasat tubul fluorescent, suspensia algala gasindu-se intre suprafata interioara a tubului cu diametrul mare si suprafata exterioara a tubului fluorescent.
In aceste dispozitive de cultivare se asigura barbotarea cu aer a suspensiei, cat si posibilitatea recoltarii unor probe de suspensie algala, sau adaugarea unor cantitati de solutie nutritiva proaspata.
Instalatie cu tuburi verticale de sticla
dupa Nagy-Tóth, 1972)
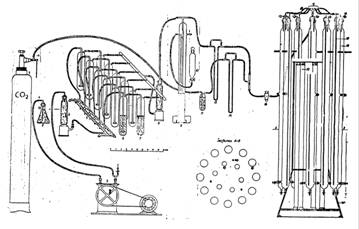
Vasele tip “spalator de gaz”, cu diferite capacitati (250 sau 500 ml, etc) se preteaza, de asemenea, pentru realizarea unor instalatii de cultivare intensiva a algelor in laborator. Prin amplasarea lor, in suporturi speciale din plexiglas, in apropierea unor lampi fluorescente, se poate asigura o intensitate maxima a fluxului luminos de ordinul a 4500 luxi. Unul dintre avantajele acestei instalatii este acela ca se pot – de exemplu - testa, simultan, mai multe variante de cultivare (deosebite, de pilda, prin compozitia mediului nutritiv), sau mai multe specii/linii ale aceleiasi specii de alge, etc. O varianta la acest sistem o reprezinta utilizarea unor vase de cultura tip Roux, asezate in pozitie orizontala si formand “baterii” de diferite marimi. Iluminarea poate fi efectuata din doua parti – de sus si de dedesubt, ceea ce asigura culturii un randament de crestere superior.
Instalatie de cultura cu vase tip spalatoare de gaz
Vasele paralelipipedice (cuve) din plexiglas pot fi utilizate cu succes in cercetari vizand determinarea rolului grosimii stratului de suspensie (alge + mediu nutritiv) in raport cu lumina incidenta. Vasele sunt prevazute cu racorduri pentru barbotare si pentru conectarea in serii. Ele sunt luminate din doua parti (cel mai eficient mod de iluminare); in functie de numarul si puterea tuburilor fluorescente din instalatie, se poate obtine un nivel de iluminare de 2 x 14000, sau altul.
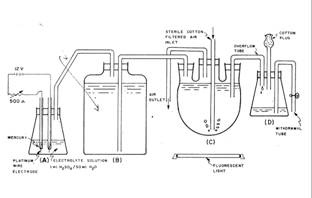
Pentru a ilustra marea varietate a tipurilor de instalatii de crestere in laborator a microalgelor, prezentam mai jos un chemostat relativ simplu construit de Carpenter (1968); dupa aprecierea autorului, echipamentul conceput prezinta avantajul evitarii unor pompe electromecanice scumpe; totodata, intregul aparat poate fi usor sterilizat ca un intreg, daca se indeparteaza, pe timpul autoclavarii, dopurile din cauciuc.
|
|
Schema chemostatului tip Carpenter
Instalatia dispune de o pompa electrolitica (A), care genereaza un amestec gazos sub presiune, ce inlocuieste volumul mediului nutritiv din rezervorul special (B) cu capacitatea de max. 4 litri solutie. Din acesta, mediul trece in vasul propriu zis de cultura (C), cu capacitatea de 2 litri, prevazut cu 3 deschideri la partea superioara. Prin deschiderea centrala patrunde tubul de barbotare si cel de evacuare a amestecului gazos. Luminarea culturii se face de jos in sus. Un al patrulea vas (D) asigura prevenirea contaminarii “retrograde” a culturii Pe traseul circuitului de barbotare se afla un filtru de vata sterila.
O problema speciala a cultivarii algelor in laborator se refera la intensitatea fluxului luminos la nivelul suprafetei culturii.
Numeroase cercetari indica nivele optime cuprinse intre 4000 – 10000 luxi.
In ceea ce priveste raportul dintre perioada de intuneric si cea de lumina pe parcursul a 24 ore, nu exista “reguli” speciale, unitare, sau unanim acceptate.
Numerosi autori au folosit raportul de 12 ore lumina : 12 ore intuneric; altii recomanda 8 ore lumina : 16 ore intuneric, sau 10 ore lumina : 14 ore intuneric.
In ceea ce priveste temperatura mediului de crestere, aceasta poate varia in functie de cerintele ecologice ale algelor cu care se lucreaza. Daca in mod obisnuit - in cazul culturilor de alge verzi (Chlorella. Ankistrodesmus, Scenedesmus, Coelastrum, Monoraphidium), se lucreaza la temperatura camerei, sau, atunci cand se dispune de sisteme de termostatare, la 20 – 250C, de regula.
In cazul cultivarii unor alge termofile (diferite specii de alge albastre, printre care si Spirulina platensis, sau alte alge cu cerinte ridicate fata de temperatura), este indispensabila utilizarea unor dispozitive de termostatare, cu ajutorul carora sa se realizeze un nivel termic constant de ordinul a 28 – 300C.
Pentru omogenizarea suspensiilor, si, dupa caz, pentru asigurarea necesarului de dioxid de carbon, se folosesc dispozitive de barbotare cu aer imbogatit cu CO2.
In general, adausul de dioxid de carbon in aer este de ordinul a 3 – 5 %.
Debitul de amestec gazos pentru barbotare este, in cazul tuburilor verticale, de ordinul a 10 – 15 ml/minut/100 ml suspensie, iar in cazul vaselor paralelipipedice, descrise mai sus, debitul necesar este de ordinul a 65 – 70 ml/min/100 ml suspensie. Debitul de gaz este mai mic in primul caz, deoarece bulele parcurg un traseu mai lung (de peste 1 metru) in instalatiile bazate pe tuburi, ceea ce faciliteaza dizolvarea dioxidului de carbon in mediul apos respectiv.
Mentionam ca sistemul de barbotare se compune, in principiu, dintr-un compresor electric, o butelie cu dioxid de carbon sub presiune, regulatorul de presiune pt. CO2, sistem de purificare si sterilizare a aerului, sistem de distributie a amestecului gazos in recipientele de cultivare a algelor.
Pentru purificarea si sterilizarea aerului se folosesc, succesiv, vase cu solutie de KMnO4 5 % sau cu H2SO4 concentrat apoi cu apa sterilizata; in circuitul amestecului gazos sunt intercalate si filtre de vata asezate inaintea, intre si dupa spalatoarele continand KMnO4 sau H2SO4 (Nagy-Tóth, 1972).
Dintre “detaliile tehnice” importante pentru reusita culturilor intensive de laborator, mai amintim doua:
utilizarea unei piese speciale din sticla, cu trei cai, introdusa in circuitul gazos la punctul de unificare a curentului de aer furnizat de compresorul electric cu curentul de CO2 provenit din butelia de presiune; prin modul de constructie al acestei piese se asigura producerea unui vartej gazos, respectiv un amestec uniform al aerului cu dioxidul de carbon;
orificiile prin care patrunde amestecul gazos in suspensia algala trebuie sa fie foarte mici, pentru ca gazul sa se disperseze sub forma unor bule extrem de mici, uniforme. In acest fel, pe de o parte se obtine un efect superior de omogenizare a suspensiei si de transfer in solutie a dioxidului de carbon necesar, iar pe de alta parte turbulenta mediului nutritiv se mentine la nivel moderat, ceea ce nu deranjeaza desfasurarea oarecum normala a proceselor fiziologice ale algelor de tip planctonic, adaptate la viata in stare de plutire intr-un mediu relativ linistit. Cele mai bune sisteme de distributie a amestecului gazos in mediile nutritive pentru microalge folosesc “orificii” formate din filtre ceramice.
Pentru cultivarea la scara mare a algelor se folosesc instalatii foarte variate ca si conceptie, ca dimensiuni si ca forma.
Au fost imaginate instalatii foarte simple, constand in canale de mica adancime practicate in sol, captusite cu folie din polietilena, dar au fost construite si instalatii industriale speciale, de mari dimensiuni, alcatuite din bazine betonate, circulare sau de alta forma, prevazute cu sisteme de agitare a suspensiei algale, cu sisteme de aerare, de recoltare sau chiar cu dispozitive de reglare a unor parametri de crestere (inclusiv automatizate). Este evident ca realizarea unor instalatii foarte sofisticate, dotate cu tehnica de varf, implica mari cheltuieli de investitii, care vor majora, in final, pretul de cost al produsului.
Dintre instalatiile de tip industrial, relativ simple, si foarte eficace in ceea ce priveste productivitatea culturilor algale, mentionam pe cea realizata la Institutul Francez al Petrolului, pentru cultivarea in masa a Spirulinei, instalatie care a fost apoi preluata de multi din cei care se ocupa de cresterea acestei alge in scop de productie. In esenta, instalatia la care ne referim consta dintr-un bazin rectangular din beton, de forma alungita. El este prevazut, in plan longitudinal, cu un perete despartitor median, si cu doua adancituri la capete. In aceste adancituri sunt amplasate doua tevi prin care aerul (de regula imbogatit cu dioxid de carbon) este introdus sub presiune in mediul nutritiv; masa de bule de gaz care se ridica permanent spre suprafata mediului nutritiv determina nu numai imbogatirea acestuia cu dioxidul de carbon necesar pentru stimularea cresterii algelor, ci genereaza si un curent continuu a suspensiei algale de-a lungul celor doua jumatati de bazin.
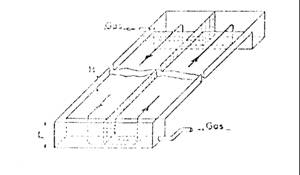
Schema bazinului tip “air-lift”
Plecand de la acest tip de bazin, care, de altfel, a dat rezultate foarte bune in productia industriala a biomasei algale, alti specialisti au optat pentru modificarea principiului de asigurare a circuitului de suspensie algala, prin inlocuirea sistemului de antrenare a mediului nutritiv de catre curentul de bule de gaz, cu un dispozitiv mecanic, simplu, constand in doua (sau mai multe) “zbaturi” miscate de motoare electrice. Un autor, proiectand astfel de sisteme de cultura pentru tarile sarace, respectiv pentru instalarea lor in zone defavorizate, lipsite de curent electric, a imaginat un sistem mecanic de antrenare a “zbaturilor” pus in miscare de o greutate mare, ridicata periodic (printr-un scripete actionat manual) pe un suport foarte inalt; prin coborarea lenta a greutatii (franata printr-un mecanism special) se asigura functionarea zbaturilor pe durata unei zile.
In imaginile de mai jos sunt prezentate sisteme de productie industriala, la scara mare, a biomasei de Spirulina.

Se remarca in aceasta fotografie acoperirea bazinelor cu o
structura transparenta, astfel ca suspensia de alge primeste integral lumina
zilei; in bazine, suspensia densa de alge este
continuu agitata de un sistem cu zbaturi, ce se poate observa in ultimul plan
al imaginii. Fotografia reprezinta o instalatie care
functioneaza in
O alta instalatie, de
capacitate productiva mult mai mare, cu bazine circulare, construita tot in

Instalatii de cultivare industriala a microalgelor (din Hills, 1981)
Medii nutritive
De-a lungul timpului, pe baza a numeroase cercetari experimentale si a investigarii cerintelor ecofiziologice ale diferitelor specii de alge, au fost elaborate diverse retete ale unor medii nutritive menite sa raspunda in mod adecvat cerintelor nutritionale generale ori celor specifice, proprii anumitor grupuri de alge.
Dintre mediile nutritive cu spectru larg de aplicabilitate, mentionam cateva.
Mediul Benecke
|
Ingredient |
Cantitatea (g)
|
||||
|
Ca(NO3)2. 4 H2O |
|
||||
|
K2HPO4 |
|
||||
|
MgSO4.7 H2O |
|
||||
|
FeSO4 |
|
||||
|
EDTA-Na2 |
|
||||
|
Solutie microelemente A4 |
1 ml |
||||
|
Solutie microelemente B7 |
1 ml |
||||
|
Apa |
1000 ml |
Mediul Knop
|
Ingredient |
Cantitate (g) |
|
Ca(NO3)2. 4 H2O |
|
|
MgSO4. 7 H2O |
|
|
KH2PO4 |
|
|
KCl |
|
|
Fe2Cl6 |
1 picatura sol.1% |
|
Apa |
1000 ml |
Mediul Knop-Pringsheim
|
Ingredient |
Cantitate (g) |
|
KNO3 |
|
|
Ca(NO3)2. 4 H2O |
|
|
K2HPO4 |
|
|
MgSO4. H2O |
|
|
FeCl3.6 H2O |
|
|
EDTA-Na2 |
|
|
Apa dedurizata |
1000 ml |
Mediul Tamyia
|
Ingredient |
Cantitate |
|
KNO3 |
|
|
MgSO4. 7 H2O |
|
|
KH2PO4 |
|
|
FeSO4 . 7 H2O |
|
|
EDTA-Na2 |
|
|
Solutie microelemente |
1 ml |
|
Apa |
1000 ml |
Solutia de microelemente are urmatoarea compozitie:
|
Ingredient |
Cantitate (g/l) |
|
HBO3 |
|
|
MnCl2. 4 H2O |
|
|
ZnSO4. 7H2O |
|
|
MoO3 |
mg/10 l |
|
NH4NO3 |
mg/10 l |
Mediul Hindak
|
Ingredient |
Cantitate (g/l) |
|
(NH4)CO3 |
|
|
(NH4)SO4 |
|
|
MgSO4. 7 H2O |
|
|
KH2PO4 |
|
|
H3BO3 |
|
|
FeSO4. 7 H2O |
|
|
CaCl2. 2 H2O |
|
|
ZnSO4. 7 H2O |
|
|
MnSO4. 7 H2O |
|
|
Na2MoO4. 2 H2O |
|
|
CuSO4. 5 H2O |
|
|
CoCl2. 6 H2O |
|
|
EDTA-Na2 |
|
|
Apa |
1 litru |
Mediul Czurda
|
Ingredient |
Cantitate (g) |
|
KNO3 |
O,2 |
|
Ca(NO3). 4 H2O |
|
|
K2HPO4 |
|
|
MgSO4. 7 H2O |
|
|
FeCl3 |
Urme |
|
Extract de sol |
10 ml |
|
Extract de Sphagnum (turba) |
5 ml |
|
Apa bidistilata |
1000 ml |
Mediul Chu
|
Ingredient |
Cantitate (g) |
|
Ca(NO3)2. 4 H2O |
|
|
K2HPO4 |
|
|
MgSO4. 7 H2O |
|
|
Na2CO3 |
|
|
Na2SiO3. 9 H2O |
|
|
FeCl3. 6 H2O |
|
|
Solutie de microelemente |
1 ml |
|
Apa |
1000 ml |
Solutia de microelemente are urmatoarea compozitie:
|
Ingredient |
Cantitate (g) |
|
ZnSO4. 7 H2O |
|
|
MnSO4. 4 H2O |
|
|
AlCl3 |
|
|
H3BO3 |
|
|
LiCl |
|
|
CoCl2. 6 H2O |
|
|
Apa distilata |
1000 ml |
Au fost elaborate si alte medii nutritive, mult mai specializate, adaptate in mod special necesitatilor nutritive ale unor anume grupe de alge. Dintre numeroasele retete publicate de specialisti, prezentam numai cateva.
Mediu L 541/a - pentru Dunaliella
|
Ingredient |
Cantitate (g) |
|
NaCl |
|
|
MgSO4. 7 H2O |
|
|
KNO3 |
|
|
K2HPO4 |
|
|
FeCl3. 6 H2O |
|
|
Extract de sol |
50 ml |
|
Apa distilata |
1000 ml |
Mediul Schönborn - pentru Euglena
|
Ingredient |
Cantitate (g) |
|
NH4NO3 |
|
|
MgSO4. 7 H2O |
|
|
KH2PO4 |
|
|
CaCl2. 2 H2O |
|
|
MnCl2. 4 H2O |
|
|
FeCl3. 6 H2O |
|
|
Apa |
1000 ml |
Mediul Würtz – pentru Pandorina morum
|
Ingrediente |
Cantitate (g) |
|
NH4NO3 |
|
|
HK2PO4 |
|
|
MgSO4. 7 H2O |
|
|
Citrat de fier |
|
|
CaCl2 |
*** |
|
Apa distilata |
1000 ml |
Ingredientele notate cu (***) se adauga in solutie dupa sterilizarea acesteia.
Mediul Higashiyama - pentru Chlorella
|
Ingrediente |
Cantitate (g) |
|
KNO3 |
|
|
KH2PO4 |
|
|
MgSO4. 7 H2O |
|
|
FeSO4. 7 H2O |
|
|
Citrat de potasiu |
|
|
Solutie microelemente Arnon A5 |
1 ml |
|
Apa bidistilata |
1000 ml |
Mediul Zarrouk - pentru Spirulina platensis
|
Ingrediente |
Cantitate (g) |
|
NaHCO3 |
|
|
K2HPO4 |
|
|
NaNO3 |
|
|
K2SO4 |
|
|
NaCl |
|
|
MgSO4. 7 H2O |
|
|
CaCl2. 2 H2O |
|
|
Solutie microelemente |
1 ml |
|
Solutie chelatizata de Fe |
1 ml |
|
Apa |
1000 ml |
Solutia de microelemente are urmatoarea compozitie:
|
Ingrediente |
Cantitate (g) |
|
H3BO3 |
|
|
MnSO4. 4 H2O |
|
|
ZnSO4. 7 H2O |
|
|
MoO3 (85 %) |
|
|
CuSO4. 5 H2O |
|
|
Co(NO3)2 . 6 H2O |
|
|
Apa distilata |
1000 ml |
Solutia chelatizata de Fe se prepara (dupa Schlösser, 1982), astfel: se dizolva 0 g FeSO4. 7 H2O si 0 g Na2EDTA in 80 ml apa distilata, fierbandu-se putin timp. Dupa racire la temperatura camerei solutia se aduce la 100 ml. Daca apare un precipitat, se va agita bine inainte de folosire.
Mediul B pentru Diatomee (Schlösser)
|
Ingrediente |
Cantitate (g) |
|
Ca(NO3)2. 4 H2O |
|
|
K2HPO4 |
|
|
MgSO4. 7 H2O |
|
|
Na2CO3 |
|
|
Na2SiO3. 5 H2O |
|
|
Citrat feric |
|
|
Acid citric |
|
|
Cianocobalamina |
|
|
Extract de sol |
30 ml |
|
Solutie de microelemente |
1 ml |
|
Apa |
1000 ml |
Solutia de microelemente este cea prezentata anterior (la reteta de mediu pentru Spirulina).
Desigur ca aceste retete de medii nutritive nu trebuie privite ca elemente ale unor proceduri standardizate, imuabile. Plecand de la analiza principalelor raporturi ionice care le caracterizeaza compozitia chimica a mediilor prezentate, dar si de la propriile observatii referitoare la cerintele nutritionale ale diferitelor populatii de alge, de la datele privind analiza compozitiei chimice a biomasei algelor, cat si de la observatiile altor autori, se pot experimenta variante originale de medii nutritive pentru diferitele tipuri/grupe/specii de alge.
In cele de mai sus au fost prezentate retete ale unor medii nutritive concepute si utilizate in practica cercetarilor de laborator.
In cadrul tehnologiilor de cultivare intensiva, la scara mare, a unor alge - in scopul obtinerii unei productii de biomasa, alegerea unor medii nutritive trebuie sa tina seama nu numai de cerintele ecofiziologice ale obiectului acvaculturii, de specificul culturilor (monocultura, policultura), de viteza de epuizare a capacitatii trofice a solutiilor nutritive in functie de conditiile de crestere, dar si de criterii de eficienta economica, care implica alternativa utilizarii unor nutrienti mai ieftini, provenind din produse de uz industrial, agricol sau de alta natura (de exemplu, utilizarea unor ape minerale naturale).
In experiente efectuate la scara mare in India, spre exemplu (Venkataraman, 1980), s-a incercat utilizarea unor medii nutritive bazate pe ingrasaminte agricole la care s-au adaugat dejectii animaliere in anumite proportii, sau reziduri de la instalatiile de producere a biogazului (“metantancuri”), etc. Ca sursa de carbon a fost utilizat fie bicarbonatul, fie un sistem de barbotare a suspensiei algale cu aer imbogatit cu dioxid de carbon.
In cadrul programului de cercetare derulat timp de cativa ani la Statiunea de Cercetari “Stejarul” din Pangarati (judetul Neamt), au fost experimentate mai multe variante de medii nutritive utilizabile in cultura pe scara mare a Spirulinei (dar si a altor alge, precum specii din genul Scenedesmus), in scopul reducerii semnificative a pretului de cost al biomasei obtinute.
Principalele directii (cai) abordate in acest scop au fost:
inlocuirea unor reactivi chimici de laborator, cu grad avansat de puritate si foarte scumpi, cu unele substante de uz alimentar; in acest sens, mentionam utilizarea bicarbonatului de sodiu alimentar in locul substantei “chimic pure”;
inlocuirea unor reactivi de laborator cu substante de uz tehnic: astfel, ca sursa de fier in mediul nutritiv a fost utilizat sulfatul feros de uz industrial (folosit de ex. in industria pielariei); ca sursa alternativa de fosfor a fost experimentat fosfatul trisodic tehnic, produs intrebuintat curent pentru prevenirea depunerilor calcaroase in instalatiile termice cu apa incalzita;
utilizarea unor ingrasaminte chimice agricole, precum ureea, sau azotatul de amoniu, ca surse de azot ;
introducerea in compozitia mediilor nutritive pentru alge a unor ape minerale care pot asigura necesarul fata de anumiti nutrienti necesari algelor; astfel, pentru acoperirea necesitatilor in raport cu ionul potasiu, a fost investigata posibilitatea utilizarii in anumite concentratii a unor ape minerale cu continut ridicat de saruri de potasiu, provenind din izvoare de pe teritoriul judetului Neamt.
Trebuie sa subliniem ca utilizarea in compozitia mediilor nutritive a unor “inlocuitori” in scopul reducerii pretului de cost al produsului final urmeaza sa se faca in conditii de maxima precautie, pentru a se evita modificari nedorite in compozitia chimica a biomasei rezultate din cultivare (precum acumularea unor cantitati prea mari de saruri minerale, acumularea unor metale grele sau chiar a unor pesticide etc.).
Procedee de recoltare
In cazul culturilor de laborator, recoltarea biomasei rezultate in instalatiile – de regula de capacitate redusa - se poate face folosind una din urmatoarele procedee de baza:
Centrifugarea suspensiei algale (utilizabila la majoritatea culturilor de microalge, cu exceptia cianoficeelor, care prezinta capacitate de plutire);
Filtrarea suspensiei algale prin sisteme de retinere adecvate (filtre din fibra de sticla, din hartie, filtre ceramice, site metalice sau din fire sintetice, etc).
In cazul culturilor la scara mare, alegerea procedeului de recoltare a biomasei depinde de mai multi factori, printre care:
Dimensiunea si forma organismelor cultivate;
Specificul proceselor de acvacultura;
Productivitatea culturilor.
In functie de factorii de mai sus, la care se adauga criterii de natura logistica si economica, se pot utiliza procedee precum:
Oprirea sistemelor de agitare (barbotare) a suspensiei algale, pentru facilitarea sedimentarii naturale a celulelor (cenobiilor sau coloniilor) pe fundul bazinelor de crestere, respectiv pentru acumularea la suprafata mediilor nutritive a biomasei plutitoare (in cazul cianoficeelor flotante);
Colectarea biomasei algale depunsa pe fundul bazinelor cu ajutorul unor dispozitive simple de sifonare;
Colectarea biomasei cianoficeelor flotante acumulata la suprafata mediului nutritiv dupa oprirea sistemelor de agitare a suspensiilor, cu ajutorul unor dispozitive cu site, tip fileu planctonic;
Centrifugarea – cu ajutorul unor centrifugi tehnice cu flux continuu – a suspensiei de microalge, utilizabila mai ales in cazul cultivarii algelor cu dimensiuni celulare foarte reduse, precum Chlorella, ce nu pot fi retinute in mod eficient de sistemele actuale de filtrare.
Procedee de prelucrare a biomasei
Este evident ca biomasa algala recoltata din bazinele de cultivare nu poate fi utilizata imediat, integral, la fata locului. Pe de o parte, este de presupus ca scopul productiei nu a fost acesta, iar pe de alta parte sunt necesare anumite operatiuni de conditionare a biomasei in vederea pastrarii ei ulterioare ori pentru utilizarea sa in continuare.
In esenta, actiunile de prelucrare a biomasei pot viza una sau mai multe dintre urmatoarele operatiuni, in functie de specificul culturii si de destinatia previzibila a productiei obtinute. Dintre operatiile de prelucrare mai importante necesare mentionam urmatoarele.
“Spalarea” biomasei, respectiv indepartarea resturilor de mediu nutritiv din masa algala, ce se prezinta de regula sub forma unei paste cu continut ridicat de lichid. In cazul recoltarii biomasei algale prin centrifugare in flux continuu, cea mai mare parte a mediului nutritiv este recuperata si restituita in bazinele de cultura; in acest procedeu tehnologic “pasta” algala rezultata este destul de consistenta, cuprinzand relativ putin mediu lichid. Pentru indepartarea nutrientilor si a celorlalte substante prezente in mediul nutritiv (in deosebi produsi extracelulari ai metabolismului algal), este de regula suficienta resuspensionarea masei algale intr-un volum de apa curata egal cu de 10 – 15 ori volumul pastei recoltate initial, operatia fiind repetata de doua ori; evident, dupa fiecare resuspensie a biomasei, este necesara repetarea procedeului de concentrare/recoltare a biomasei algale respective. In cazul utilizarii unor medii nutritive mai concentrate (asa cum este cazul culturilor de Spirulina, unde cantitatea de saruri din mediu se apropie de 20 grame/litru), operatiunile de “spalare” a biomasei sunt mai complicate. Este necesara repetarea spalarii, utilizarea unor cantitati mai mari de apa, evental folosirea unor cantitati mai mari de apa incalzita, pentru a mari capacitatea sa de dizolvare a sarurilor. O metoda specifica distincta consta in tratarea biomasei de Spirulina cu o solutie de acetat de amoniu cu concentratia de 1 %; utilizarea acesteia asigura eliminarea compusilor carbonati insolubili sau greu solubili in apa, prevenind concomitent permeabilizarea membranelor celulare si iesirea compusilor cu masa moleculara mica in solutia de lavaj.
O alta cale de tratare a biomasei de Spirulina consta in spalarea ei cu o solutie de acetat de amoniu avand concentratia de 1,5 %, in acest fel obtinandu-se indepartarea surplusului de saruri; se asigura atat eliminarea compusilor carbonati indolubili sau greu solubili in apa, cat si prevenirea permeabilizarii membranelor celulare si iesirea din celula a compusilor cu masa moleculara mica.
In cazul biomasei de Spirulina, dupa spalare, aceasta este resuspendata in apa, in proportia de 10 grame (substanta uscata)/1 litru apa, si tratata cu ultrasunete (22 kHz) pentru perioade de cate 30 secunde, de 5 ori, la intervale de 60 secunde, pana la dezintegrarea completa a celulelor de Spirulina.
O alta operatie de prelucrare a biomasei se refera la uscarea acesteia. Operatia este destul de importanta, mai ales prin felul in care este executata. Din testele de laborator pentru utilizarea unor etuve (cu ventilatie) s-a constatat ca este indispensabila uscarea foarte rapida a pastei de alge (la nivel de cateva ore); pe de alta parte, ridicarea temperaturii - in vederea accelerarii pierderii apei din masa algala - este limitata pana la valori ce nu pot depasi 38 – 400C, pentru a nu se ajunge la alterarea ireversibila a unor componente chimice ale biomasei (in primul rand a proteinelor). Este necesara depunerea biomasei algale pe tavile destinate uscarii in straturi uniforme, de cca 1-1 cm grosime, iar pe parcursul uscarii este indispensabila amestecarea repetata a biomasei.
O alternativa - utilizabila in raport cu anumite folosinte - o reprezinta congelarea biomasei (la – 15 . - 180C), ceea ce asigura o pastrare indelungata a biomasei algale, intr-o stare foarte apropiata de cea proaspata.
In vederea pastrarii, sau a utilizarii ulterioare, este necesara si macinarea acesteia, respectiv obtinerea unei pulberi fine, omogene, care se poate usor introduce in anumite preparate, sau se poate folosi pentru producerea unor tablete de calitate. Pentru aceasta operatie se poate folosi, in conditii de laborator (la scara mica), o rasnita de cafea, iar in conditii de productie la scara pilot sau chiar la nivel industrial, se utilizeaza instalatii tip “moara” de diferite capacitati.
La nivelul productiei industriale, uscarea si obtinerea “fainii” de alge, se folosesc instalatii de tipul atomizoarelor – a caror functionare se bazeaza pe uscarea in curent turbionar de aer incalzit (la 2000C) a unei “dispersii” a suspensiei concentrate de alge, realizata prin cultura la scara mare. Imaginea de mai jos reprezinta o astfel de instalatie, utilizata la producerea pulberii de Spirulina in Mexic. Fotografia a fost reprodusa dupa Hills (1981).

In legatura cu conditiile de pastrare indelungata a biomasei (pudrei) de alge, se impune respectarea unor conditii obligatorii, precum:
Asigurarea unei umiditati maxime de 2-3 % in masa uscata;
Temperatura mediului ambiant de maxim 12 – 150C;
Umiditatea atmosferica in spatiile de pastrare cat mai redusa;
Evitarea insolatiei directe la nivelul biomasei algale sau a containerelor (ambalajelor) respective;
Verificari periodice ale unor parametri ai biomasei algale, in primul rand a umiditatii materialului si a incarcarii microbiene a acestuia (mai ales ciuperci microscopice).
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |