
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Amestecuri de substante |
Amestecuri de substante
AMESTECURI DE SUBSTANTE
In natura, deci si in materialele de constructii, substantele (cu aceeasi structura si compozitie chimica) nu se gasesc decat foarte rar singulare, ci de cele mai multe ori sub forma de amestecuri si in contact cu alte substante.
La limita de separatie a doua substante, omogenitatea fiecareia se modifica, straturile periferice de particule (molecule, atomi, ioni) sunt supuse unor actiuni diferite fata de cele la care sunt supuse particulele interioare si in consecinta in structura substantelor cu forte de coeziune mai mari se produc presiuni moleculare si in acelasi timp vor atrage particulele din substantele cu forte de coeziune mai mici si astfel in zona de contact, concentratia acestei substante devine mai mare decat in restul volumului sau.
Aceste perturbari duc la aparitia fenomenului de interfata (suprafata de contact a doua substante).
1. Fenomene de interfata
Fenomenele de interfata depind de fortele de coeziune interne, iar intensitatea acestora va depinde de :
structura chimica a substantelor cu care vin in contact, pentru ca aceasta determina marimea fortelor de coeziune interna;
starile de agregare ale substantelor, pentru ca la aceeasi substanta marimea fortelor de coeziune depinde de starea de agregare (scad de la starea solida la starea gazoasa)
temperatura si presiune, pentru ca modifica starea energetica si implicit coeziunea interna;
concentratia particulelor intrucat coeziunea interna depinde de numarul de constituenti.
1.1. Adsorbtia, absorbtia, sorbtia si desorbtia
Adsorbtia consta in formarea unui strat de particule (molecule, atomi, ioni) dintr-o substanta cu forte de coeziune interna mai mici (in stare lichida sau gazoasa) pe suprafata unei substante cu forte de coeziune mai mari (in stare lichida sau solida).
Fenomenul de atragere a constituentilor fizici a unei substante la suprafata de contact cu alta substanta, ca urmare a dezechilibrului fortelor de coeziune se numeste adsorbtie sau fiziosorbtie
Substanta cu forte de coeziune mai mari, care provoaca adsorbtia se numeste adsorbant iar substanta a carei particule sunt atrase se numeste adsorbat.
In straturile de particule adsorbite concentratia este maxima la contactul cu adsorbantul si scade foarte repede pe masura ce particulele se gasesc la o distanta mai mare de suprafata de contact.
Daca fortele ce realizeaza adsorbtia sunt slabe, in mod obisnuit de tip Van der Waals, procesul este reversibil cu modificarea parametrilor de stare (presiune, temperatura) iar in cazul cand legaturile sunt de tipul legaturilor interatomice, procesul este ireversibil.
Procesul de formare a legaturilor chimice la suprafata de contact adsorbat - adsorbant se numeste ceimiosorbtie sau chemosorbtie si este un proces ireversibil
Chemiosorbtia se deosebeste de fiziosorbte prin:
se realizeaza prin legaturi interatomice (electrovalente in mod obisnuit)
este selectiva, adica un adsorbant nu adsoarbe orice adsorbat
particulele chemiosorbite nu mai sunt mobile pe suprafata absorbantului, fiind fixate in anumite pozitii bine determinate
Fiziosorbtia este un proces reversibil si se poate produce la modificarea parametrilor de stare (temperatura, presiune)prin modificarea structurii adsorbatului sau sub unele actiuni exterioare (energie electrica, mecanica etc.)
Procesul de indepartare a adsorbatului de pe suprafata adsorbantului se numeste desorbtie
Substantele solide, prin prezenta unor pori deschisi, pot atrage substantele cu forte de coeziune mai slabe si in interiorul volumului realizand fenomenul de absorbtie.
Absorbtia este procesul de patrundere si repartizare a unei anumite substante in tot volumul altei substante.
Sorbtia reprezinta suma valorilor adsorbtiei si absorbtiei.
Substantele adsorbite isi modifica in apropierea suprafetelor de contact cu adsorbantul o serie de caracteristici cum ar fi: vascozitatea (creste), temperatura de evaporare (creste) etc.
1.2. Tensiunea superficiala
Ca o consecinta a actiunii rezultantei fortelor de coeziune interna adsorbat-adsorbant, patura superficiala a adsorbantului va tinde sa-si reduca suprafata - se comporta ca o membrana elastica - intrucat pe directiile cuprinse in interfata fortele de coeziune intre particule se echilibreaza reciproc.
Forta tangentiala de la suprafata de contact a doua substante, pe o lungime de 1 m, se numeste tensiune superficiala cand substantele se gasesc in stari de agregare diferite si tensiune interfaciala cand substantele ce vin in contact sunt in stare lichida - nemiscibile.
Tensiunea superficiala (interfaciala) are semnificatii si se poate cuantifica numai atunci cand se precizeaza caracteristicile substantelor care vin in contact si temperatura acestora.
1.3. Liofilie si liofobie
O consecinta a tensiunii superficiale o reprezinta modul de comportare a substantelor care vin in contact astfel:
O molecula de lichid din apropierea limitelor se separatie solid - lichid si lichid - gaz este supusa la urmatoarele forte de atractie: (fig.1) ssg (solid - gaz), ssl (solid-lichid) si slg (lichid-gaz) a caror rezultanta este s

Fig.1. Adeziunea lichidelor la solid
Daca o picatura dintr-o substanta lichida se gaseste in contact cu o substanta solida, intr-un mediu gazos apar urmatoarele tensiuni superficiale: solid-gaz (ssg), solid-lichid (ssl ) si lichid-gaz (slg) a caror rezultanta este s si se numeste forta de adeziune la solid (fig.2).
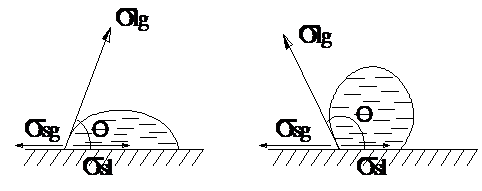
Fig.2. Liofilia si liofilia
Ecuatia de echilibru a tensiunilor superficiale cu punctul triplu de contact si a rezultantei acestora este :
![]() (1)
(1)
Unghiul q se numeste unghi de racord sau unghi de udare si constituie parametrul variabil si pentru ca s sa fie minim trebuie ca:
q daca ssg >ssl
q daca ssg <ssl
Liofilia caracterizeaza afinitatea dintre un lichid si un solid, consecinta a faptului ca tensiunea superficiala a solidului este mai mare decat a lichidului, astfel incat rezultanta s sa conduca la depasirea fortelor de atractie intermoleculara din lichid si acesta se intinde pe fata solidului, picatura capata forma alungita.
Liofilia reprezinta afinitatea solidului fata de lichid - lichidul uda solidul - se realizeaza cand unghiul de udare are valori mai mici de 900.
Liofobia se manifesta atunci cand tensiunea superficiala a lichidului este mai mare decat tensiunea superficiala a solidului, rezultanta s este indreptata spre lichid.
Liofobia reprezinta lipsa afinitatii solidului fata de lichid - lichidul nu uda solidul - si se realizeaza cand unghiul de udare are valori mai mari de 900.
In situatia cand substanta lichida este apa, fenomenele se numesc hidrofilie si hidrofobie.
Ascensiunea capilara
O alta consecinta a perturbarii tensiunilor superficiale la contactul dintre substante diferite (ca structura si starea de agregare) este capilaritatea .
Tendinta de ridicare sau coborare a unui lichid intr-un capilar solid se numeste ascensiune capilara
Un capilar se formeaza intr-un solid prin unirea unor pori si nu are un ax liniar si sectiune constanta, sau poate fi un vas capilar cand are un ax liniar si sectiune mica si constanta.
Daca solidul are tensiunea superficiala mai mare ca a lichidului, in capilar lichidul va avea tendinta de ascensiune (apa in solid) (fig.3a.) daca lichidul are tensiunea superficiala mai mare, acesta va avea tendinta de coborare (mercurul intr-un vas capilar) (fig.3.b.).

Fig.3. Miscare capilara
Inaltimea de ridicare sau coborare (numita si inaltime de capilaritate) a lichidului intr-un capilar va depinde de caracteristicile fizice ale lichidului si de elementele geometrice ale capilarului. Pentru un vas capilar, inaltimea de capilaritate se poate calcula la echilibrul intre forta de adeziune la solid (s) si presiunea hidrostatica a lichidului.
![]()
de unde
![]() (2)
(2)
in care:
d = diametrul vasului capilar
r = densitatea lichidului
g = acceleratia gravitationala
De remarcat ca inaltimea capilara va fi pentru acelasi lichid si solid cu atat mai mare cu cat diametrul este mai mic. Intr-un capilar, inaltimea capilara va fi mai mica decat intr-un vas capilar ca urmare a variatiei diametrului si a traseului neliniar; astfel, intr-un teren nisipos inaltimea capilara va fi mai mare decat in pietris. Pentru a impiedica ridicarea apei din terenul de constructii in peretii unor cladiri, se prevad elemente de constructii care sectioneaza capilarele fig.

Fig. Intreruperea capilaritatii in elementele de constructii
1.5. Miscibilitatea lichidelor
Daca doua lichide nu se pot amesteca pentru a forma o structura omogena (particulele constituente nu pot difuza reciproc) interfata acestora, datorita tensiunii interfaciale, se comporta ca o membrana impermeabila.
Miscibilitatea lichidelor este proprietatea acestora de a forma amestecuri omogene prin difuzia reciproca a componentelor.
Miscibilitatea lichidelor se reduce odata cu cresterea tensiunii interfaciale.
Lichidele care nu por forma amestecuri omogene se numesc nemiscibile.
1.6. Influenta absorbtiei asupra caracteristicilor substantelor
La suprafata de separatie gaz - lichid si lichide nemiscibile prin adsorbtie se modifica tensiunea superficiala. In statul adsorbit tensiunea superficiala are o valoare intermediara intre tensiunile superficiale ale celor doua substante care vin in contact, mai apropiata de tensiunea superficiala cea mai mica.
Tensiunea superficiala a lichidelor, cu aplicatii in practica, se poate modifica cu ajutorul unor substante numite substante tensioactive.
Substantele tensioactive, in general substante organice cu structura polara, se acumuleaza pe suprafata lichidelor orientandu-se in functie de natura suprafetelor (hidrofila sau hidrofoba) formand "perii moleculare".
Stratul monomolecular format modifica fortele de atractie intre moleculele lichidului ceea ce conduce si la modificarea tensiunii superficiale pana la modificarea caracterului (hidrofob sau hidrofil).
Adsorbtia pe suprafata solidelor modifica o serie de proprietati ale acestora. Practic se poate considera ca toate materialele solide aflate in aer au pe suprafata lor o pelicula adsorbita din gazele si vaporii de apa din atmosfera, aceasta producand urmatoarele modificari:
marirea progresiva de volum, incepand de la suprafata de contact, ceea ce poate produce fisurarea solidului;
Reducerea rezistentei la intindere, datorita microfisurilor deschise la suprafata solidului, in care patrund moleculele adsorbite, largindu-le si adancindu-le printr-un efect de pana (fig.5); astfel s-a stabilit ca rezistenta la intindere a unei baghete din sticla incalzita (in vid la 3500C cand se produce desorbtia gazelor de pe suprafata sticlei) este de doua ori mai mare decat a unei probe asemanatoare dar pastrate n aer; aceasta situatie explica de ce rezistenta unor fire mai subtiri este mai mare decat a celor cu sectiune mai mare.
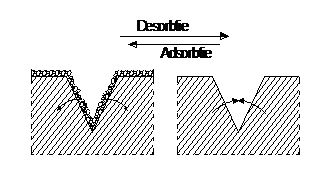
Fig.5. Efectul de pana a stratului adsorbit de lichid pe solid
scaderea frecarii dintre solide, pelicula avand rol de lubrifiant; in cazul existentei statului adsorbat (fig.6) frecarea dintre solide este mult redusa (coeficientul de frecare subunitar, iar daca se inlatura statul adsorbit prin incalzire coeficientul de frecare creste mult peste unitate.

Fig.6. Rolul de lubrefiant al lichidului adsorbit
1.7. Aplicatii ale fenomenelor de interfata
Una din aplicatiile cele mai frecvente in tehnica a fenomenelor de interfata este modificarea caracterului liofil sau liofob al materialelor.

Fig.7.
Procesul de liofobizare si liofilizare
Liofobizarea (hidrofobizarea) consta in micsorarea afinitatii unor substante fata de lichide (apa) prin folosirea substantelor tensioactive. Pe suprafata liofila a solidului substanta tensioactiva se adsoarbe cu terminatia polara pe solid si cu terminatia nepolara spre exterior (fig.7.a) conferind ansamblului un caracter hidrofob.
La materialele de constructii liofobizarea se aplica la: stabilizarea argilelor, obtinerea cimentului hidrofob si a materialelor de protectie la actiunea apei.
Liofilizarea (hidrofilizarea) urmareste modificarea caracterului liofob al unei substante in liofil si se folosesc tot substante tensioactive cu molecule alungite care orienteaza pe suprafata substantei liofile (fig7.b.). se aplica in special la obtinerea emulsiilor (amestecuri de lichide nemiscibile cum ar fi uleiuri in apa, bitm in apa etc.).
Flotatia se foloseste la imbunatatirea continutului de substante utile din minereuri. Minereurile sunt materiale naturale care contin sub forma de combinatii metale utile alaturi de steril. Partea activa dintr-un mineral are caracter hidrofob, iar sterilul are caracter hidrofil. Minereurile se macina foarte fin, astfel incat tensiunea superficiala sa fie mai mare decat greutatea particulelor; pulberea astfel obtinuta se raspandeste pe suprafata apei, realizandu-se o separare, partea utila din minereu va pluti pe suprafata apei, iar particulele de steril se decanteaza datorita greutatii crescute prin adsorbtia apei si se va realiza astfel separarea urmarita.
Spalarea. Indepartarea substantelor organice de pe suprafata unui solid se realizeaza foarte greu datorita faptului ca acestea sunt hidrofobe. Prin adaugarea sapunului sau a detergentilor acestia modifica caracterul suprafetei murdare din hidrofob in hidrofil, murdaria se fragmenteaza, se emulsioneaza si poate fi indepartata.
Cromatografia consta in separarea unor amestecuri foarte complexe in substantele componente.
1.8. Suprafata specifica
Fenomenele de suprafata depind de marimea suprafetelor de contact intre ele si cum solidele au volum si forma proprie, depind de suprafata solidului in zonele de contact.
Suprafata specifica a unui material reprezinta raportul dintre suprafata care il separa de mediul in care se afla si volumul sau.
|
Suprafata specifica depinde de gradul de fragmentare al materialului. Daca se considera un cub cu latura de 1cm, deci cu volumul de 1cm3, la fragmentarea prin reducerea laturii in progresie geometrica, se obtine urmatoarea progresie a numarului de cuburi si a suprafetei specifice.
Tabel 1.
|
Latura cubului |
Nr. de cuburi |
Suprafata specifica cm2/cm3 |
|
|
1cm |
|
|
|
|
1mm |
|
|
6x10 |
|
|
|
|
6x102 |
|
|
|
|
6x103 |
|
|
|
|
6x104 |
|
100m μ |
|
|
6x105 |
|
10m μ |
|
|
6x106 |
|
1m μ |
|
|
6x107 |
Daca forma particulelor ar fi sferica (sfera are raportul suprafata volum cel mai mic dintre toate corpurile geometrice) suprafata specifica se reduce la 80%.
Marimea suprafetei specifice se poate realiza prin mai multe procedee cum ar fi:
Macinarea materialului (in mori tubulare cu bile) cand particulele obtinute pot ajunge la dimensiunea de ordinul zecimii de microni (cazul cimentului) si daca se ia in consideratie si suprafata rugoasa a particulelor suprafata specifica creste foarte mult.
Marirea rugozitatii suprafetelor, in special prin actiunea moderata a unor agenti corozivi. Datorita neomogenitatii suprafetei solidului coroziunea se produce neuniform, siprafata transformandu-se intr-un camp plin de santuri microscopice.
Metode de precipitare. In urma unor reactii chimice produsii de reacsie precipita pe un suport solid inert din punct de vedere chimic.
2. Sisteme disperse
S-a aratat ca materialele in natura sunt formate din amestecuri de substante care se pot deosebi intre ele prin structura chimica sau prin starea de agregare. Amestecurile de substante formeaza sistemele de substante care se caracterizeaza prin:
Componenele sistemului, definite prin substantele individuale diferentiate din punct de vedere chimic.
Fazele sistemului formate din partile omogene si distincte din punct de vedere fizic, separate intre ele prin suprafete bine definite.
Deci, componentele unui sistem definesc partile acestuia care pot fi individualizate sub aspect structural chimic, iar fazele sistemului, partile, care pot fi individualizate sub aspect fizic. De exemplu:
amestecul apei si a vaporilor sai (in timpul fierberii) formeaza un sistem cu o componenta (apa) si doua faze (lichida si gazoasa);
amestecul a doua gaze sau doua lichide miscibile realizeaza un sistem cu doua componenete si o faza (gazoasa sau lichida);
amestecul dintre un lichid si un gaz (apa carbogazoasa) formeaza un sistem cu doua componente si doua faze.
Sistemele cu o singura faza la componentele nu pot fi observate (individualizate) cu mijloace fizice (in lumina naturala) se numesc sisteme omogene.
Sistemele cu doua sau mai multe faze care se pot individualiza fizic prin suprafete de separatie formeaza sisteme eterogene.
Partea predominanta (continua) dintr-un sistem formeaza mediul de dispersie sau faza dispersanta, iar partea discontinua se numeste faza dispersata sau dispersoid.
Sistemele de substante se pot diferentia dupa fazele sistemului si dupa marimea dispersoidului (tabelul2).
Sistemele disperse pot stabile sau instabile (mentinerea sau nu in timp a fazei dispersate) ca o consecinta a fenomenelor de interfata care permit sau nu aglomerarea dispersatului si eliminarea acestuia din faza dispersanta prin sedimentare sau difuzie, fenomene ce depind la randul lor de suprafata specifica a dispersoidului.
Tabel 2.
|
Marimea dispersoidului cm |
Tipul sistemului |
Denumirea sistemului |
Observatii |
|
< 10-7 |
Omogen |
Solutii |
Dispersoidul are marimea moleculelor mici a atomilor sau a ionilor, nu se por observa la microscopul optic |
|
|
Eterogen |
Coloid |
Dispersoidul se poate observa la microscopul optic de mare putere de marire dar nu cu ochiul liber |
|
> 10-5 |
Eterogen |
Suspensie |
Dispersoidul se poate observa cu microscopul optic si cu ochiul liber |
Un sistem dispers va fi cu atat mai stabil cu cat suprafata specifica a dispersoidului, va fi mai mare ca urmare a intensitatii fenomenelor de suprafata si in acelasi timp, in functia de diferenta intre densitatile fazelor care faciliteaza separarea prin sedimentare.
2.1. Solutii
Solutiile sunt cele mai des sisteme de substante intalnite in natura si stau la baza formarii unor materiale de constructii influentand in acelasi timp durabilitatea acestora.
Sistemele disperse omogene in care dispersoidul este constituit din molecule mici, atomi sau ioni (nu depasesc ca marime 10-7cm) se numesc solutii.
In solutii mediul de dispersie se numeste solvent sau dizolvant iar componenta dispersata se numeste solut, solvat sau dizolvat; procesul de realizare a solutiilor (dispersarea solutului in solvent) se numeste dizolvare.
Fazele sistemului determina denumirea solutiilor (se folosesc pentru notarea starilor de agregare simbolurile: G - gaz, L - lichid, S - solid (tabel 3).
Dizolvarea se produce in mod diferit in functie de natura legaturilor interatomice si de starea de agregare a componentilor ce formeaza sistemul si este urmare a difuziei solutului in solvent.
Tabelul 3
|
Solvent |
solut |
simbol |
denumire |
|
Starea de agregare a componentilor |
|||
|
gaz |
gaz |
G-G |
amestecuri de gaze |
|
lichid |
gaz |
G-L |
solutii lichide |
|
lichid |
L-L |
||
|
solid |
S-L |
||
|
solid |
gaz |
G-S |
aliaje solutie solida |
Solutiile de G-G si G-L se realizeaza ca urmare a capacitatii gazelor de a difuza prin constituentii solventului;
La solutiile L-L si S-L dizolvarea se produce in doua etape: in prima etapa se rup legaturile solutului si se realizeaza legaturi solvent - solut si care in etapa urmatoare difuzeaza in sovent;
Solutiile G-S si S-S se realizeaza in stare lichida a solventului si dupa caz si a solutului, dupa mecanismul L-L.
Solutiile S-S constituente de baza in metale si pentru substantele cristaline izomorfe, se realizeaza prin inlocuirea din reteaua cristalina a solventului cu particulele de solut solutii de substitutie sau pozitionarea particulelor de solut in interstitiile retelei cristaline a solventului solutii de interstitie (fig.8).
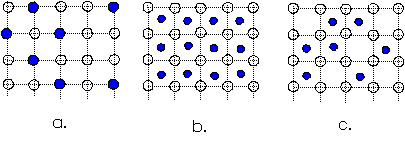
Fig.8. Solutii solide
Solutiile de substitutie se pot forma daca ionii constituenti au raze ionice egale sau apropiate ca marime cand se pot inlocui in retea in orice proportie (fig.8.a).
La solutiile de interstitie, cand ionii constituenti sunt diferiti ca dimensiuni, astfel incat particulele de solut sa se poata plasa in interstitia particulelor de solvent, distributia poate fi uniforma (fig.8.b.) sau dezordonata (fig.8.c.), dar care la o anumita temperatura isi poate uniformiza distributia formand suprafetele.
Formarea solutiilor mai depinde si de natura legaturilor interatomice intrucat este necesar ca interactiunea solvent - solut sa compenseze interactiunea particulelor de solut si se pot realiza cand:
Legaturile chimice ale componentelor respectiv legaturile solvent - solut sunt de aceeasi natura; substantele cu legaturi ionice se dizolva in substante cu legaturi de acelasi tip sau covalente polare (apa) si nu se dizolva in substantele cu legaturi nepolare (solventi organici).
Energiile de legatura ale componentelor sunt comparabile sau mai mici decat energiile de legatura solvent - solut; solidele cu retea moleculara se dizolva in solventi organici deoarece fortele de legatura din reteaua cristalina sunt de tipul fortelor van der Waals sau legaturi de hidrogen, iar fortele de legatura solvent - solut sunt de tip van der Waals.
Pentru studiul materialelor de constructii intereseaza in mod deosebit mecanismul dizolvarii substantelor solide in solventi lichizi, in special apa.
Dizolvarea va depinde natura legaturilor solidului (solut) si ale apei (solvent) si se realizeaza in doua etape (fig.9).
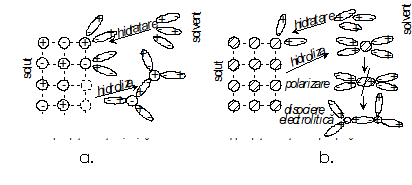
Fig.9. Procesul de hidratare -
hidroliza
In prima etapa moleculele polare de apa sunt atrase de constituentii solidului formand pelicule cu densitati diferite, maxime la suprafata de contact, etapa numita hidratare.
In etapa a doua, numita hidroliza particulele de solvent conduc la ruperea unor unitati structurale din solut (ioni la reteaua cristalina - fig.9.a., molecule la reteaua moleculara - fig.9.b.), care difuzeaza in solvent (apa) sub forma de particule hidratate. La structurile cu legaturi moleculare ale solidului apare si o a treia etapa cand se realizeaza hidroliza moleculelor hidratate formate in etapa a doua.
Prin hidroliza in apa se realizeaza noi legaturi care au ca efect aparitia in solutie a unor ioni, fenomen care se numeste disociere electrolitica sau ionica, iar substantele care determina acest fenomen se numesc electroliti.
Procesul de hidratare - hidroliza are o foarte mare importanta in mecanismele de intarire a liantilor minerali (ipsos, var, ciment).
2.1.1. Concentratia si solubilitatea solutiilor
Principala caracteristica a unei solutii o reprezinta concentratia.
Concentratia solutiilor - reprezinta marimea care exprima raportul dintre solut si solvent.
Dupa concentratie, se deosebesc:
solutii concentrate - cand cantitatea de solut este mare in raport cu cantitatea de solvent;
solutii diluate - cand cantitatea de solut este mica in raport cu cantitatea de solvent.
Dupa modul de exprimare a partilor unei solutii concentratia poate fi:
Concentratia procentuala de masa - se exprima prin raportul dintre masa solutului si 100g de solutie.
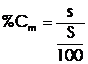 (3
)
(3
)
In care:
s - masa solutului (grame)
S - masa solventului (grame)
Concentratia procentuala de volum - se exprima prin raportul dintre masa solutului si 100ml de solutie.
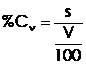 (4 )
(4 )
In care:
s - masa solutului (grame)
V - volumul solutiei (mililitri)
Masa de solut exprimata in grame continuta intr-un mililitru de solutie se numeste titru si se noteaza cu T.
Concetratia procentuala volumica reprezinta raportul dintre volumul solutului si 100 unitati de volum de solutie.
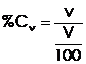 (5)
(5)
In care:
v - masa solutului (mililitri)
V - volumul solutiei (mililitri)
Concentratia molara (molaritate) - se exprima prin numarul de moli de solut dizolvati intr-un litru de solutie.
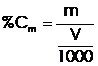 (
6)
(
6)
In care:
m - reprezinta numarul de moli de solutie
V - volumul de solutie (mililitri)
Concentratia molala (molalitate) - se exprima prin numarul de moli de solutie dizolvati in 1000 g de solvent.
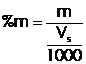 (
7)
(
7)
In care:
m - numarul de moli de solut
Vs - volumul de solvent (mililitri)
Concentratia normala (normalitate) - se exprima prin numarul de echivalenti gram (vali) de solut dizolvati intr-un litru de solutie.
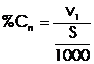 (8)
(8)
In care:
V1- numarul de vali de solut
S - volumul de solusie (mililitri)
In practica se intalnesc cazuri in care substantele pot forma amestecuri omogene, se amesteca intre ele in orice proportie, dar cel mai adesea amestecarea se poate realiza in anumite limite, adica concentratiile pot avea o valoare maxima - limita de saturatie.
Concentratia maxima la care poate ajunge o solutie se numeste concentratia de saturatie, iar solutia astfel realizata se numeste solutie saturata.
Concentratia de saturatie va fi determinata de natura constituentilor solutiei, de temperatura si de presiune.
Concentratia solutului intr-o solutie saturata se numeste solubilitatea solutului (a substantei).
In functie de solubilitatea maxima in apa (S - grame de solut la 100g apa la saturatie, 1 atm si 200C) substantele pot fi:
Substante usor solubile (S > 10g; > 1%)
Substante greu solubile (S = 10g 0,01g; 1%0,1%)
Substante insolubile (S < 0,01g)
Solubilitatea variaza in functie de temperatura si presiune (la gaze creste odata cu cresterea presiunii si scade odata cu cresterea temperaturii).
Daca unei solutii saturate i se modifica parametrii de stare din solutie se poate elimina solutul pana se ajunge la solubilitatea noilor conditii.
Eliminarea solutului dintr-o solutie saturata, la modificarea parametrilor de stare, se produce prin degazare la solutii G-L, prin separare la solutiile L-L si prin precipitare la solutiile S-L.
Este posibil uneori ca eliminarea solutului din solutie sa intarzie sa se produca, astfel incat se ajunge la o concentratie superioara saturatiei.
Starea solutiei in care concentratia este superioara solubilitatii se numeste stare suprasaturata.
Cand starea suprasaturata a unei solutii este urmare a unei reactii chimice a solutului cu solventul si in cazul cand solubilitatea noii structuri este nai mica se produce precipitarea care explica procesul de intarire a unor lianti minerali cum ar fi ipsosul.
Starea suprasaturata este instabila si in cazul unui aport energetic sau prezentei unui germen de cristal solutia precipita si cristalizeaza.
2.1.2. Proprietatile coligative ale solutiilor
Solutiile prezinta o serie de proprietati diferite de ale solventului si care depind de numarul de particule prezente in sistem si independent de proprietatile particulelor.
Proprietatea coligativa este caracteristica unui sistem determinata de numarul particulelor din sistem, dar independent de proprietatile proprii ale particulelor.
Proprietatile coligative ale solutiilor sunt:
Scaderea presiuni de vapori;
Ridicarea punctului de fierbere;
Coborarea punctului de solidificare (congelare);
Presiunea osmotica.
Legea lui F.M. Raoult (1867) prevede ca scaderea relativa a presiunii de vapori a unei solutii diluate este direct proportionala cu fractia molara a solutului din solutie fiind independenta de temperatura si natura solutului.
Conform legii lui Raoult presiunea de vapori a unei solutii va fi intotdeauna mai mica decat cea a solventului pur - in solvent se gasesc mai multe fractiuni molare de solut fata de solventul pur unde fractiunea de solut este 0.
Consecintele reducerii presiunii de vapori sunt ridicarea temperaturii de fierbere si coborarea temperaturii de solidificare (congelare) a solutiilor lichide fata de solventului pur.
Coborarea temperaturilor de congelare a solutiilor in apa au aplicatie in constructii la executia constructiilor pe timp friguros (turnarea betonului si prelucrarea mortarelor) sau la dezghetarea drumurilor.
Osmoza reprezinta procesul de trecere printr-o membrana semipermeabila a unui solvent intr-o solutie a aceluiasi solvent sau dintr-o solutie mai diluata in una mai concentrata.
Membrana semipermeabila este o folie cu pori foarte mici care permit trecerea moleculelor solventului retinand moleculele solutului.
Fenomenul de osmoza se produce ca urmare a tendintei solutiilor de a-si reduce concentratia prin difuzie.
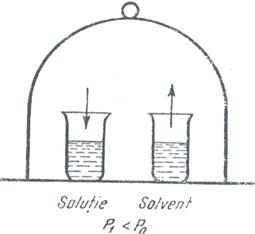
Daca intr-un spatiu inchis
(de exemplu sub un clopot de sticla) se aseaza doua vase:
unul cu solvent si unul cu o solutie a aceluiasi solvent (fig. 10)
are loc urmatorul proces: din cele doua vase in spatiul inchis
se vor afla vapori a celor doua lichide (solventi si
solutie) care au presiunea de vapori diferita si cum in acest
spatiu nu poate exista decat o singura presiune de vapori
inseamna ca cele doua presiuni de vapori trebuie sa se
egaleze. Cum presiunea de vapori a solventului p0 este
constanta trebuie sa se modifice presiunea de vapori p1 a
solutiei. Acest proces este posibil numai daca solutia se
dilueaza, ceea ce inseamna o condensare a vaporilor de solvent
si deci o vaporizare continua a acestuia. Procesul se termina
cand tot solventul s-a evaporat. Rezulta astfel tendinta de diluare a
solutiei.
Fig.10. Modificarea procentului de solvent din solutie
Presiunea osmotica a unei solutii este presiunea echivalenta presiunii hidrice care se opune trecerii dizolvantului in solutie cand dizolvantul si solutia sunt separate printr-o membrana semipermeabila.
Presiunea osmotica se poate pune in evidenta intr-o celula osmotica (fig.11) formata dintr-un recipient in care se gaseste solutia diluata sau solventul (3), om palnie in care se va gasi solutia concentrata (1) inchisa la partea inferioara cu o membrana semipermeabila (2).
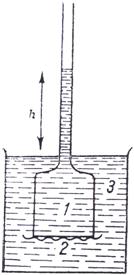
![]()
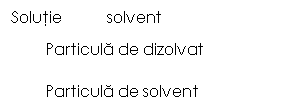
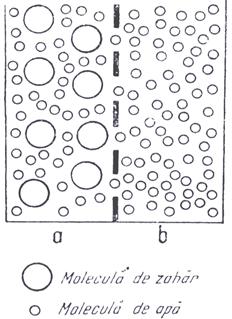
Fig.11. Celula osmotica
![]() Fenomenul de osmoza va conduce la
cresterea volumului in solutie mai concentrata ca urmare a
difuziei solventului si corespunzator se va ridica nivelul lichidului
din palnie pana cand presiunea coloanei de lichid devine suficient de mare
pentru a impiedeca difuzia moleculelor de solvent prin membrana
semipermeabila. Inaltimea h a coloanei de lichid din palnie
reprezinta presiunea osmotica.
Fenomenul de osmoza va conduce la
cresterea volumului in solutie mai concentrata ca urmare a
difuziei solventului si corespunzator se va ridica nivelul lichidului
din palnie pana cand presiunea coloanei de lichid devine suficient de mare
pentru a impiedeca difuzia moleculelor de solvent prin membrana
semipermeabila. Inaltimea h a coloanei de lichid din palnie
reprezinta presiunea osmotica.
Osmoza explica unele procese biologice la nivelul celulei vegetale si animale, intarirea liantilor hidraulici, coroziunea liantilor intariti etc.
2.2. Sisteme coloidale
Sistemele disperse, microeterogene, in care dispersoidul are dimensiunile cuprinse intre 10-7 - 105 se numesc sisteme coloidale sau coloizi.
In cadrul sistemelor disperse coloizii ocupa un loc intermediar intre dispersele omogene (solutii) si dispersele grosiere neomiogene fiin considerate sisteme microeterogene la care particulele dispersoidului sunt mai mari decat ale moleculelor mici dar mai mici decat lungimea de unda a luminii in spectrul vizibil (nu se pot observa la microscopul optic).
Sistemele coloidale se por forma intre toate fazele cu exceptia G-G care formeaza un sistem omogen (tabel 4)
Tabel
|
Mediul de dispersie |
Dispersoid |
Simbol |
Denumire |
|
Starea de agregare a componentilor |
|||
|
gaz |
lichid |
L-G |
aerosoli |
|
solid |
S-G |
||
|
lichid |
gaz |
G-L |
spume fine |
|
lichid |
L-L |
emulsii coloidale |
|
|
solid |
S-L |
soli |
|
|
solid |
gaz |
G-S |
xerogel |
|
lichid |
L-S |
geluri |
|
|
solid |
S-S |
aliaje |
|
Suprafata specifica mare a particulelor de dispersoid inlesneste dezvoltarea fenomenelor de interfata si astfel coloizii pot fi liofili (hidrofili) la care particulele fazei disperse sunt umectate de mediul de dispersie si liofobi (hidrofobi) la care particulele fazei disperse nu sunt umectate de mediul de dispersie.
Pentru studiul materialelor de constructii intereseaza in primul rand coloizii cu dispersoid solid in structurile S-L - sol si L-S - gel. Realizarea acestor structuri incepe cu formatiunea sol.
Soli liofili
La solii liofili datorita afinitatii mediului de dispersie fata de dispersat particulele de dispersoid se autodifuzeaza; pe fiecare particula de dispersoid se realizeaza un invelis din mediul de dispersie care va impiedeca aglomerarea datorita elasticitatii structurii. Prin acest mecanism este impiedecata aglomerarea particulelor de dispersoid fiind compensata partial diferenta de densitate intre fazele sistemului.
Soli liofobi
In cazul coloizilor liofobi, datorita lipsei de afinitate intre faze, pentru realizarea dispersiei si stabilitatii sistemului este necesar mai intai modificarea caracteristicii suprafetei dispersoidului din luiofob in liofil si pentru aceasta se folosesc substantele tensioactive.
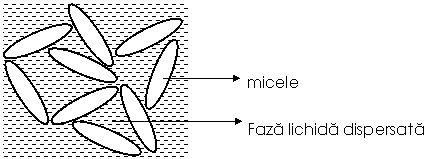
Substantele tensioactive se adsorb pe suprafata dispersoidului cu formarea unei pelicule hidrofile incarcata cu sarcina electrica (A) (fig. ). In jurul acestor structuri ionice complexe vor fi atrasi contraioni (B) (ioni de sens contrar ionilor din primul strat - A) din mediul de dispersie formandu-se un strat dublu electric, sistemul format numindu-se micele. Cand sarcina electrica a primului strat A de ioni este negativa sistemul se numeste negativ sau anionic, iar cand sarcina acestor ioni este pozitiva sistemul se numeste pozitiv sau cationic.
Stabilitatea solilor hidrofobi se asigura prin formarea micelelor care se resping electrostatic ca urmare a unei sarcini electrice de acelasi semn.
Obtinerea sistemelor coloidale
Metodele de obtinere a sistemelor coloidale difera dupa tipul coloidului si natura fazelor componente.
1. Metode de dispersare in care faza dispersata este fin fragmentata pana la dimensiunile coloizilor si difuzata in faza dispersanta; aceasta se va realiza prin:
Dispersare mecanica - macinare in mori coloidale;
Dispersare electrica - descarcari electrice intre doi electrozi;
Dispersare ultrasonica - folosirea sunetelor de inalta frecventa.
2. Metode de condensare prin care se realizeaza aglomerarea unor particule mai mici (molecule) dintr-o solutie pana la dimensiunile coloidale folosindu-se:
Metode chimice - reactii de dublu schimb, de hidroliza, de reducere - oxidare;
Schimbarea solventului - se schimba solventul prin adaugare lenta si agitare;
Condensarea vaporilor unor substante.
Separarea fazelor din sistemele coloidale
Separarea fazelor din soli poate deveni necesara in unele procese de prelucrare a materialelor de constructii si se poate realiza prin:
Evaporarea totala a fazei lichide;
Salifierea consta in introducerea de electroliti, in solii liofili, care produc desorbtia fazei dispersante, incat particulele de dispersoid raman fara invelisul eleastic, se reunesc in formatiuni mari (proces numit coagulare) si sedimenteaza;
Ultracentrifugarea - se folosesc intalatii de centrifugare cu turatii foarte mari, cand datorita fortei centrifuge, cand faza cu densitate mai mare se aglomereaza la periferia centrifugei.
Electroforeza se aplica solilor liofobi si consta in aplicarea unui camp electric continuu care orienteaza contraionii, pe de o parte si retul micelei pe de alta parte, spre electrozii corespuzatori.
2.3. Geluri
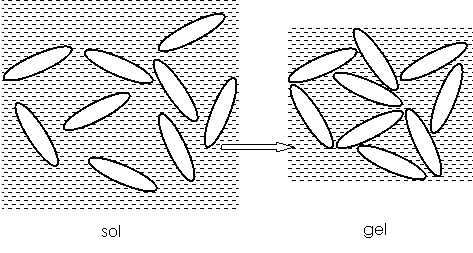
Structurile coloidale la care mediul de dispersie este solid. Iar dispersatul este lichid se numeste gel.
Gelurile se obtin prin reducerea
treptata a fazei lichide din structura sol (prin evaporare, absorbtie
la suport) pana cand particulele de dispersoid ajung in contact formand o
retea tridimensionala in care ramane dispersata faza
lichida (fig.12). Gelurile se pot realiza prin reducerea energiei unui
sistem tip sol de concentratie mare.
Fig.12. Structura gelurilor
Transformarea sol - gel se numeste gelificare si nu trebuie confundata cu coagularea, intrucat nu se produce separarea fazelor de pe micele.
Gelificarea produce modificari ale proprietatilor sistemului coloidal prin: disparitia sau reducerea caracteristicilor fazei lichide (cresterea vascozitatii, disparitia curgerii) si aparitia proprietatilor solidelor (rezistentei mecanice (elasticitate, duritate).
Principala caracteristica mecanica a gelurilor
este elasticitatea care depinde de forma dispersoidului; gelurile sunt cu atat
mai elastice cu cat dispersoidul are o forma mai alungita si
procentul de faza lichida este mai mare.
Fig.13. Gelificarea
Daca intre particulele fazei dispersante din gel se realizeaza legaturi interparticulare, procesul de transformare sol-gel este reversibil; daca in punctele de contact a particulelor dispersate din structura gelurilor se realizeaza legaturi chimice procesul de gelificare este ireversibil.
Transformarile sol-gel, aplicate la folosirea materialelor de constructii, se pot realiza prin:
Adaugare de faza lichida (mediu initial de dispersie) - transformarea pastei de var prin adaugarea apei si obtinerea laptelui de var;
Aport energetic (agitare mecanica, incalzire moderata) - vibrarea betonului in procesul de turnare, incalzirea bitumului la realizarea betoanelor asfaltice etc.;
Folosirea unor substante chimice, (in mod obisnuit electroliti) care se adsorb pe particulele de solid marindu-le potentialul electrocinetic ce conduce la dispersarea particulelor; substantele folosite in acest sens se numesc peptizanti, iar procesul se numeste peptizare.
Tixotropia este proprietatea unor geluri (tixotropice) de a trece in soli prin aport energetic.
In timp gelurile pastrate in mediu uscat isi pierd prin evaporare sau procese chimice o mare parte din faza lichida care este inlocuita cu o faza gazoasa realizandu-se procesul de uscare.
Gelurile la care faza lichida a fost inlocuita cu o faza gazoasa se numesc xerogeluri.
Uscarea gelurilor este insotita de:
Contractii mari de volum datorita rearanjarii strucuturii; daca contractia este impiedecata (cazul aderarii pietrei de ciment pe agregat in beton) structura se poate fisura;
Reducerea elasticitatii, respectiv cresterea rigiditatii ca urmare a realizarii de legaturi fizice suplimentare si uneori de legaturi chimice.
Procesul ireversibil de rigidizare in timp, a gelurior, ca urmare a unor modificari structurale fizice si chimice se numeste imbatranirea gelurilor.
In contactul cu faza lichida (umezire in cazul apei) gelurile absorb lichidul si isi maresc volumul, proces numit imbibare. Uscarea gelurilor dupa imbibare conduce la o noua reducere de volum de intensitate mai mica decat inainte de realizarea imbibarii. Variatiile de volum la uscare - imbibare sunt cu atat mai mari cu cat gelurile sunt mai elastice si mai proaspete.
Sistemele coloidale explica fenomenele de intarire a liantilor hidraulici, procese de prelucrare a bitumurilor, structura si modul de folosire a chiturilor, comportarea unor argile etc.
2. Sisteme eterogene
Sistemele eterogene sunt sisteme disperse macroeterogen, putin stabile, in care marimea dispersoidului este mai mai mare decat 10-5cm.
Sistemele eterogene se pot realiza prin toate combinatiile starilor de agregare, cu exceptia combinatiei G-G.
Sistemele eterogene in medii lichide au stabilitate redusa datorita marimii dispersoidului (fenomenele de suprafata nu pot compensa greutatea particulelor) si a diferentelor de densitate intre componenti.
Suspensii in medii lichide
Spumele sunt suspensii de gaz in lichid (G-L).
Difuzia gazului in mediul de dispersie lichid se poate realiza prin agitare (spumare), prin suflare (barbotare) si respectiv prin degajare de gaze ca urmare a unor reactii chimice in mediul de dispersie.
Stabilitatea aglomerarilor de gaz in mediul de dispersie in faza lichida se realizeaza prin reducerea tensiunii superficiale a lichidului si in acest scop se folosesc substante tensioactive - spumanti de regula sapunuri si detergenti.
Emulsiile sunt suspensii de tip realizate intre lichide nemiscibile (L-L).
Emulsiile se numesc directe sau ulei in apa (UA) si inverse sau apa in ulei (AU) dupa cum lichidele nemiscibile formeaza fazele sistemului.
Stabilitatea emulsiilor este necesara si se poate realiza prin reducerea tensiunii interfaciale si / sau liofilizare. Pentru aceasta se folosesc substante tensioactive numite emulgatori sau emulsori.
Separarea fazelor uei emulsii se numeste ruperea emulsiei sau dezemulsionare si se poate realiza prin:
Sedimentarea prin separarea in timp a fazelor;
Uscarea emulsiei, prin evaporarea unei faze;
Centrifugarea emulsiei;
Folosirea unor substante care reactioneaza cu emulgatorii separandu-i de pe faza dispersata.
Suspensiile de solid in lichid sunt foarte putin stabile intrucat dimensiunile mari ale dispersatului si a diferentei mari intre dispersat si dispersant conduc la sedimentare.
Suspensiile se regasesc in materialele de constructii, in special in procesele de punere in opera a unor lianti (bitumul) si in structura vopselelor si a emailurilor sau in procesul de transport hidraulic.
Suspensii in medii solide
Suspensiile in medii solide se realizeaza prin difuzia dispersatului cand mediul de dispersie este lichid (sau sub forma de topitura) si care se intareste in urma unor procese fizico - chimice sau prin solidificare.
Suspensiile de G-S se realizeaza in scopul obtinerii unor materiale poroase folosite ca materiale de izolatie termica si fonica.
Structura macroporoasa se obtine prin spumare, iar volumul de pori determinat de gazul dispersat comunica cu exteriorul.
Structura celulara formata cu pori care nu comunica cu exteriorul se obtine ca urmare a aglomerarii gazului, sub forma de bule de dimensiuni mici, care nu comunica cu exteriorul si care au rezultat in urma unei reactii chimice.
Suspensiile de G-S rezultate in mod accidental in procesul de obtinere a unor materiale solide compacte (metale, sticla) se numesc sufluri si constituie defecte de structura.
Suspensiile L-S sunt formate prin adsorbtie de faza lichida in structura cu pori deschisi a solidelor.
Suspensiile de S-S se numesc aliaje de amestec si se realizeaza prin cristalizarea impreuna a structurilor din faza lichida prin racire; astfel de sisteme se intalnesc in metale, roci etc.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








