
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Sistemul periodic al elementelor |
Sistemul periodic al elementelor
SISTEMUL PERIODIC AL ELEMENTELOR
LEGEA PERIODICITATII:
o lege fundamentala a naturii, sta la baza clasificarii elementelor o a fost enuntata de D. I. Mendeleev in 1869:
"Proprietatile fizice si chimice ale elementelor se repeta periodic in functie de masele lor atomice"
o i-a permis lui Mendeleev ordonarea celor 63 de elemente cunoscute la aceea vreme, in ordinea crescatoare a maselor lor atomice, intr-un tabel numit sistemul periodic al elementelor. Asezate in linii si coloane, elementele cu proprietati asemanatoare se
gaseau unele sub altele (in aceeasi coloana, adica grupa)
o la inceputul secolului al XX-lea, odata cu marile descoperiri din fizica atomului, legea a fost reformulata de Moseley (1913):
"Proprietatile elementelor sunt functii periodice ale numarului atomic Z"
o i-a permis lui Mendeleev sa deduca existenta unor elemente, necunoscute la acea data, si "sa prevada" descoperirea lor, precum si pozitia lor in sistemul periodic al elementelor. Asezate in locurile libere din tabele, conform legii periodicitatii, aceste elemente au fost denumite cu ajutorul prefixelor "eka" sau"dvi": eka-bor (Sc), eka-
aluminiu(Ga), eka-siliciu (Ge), eka-mangan (Tc), dvimangan (Re)
o Mendeleev sugereaza chiar verificarea maselor atomice ale unor elemente pentru care a observat o inversiune a pozitiei in sistemul periodic:
Te (Ar = 127,6) - perioada a 5-a, grupa VIA (16) si I (Ar = 126,2) - perioada a 5-a, grupa VIIA (17)
alte inversiuni in sistemul periodic:
Co (Ar = 58,9) - perioada a 4-a, grupa VIIIB (9) si Ni (Ar = 58,7) - perioada a 4-a, grupa VIIIB (10) !!!!!
Ar (Ar = 39,9) - perioada a 3-a, grupa VIIIA (18) si K (Ar = 39,1) - perioada a 4-a, grupa IA (1)
o astazi se cunosc peste 400 de variante ale sistemului periodic al elementelor, care au la baza tabelul lui Mendeleev; cea mai cunoscuta si utilizata forma este asa-numita "forma lunga" propusa de Rang in 1893 si ameliorata de Alfred Werner in 1905. Acesta cuprinde 18 coloane verticale si 7 siruri orizontale, fiind o reflectare obiectiva a structurii electronice a elementelor.
GRUPELE SISTEMULUI PERIODIC AL ELEMENTELOR:
o Coloanele verticale, numite grupe sau familii, contin elemente cu proprietati fizice si chimice asemanatoare, care au aceeasi configuratie electronica in stratul de valenta. Ele sunt notate cu cifre arabe de la 1 la 18, conform recomandarilor IUPAC din 1986; pana atunci grupele principale erau notate cu cifre romane de la I la VIII si litera A, iar grupele secundare erau notate cu cifre romane de la I la VIII si litera B. Grupa a-VIII-a B (respectiv grupele 8,9 si 10) contine triada fierului (Fe, Co, Ni) si metalele platinice
(Ru, Rh, Pd, Os, Ir, Pt).
o Numarul grupei in care se gaseste un element este egal cu numarul electronilor din stratul de valenta al atomilor elementului respectiv.
Pentru a afla numarul de electroni din stratul de valenta in cazul elementele grupelor 13 - 18, se scade numarul 10 din numarul grupei; de exemplu fosforul se gaseste in gupa 15 a sistemului periodic, deci are 15-10 = 5 electroni in stratul de valenta, asa cum se observa si din scrierea configuratiei electronice P: 1s 2s 2p 3s 3p
PERIOADELE SISTEMULUI PERIODIC AL ELEMENTELOR:
o Sirurile orizontale ale sistemului periodic, cuprinzand elementele dintre doua gaze rare succesive, se numesc perioade. Sistemul periodic contine 7 perioade corespunzatoare celor 7 nivele energetice notate cu cifre arabe de la 1 la 7. Numarul perioadei in care se afla un element este egal cu numarul de nivele energetice (straturi)
ocupate cu electroni, sau cu valoarea numarului cuantic principal "n" pentru stratul exterior al atomului unui element. primele 3 perioade sunt scurte(2, respectiv 8 si 8 elemente), iar urmatoarele 4 sunt lungi (18, respectiv18 si 32 elemnte). Perioada a saptea este incompleta. Lantanidele (seria 4f) si actinidele (seria 5f) ocupa o pozitie speciala in sistemul periodic, in partea de jos, sub forma a doua siruri a cate 14 elemente.
(Vezi Cursul 2)
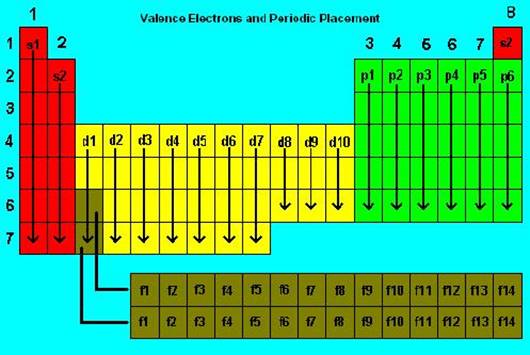
BLOCURI DE ELEMENTE:
Potrivit acestei clasificari se disting 4 blocuri de elemente, apartenenta la acestea fiind determinata de tipul de orbital ocupat de electronul distinctiv in configuratia electronica fundamentala a atomilor:
o Blocul s - elemente cu configuratia stratului de valenta sn (n = 1 sau 2). o Le bloc p - elemente cu configuratia stratului de valenta s2pn (n = 1 à 6). o Le bloc d - elemente cu configuratia stratului de valenta s2d n (n = 1 à 10). o Le bloc f - elemente cu configuratia stratului de valenta s2fn (n = 1 à 14).
NUMARUL ATOMIC Z indica:
o numarul protonilor din nucleul unui atom
o numarul electronilor din invelisul electronic al unui atom
o numarul de ordine (asezarea) elementului in sistemul periodic al elementelor
ORGANIZAREA SISTEMULUI PERIODIC AL ELEMENTELOR SE POATE EXPLICA PE BAZA CUNOASTERII CONFIGURATIILOR ELECTRONICE ALE ATOMILOR ELEMENTELOR:
o fiecare perioada incepe cu un metal alcalin si se termina cu un gaz rar
o repetarea periodica a proprietatilor elementelor este determinata de repetarea dupa un anumit numar de elemente a configuratiei nivelului electronic exterior.
o Proprietatile chimice ale elementelor sunt influentate in principal de structura electronica a nivelului exterior "n", sunt influen tate mai putin de configuratia electronica a penultimului strat electronic "n-1" si sunt influen tate foarte putin de configuratia electronica a antepenultimului strat "n-2". Asa se explica de ce
elementele dintr-o grupa au proprietati asemanatoare (avand configuratii electronice identice in nivelurile externe), iar elementele dintr-o perioada proprietati diferite (configuratii electronice diferite in nivelele electronice exterioare). Proprietatilor elementelor dintr-o perioada scurt a sunt mult mai diferite (variatia lor este "brusca" la cresterea lui Z) decat propriet atile elementelor dintr-o perioada lung a (variatia lor este "treptata", mai lenta odat a cu cresterea lui Z). Astfel, lantanidele au proprietati foarte asemanatoare, electronul distinctiv fiind intr-un orbital 4f, configuratia electronica a nivelelor externe este aceeasi: 6s 5d
PROPRIETATILE FIZICE SI CHIMICE ALE ELEMENTELORSE CLASIFICA in:
o neperiodice, care sunt determinate de nucleul atomic:
numarul atomic Z, cu valori de la 1 la 109
masa atomica, cu valori cuprinse intre 1,008 (H) si 262 ( Hs = hassiu)
spectre de raze X
o periodice, care sunt determinate de invelisul electronic:
o proprietati fizice:
raza atomica
raza ionica
energie de ionizare
afinitate pentru electroni o proprietati chimice:
caracter electropozitiv (metalic)
caracter electronegativ (nemetalic)
valenta, numar de oxidare N.O.
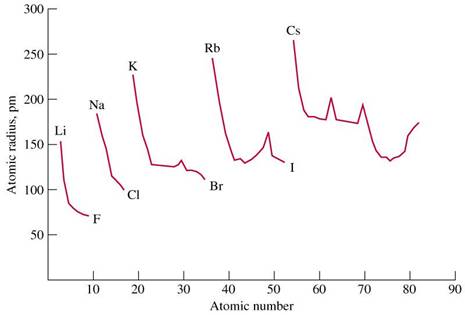
RAZA ATOMICA:
este jumatatea distantei dintre nucleele a doi atomi identici, vecini, dintr-o molecula (homonucleara, deci este practic raza covalenta) sau dintr-un cristal metalic
este o marime caracteristica fiecarui atom, determinata prin metode cristalografice (difractie cu raze X), pe baza structurilor cristaline ale combinatiilor in care se gasesc atomii respectivi (compusi care contin in nodurile retelelor cristaline atomi, nu ioni sau molecule)
intr-o perioada, metalele alcaline au cele mai mari raze atomice, fiind urmate de metalele alcalino-pamantoase si de gazele rare; metalele tranzitionale din mijlocul fiecarei serii au cele mai mici raze atomice dintre elementele unei perioade; in general, se poate spune ca:
o in cadrul unei perioade, in grupele principale, razele atomice scad cu cresterea numarului de ordine Z
o in cadrul unei perioade, in blocul elementelor "d" se constata o scadere a razelor atomice de la grupa a 3-a pana la grupele 8-10, apoi o usoara crestere la elementele grupelor 11 si12
o in cadrul unei perioade, in blocul elementelor "f" se constata o scadere usoara a razelor atomice cu cresterea numarului atomic Z, deci se observa "contractia lantanidelor"
in grupele principale ale sistemului periodic, razele atomice cresc in general semnificativ cu cresterea numarului atomic Z; in grupele secundare, razele atomice


cresc us or cu cresterea numarului atomic Z, existand o diferenta mica intre razele atomice ale elementelor din seriile 4d (perioada a 5-a) si 5d (perioada a 6-a)
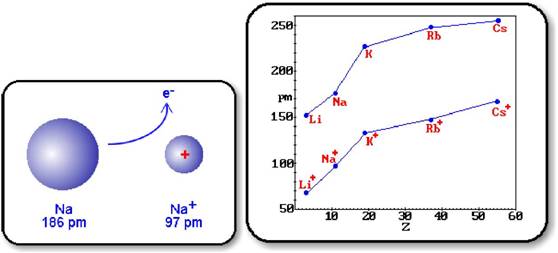
RAZA IONICA:
este raza cationului, respectiv a anionului in compusii ionici cristalini; este dimensiunea relativa a unui ion intr-un cristal ionic
raza cationului este totdeauna mai mica decat raza atomului din care provine (pierzand electroni, un atom se transforma intr-un cation cu aceeasi sarcina nucleara ca a atomului, care atrage un numar mai mic de electroni, ceea ce are ca rezultat scaderea razei)
raza anionului este intotdeauna mai mare decat raza atomului din care provine (acceptand electroni, un atom se transforma intr-un anion cu aceeasi sarcina nucleara ca a atomului, care atrage un numar mai mare de electroni, intre care se manifesta si respingerile electrostatice, fapt ce determina extinderea norului electronic si deci cresterea razei)
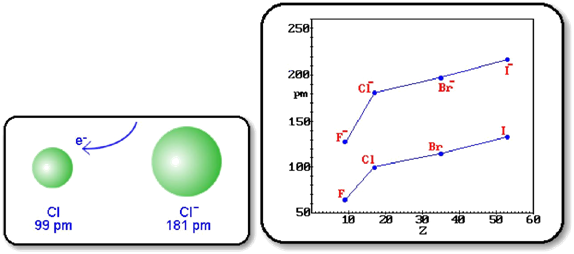
marimea razelor ionice variaza asemanator cu marimea razelor atomice
ionii izoelectronici sunt ioni cu configuratia electronica identica
in cadrul unei perioade, pentru ionii izoelectronici, atat pentru anioni, cat si pentru cationi, se constata scaderea razei ionice cu cresterea numarului atomic Z (adica a
|
sarcinii nucleare): |
|
|
|
Na |
Mg |
Al |
|
11p |
12p |
13p |
|
10e |
10e |
10e |
![]()
scade raza cationului cu cresterea lui Z
|
P |
S |
Cl |
|
15p |
16p |
17p |
|
18e |
18e |
18e |
![]()
scade raza anionului cu cresterea lui Z
in grupa, razele ionilor cu aceeasi sarcina cresc cu cresterea numarului atomic Z
pentru acelasi element raza cationului scade cu cresterea sarcinii cationului:
raza cationului Fe este mai mare decat raza cationului Fe
DENSITATEA:
masa unitatii de volum, este exprimata in gram/cm
in grupe se constata cresterea densitatilor elementelor odata cu cresterea numarului atomic Z
in perioade se constata cresterea densitatilor elementelor de la extremitati spre centru
dintre nemetale, cel mai usor element (densitatea cea mai mica) este hidrogenul, urmat fiind de heliu; cele mai grele nemetale (densitatile cele mai mari) sunt carbonul si iodul
dintre metale, cel mai usor este litiul (in general metalele alcaline au densitate mica, subunitara); cele mai grele metale sunt iridiul si osmiul
TEMPERATURA DE TOPIRE (punctul de topire):
temperatura la care o substanta solida trece in stare lichida la presiunea de 760 mm Hg (temperatura normala de topire)
in grupele principale se constata o scadere a punctelor de topire cu cresterea numarului atomic Z, in timp ce in grupele secundare se constata o crestere a punctelor de topire cu cresterea numarului atomic Z
o cele mai mici puncte de topire le au heliu (-272,1sC) si hidrogenul (-259,23sC) o cele mai mari puncte de topire le au carbonul (forma alotropica diamant
3500sC) si wolframul (3410sC)
o singurele elemente lichide sunt bromul (-7,25sC) si mercurul (-38,84sC)
o elemente usor fuzibile (topesc la temperaturi joase) sunt: cesiul, galiul, rubidiul, fosforul alb, potasiul, sodiul, sulful
o elemente greu fuzibile (topesc la temperaturi inalte) sunt: reniul, osmiul, molibdenul, borul.
TEMPERATURA DE FIERBERE (punctul de fierbere):
temperatura la care presiunea vaporilor unui lichid devine egala cu presiunea de 760 mm Hg (temperatura normala de fierbere)
valorile variaza asemanator cu punctele de topire
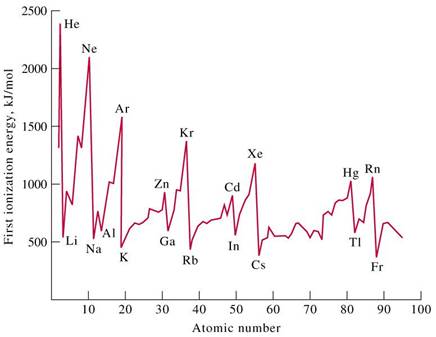
ENERGIA DE IONIZARE (POTENTIAL DE IONIZARE):
energia consumata la indepartarea unuia sau mai multor electroni dintr-un atom izolat in stare gazoasa sau energia absorbita la formarea unui ion pozitiv din atomul liber; se masoara in electronvolti (eV)
energia primara de ionizare (EI ) este energia consumata la smulgerea primului electron din configuratia electronica a atomului neutru; energia secundara de ionizare (EI ) este energia consumata la smulgerea celui de al doilea electron din configuratia electronica a ionului cu sarcina 1+; energia tertiara de ionizare este energia de ionizare pentru al 3-lea electron (EI ); valoarea energiei de ionizare creste brusc dupa prima treapta de ionizare: EI < EI < EI pentru ca al doilea, al treilea electron vor fi eliminati din ioni pozitivi, in care atractia electrostatica a sarcinii nucleare asupra fiecarui electron este mai mare
in perioada, energia primara de ionizare creste de la grupa 1 la grupa 18, deci odata cu cresterea numarului atomic Z; elementele care au in stratul exterior configuratii electronice stabile au energii de ionizare mai mari:
o elementele grupei 2 - configuratia electronica in stratul exterior ns
o elementele grupei 15 - configuratia electronica in stratul exterior ns np (substrat "p" semiocupat cu electroni)
o elementele grupei 12 - configuratia electronica in stratul exterior ns (n-1)d
in grupe, energia primara de ionizare scade cu cresterea numarului atomic Z, deci o data cu cresterea numarului de straturi ocupate cu electroni si cu micsorarea atractiei electrostatice a nucleului asupra electronilor din stratul exterior ca urmare a departarii de nucleu.
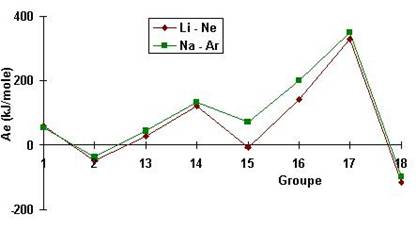
AFINITATEA PENTRU ELECTRONI:
energia degajata (sau consumata!) de un atom izolat in faza gazoasa care accepta un electron si se transforma intr-un ion negativ, un anion; acceptarea a doi sau mai multi electroni in configuratia unui atom se face cu consum de energie;
se masoara in joules/atom, kilojoules/mol sau electronvolti
valoarea negativa reprezinta energia realizata, eliberata de un atom la acceptarea unui electron; cu cat aceasta valoare este mai negativa, cu atat atomul are tendinta mai mare de accepta un electron
in perioada, afinitatea pentru electron creste, este din ce in ce mai negativa, pe masura ce creste numarul atomic Z (exceptie fac elementele grupei 2 si 18)
in grupe, afinitatea pentru electron scade cu cresterea numarului atomic Z, deoarece electronul se adauga pe un nivel a carui distanta de la nucleu creste odata cu numarul de straturi
CARACTERUL ELECTROPOZITIV:
proprietatea atomilor de a ceda electroni si de a forma ioni pozitivi
creste odata cu cresterea caracterului metalic si cu scaderea energiei de ionizare, adica: o in grupele principale creste de sus in jos odata cu cresterea numarului atomic
Z, deci cu cresterea numarului de straturi ocupate cu electroni
o in perioade scade de la grupa 1 la grupa 14, odata cu cresterea numarului atomic Z si cu cresterea numarului de electroni cedati
metalele sunt ordonate in sensul descrescator al caracterului electropozitiv in seria activitatii metalelor (seria Beketov-Volta, seria tensiunilor chimice), in care tendinta atomilor metalici de a ceda electroni este comparata cu tendinta atomului de hidrogen de ceda electroni:
K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Bi Sb Hg Ag Pt Au
→→scade caracterul electropozitiv al elementelor→→→
→→scade reactivitatea chimicaa elementelor→→→
→→scade caracterul reducator→→→
cu cat caracterul electropozitiv al unui element este mai accentuat, cu atat reactivitate chimica a elementului respectiv este mai mare:
o variatia caracterului electropozitiv ↔ variatia caracterului metalic ↔ variatia reactivitatii in grupa - ex. - reactia metalelor alcaline cu apa:
2Na + 2H-OH → 2NaOH + H 2K + 2H-OH → 2KOH + H
Metalele grupei 1, metalele alcaline, reactioneaza foarte usor, chiar violent, cu oxigenul si cu apa, astfel incat este necesara pastrarea lor sub petrol
![]()
Reactia sodiul cu apa este violenta, caldura degajata in urma reactiei putand topi metalul nereactionat; potasiul reactioneaza cu apa si mai energic decat sodiul, caldura degajata aprinzand instantaneu hidrogenul degajat din reactie, ceea ce poate provoca chiar explozii
o variatia caracterului electropozitiv ↔ variatia caracterului metalic ↔ variatia reactivitatii in perioada - ex. - reactia metalelor din perioada a 3-a cu apa:
|
2Na + 2H-OH → 2NaOH + H → reactie violenta la temperatura camerei Mg + 2H-OH → Mg(OH) + H → reactia decurge la usoara incalzire 2Al + 6H-OH → 2Al(OH) + 3H → reactia decurge la incalzire puternica
o variatia caracterului electropozitiv ↔ variatia caracterului metalic ↔ variatia tariei bazelor (hidroxizilor metalici) in grupa si in perioada:
perioada a 3-a:
|
NaOH |
Mg(OH) |
Al(OH) |
|
baza tare |
baza tarie medie |
baza cu caracter amfoter |
![]()
→ → → scade taria bazelor → → →
grupa a 2-a:
|
Be(OH) |
Mg(OH) |
Ca(OH) |
Sr(OH) |
Ba(OH) |
|
baza cu |
baza de |
baza |
baza |
baza |
|
caracter |
tarie medie |
tare |
tare |
tare |
|
amfoter |
|
|
|
|
|
|
→ → creste taria bazelor → |
|
|
|
![]() cel
mai electropozitiv element din sistemul periodic este franciul, Fr, dar pentru
ca este element radioactiv este considerat CESIUL, Cs.
cel
mai electropozitiv element din sistemul periodic este franciul, Fr, dar pentru
ca este element radioactiv este considerat CESIUL, Cs.
CARACTERUL ELECTRONEGATIV:
proprietate atomilor elementelor de a capta electroni si de a forma ioni negativi; elementele au un caracter electronegativ cu atat mai accentuat cu cat accepta un numar mai mic de electroni si pe un strat mai apropiat de nucleu, unde forta de atractie e mai mare; sunt nemetale, deci isi manifesta caracterul nemetalic
in grupe, scade de sus in jos, odata cu cresterea numarului atomic Z, deci cu cresterea numarului de straturi ocupate cu electroni
in perioade, creste de la grupa 14 la grupa 17, odata cu cresterea numarului atomic Z, adica cu micsorarea numarului de electroni captati si cresterea sarcinii nucleare
FLUORUL, F este elementul cel mai electronegativ din sistemul periodic
variatia caracterului electronegativ al elementelor in grupe si in perioade influenteaza caracterul acido-bazic al compusilor binari cu hidrogenul, HnE, ai elementelor:
o in perioada, caracterul acid al HnE creste cu cresterea caracterului electronegativ al elementului E:
|
NH |
H O |
HF |
|
baza slaba |
amfolit acido-bazic |
acid de tarie medie |
|
H S |
HCl |
|
|
acid slab |
acid tare |
|
![]()
→ creste caracterul acid cu cresterea caracterului electronegativ al elementului →
o in grupa, caracterul acid al HnE scade cu cresterea caracterului electronegativ
al elementului:
HF HCl HBr HI
acid de tarie medie acid tare acid tare acid tare
![]()
→ creste caracterul acid cu scaderea caracterului electronegativ al elementului →
variatia caracterului electronegativ al elementelor in grupe si in perioade influenteaza taria oxoacizilor elementelor:
o in perioada, pentru oxoacizii cu elementul central la stare de oxidare maxima, taria oxoacizilor creste cu cresterea caracterului electronegativ al elementului:
|
H SiO |
H PO |
H SO |
HClO |
|
acid slab |
acid tarie medie |
acid tare |
acid foarte tare |
![]()
→ creste caracterul acid cu cresterea caracterului electronegativ al elementului →
o in grupa, pentru oxoacizii cu elementul central la aceeasi stare de oxidare (de obicei stare de oxidare maxima), taria oxoacizilor scade cu scaderea caracterului electronegativ al elementului:
|
HNO |
H PO |
H AsO |
H[Sb(OH) |
|
acid tare |
acid tarie medie |
acid slab |
acid foarte slab |
![]()
→ scade caracterul acid cu scaderea caracterului electronegativ al elementului →
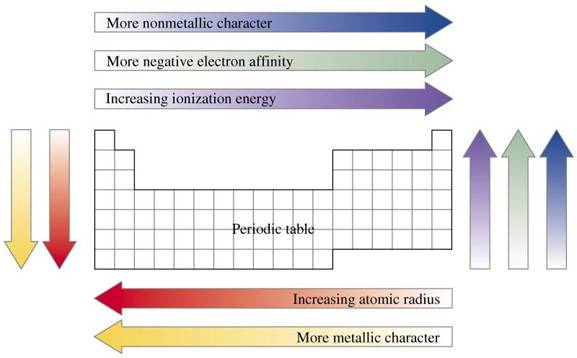
Proprietati periodice ale elementelor - variatia in grupe si in perioade
10. VALENTA, NUMAR DE OXIDARE:
Notiunea de numar de oxidare inlocuieste conceptul de valenta, desemnand numarul de sarcini pozitive sau negative care se pot atribui unui atom dintr-o combinatie, in functie de sarcinile electrice reale sau formale ale celorlalti atomi cu care este combinat.
Numarul de oxidare al elementelor in combinatie cu alte elemente mai electronegative decat ele prezinta valori pozitive, deoarece pot ceda acestora, total sau partial, electronii lor de valenta
Numarul maxim de oxidare pozitiv al unui element este egal cu numarul grupei sistemului periodic din care face parte elementul respectiv. Exista unele exceptii de la regula numarului de oxidare pozitiv maxim pentru elementele din perioada a 2-a precum si pentru elementele tranzitionale din grupele VIIIB (8,9,10) si IB (11)
In combinatiile cu alte elemente, mai electropozitive decat ele, elementele prezinta un singur numar de oxidare negativ egal cu (8-n) in care n este numarul grupei din care face parte elementul respectiv
In stabilirea numarului de oxidare al unui atom, trebuie sa se tina seama de urmatoarele reguli:
o fluorul are in toate combinatiile sale numarul de oxidare -1
o oxigenul are in aproape toti compusii numarul de oxidare -2, cu exceptia oxizilor de fluor in care oxigenul are N.O. = +2 si a combinatiilor peroxidice unde are N.O. = -1
o metalele, cu putine exceptii, au in combinatiile lor numere de oxidare pozitive; metalele alcaline au constant N.O. = +1, iar metalele alcalino-pamantoase au N.O. = +2
o substantele elementare au N.O. = 0
o suma sarcinilor pozitive si negative ale elementelor dintr-o combinatie neutra din punct de vedere electric este egala cu zero
GRUPELE DE ELEMENTE SI PRINCIPALELE LOR NUMERE DE OXIDARE, IN
FUNCTIE DE CONFIGURAT IA LOR ELECTRONICA: Grupa IA = 1 - metale alcaline: (H) Li, Na ,K, Rb, Cs, Fr (str.int. + ns
s ----> s N.O.= +1 Exemple: NaCl Hidrogenul prezinta un caz particular:
|
s |
|
s |
N.O.= +1 |
Exemplu: HCl |
|
s |
|
s |
N.O.= -1 |
Exemplu: NaH |
Grupa IIA = 2 - metalele alcalino-pamantoase: Be,Mg,Ca,Sr,Ba,Ra (str.int. +ns
|
s |
s |
N.O.= +2 |
Exemplu: MgCl2 |
|
Grupa IIIA = 13: B, Al, Ga, In, Tl (str.int. +ns np |
|
||
|
s p |
s p |
N.O.= +3 |
Exemple: Al2O3, TlCl3 |
|
s p |
s p |
N.O.= +1 |
Exemplu: TlCl |
|
Grupa IVA = 14 - grupa carbonului C, Si, Ge, Sn, Pb (str.int. +ns np |
|||
|
s p |
s p |
N.O.= +4 |
Exemple: CO2,PbO2 |
|
s p |
s p |
N.O.= +2 |
Exemple: CO, PbO |
|
s p |
s p |
N.O.= -4 |
Exemplu: CH4 |
|
Grupa VA = 15 - grupa azotului N, P, As, Sb, Bi (str.int. +ns np |
|||
|
s p |
s p |
N.O.= -3 |
Exemplu: NH3 |
|
s p |
s p |
N.O.= +3 |
Exemplu: HNO2 |
|
s p |
s0p0 |
N.O.= +5 |
Exemplu: HNO3 |
Grupa VIA = 16 - grupa oxigenului (calcogenii) O, S, Se, Te, Po (str.int. +ns np
|
s p |
|
s p |
N.O.= -2 |
Exemplu: H2O |
|
s p |
|
s p |
N.O.= +4 |
Exemplu: H2SO3 |
|
s p |
---->s p |
N.O.= +6 |
Exemplu: H2SO4 |
|
Grupa VIIA = 17 -halogeni: F, Cl, Br, I, At (str.int. +ns np
|
s p |
s p |
N.O.= -1 |
Exemplu: HCl |
|
s p |
s p |
N.O.= +5 |
Exemplu: HClO3 |
|
|
|
s p |
s p s p N.O.= +7 Exemplu: HClO4
Grupa VIIIA = 18 -gaze nobile, inerte, rare: He,Ne,Ar,Kr,Xe,Rn (str.int. +ns np
N.O.= 0 Exemple: Ne, Ar
Cele 3 serii complete, a cate 10 elementele tranzitionale cu orbitali d in curs de ocupare (blocul de elemente d) sunt urmatoarele:
|
21Sc |
22Ti |
23V |
24Cr |
25Mn |
26Fe |
27Co |
28Ni |
29Cu |
30Zn |
|
39Y |
40Zr |
41Nb |
42Mo |
43Tc |
44Ru |
45Rh |
46Pd |
47Ag |
48Cd |
|
57La |
72Hf |
73Ta |
74W |
75Re |
76Os |
77Ir |
78Pt |
79Au |
80Hg |
Prima serie de elemente are in curs de ocupare seria 3d, a doua serie are in curs de ocupare seria 4d si a treia serie de elemente are in curs de ocupare seria 5d.
SERIA "3d" DE ELEMENTE SI PRINCIPALELE LOR NUMERE DE OXIDARE, IN FUNCTIE DE CONFIGURATIA LOR ELECTRONICA:
IIIB = 3 21Sc Ar 4s 3d
IVB = 4 22Ti Ar 4s 3d
V B = 5 23V Ar 4s 3d
VIB = 6 24Cr Ar 4s 3d
VIIB = 7 25Mn Ar 4s 3d
VIIIB (8) 26Fe Ar 4s 3d
27Co Ar 4s 3d
28Ni Ar 4s d
IB = 11 29Cu Ar 4s 3d
IIB = 12 30Zn Ar 4s 3d
|
s d --->s p |
Eox: +3 |
Exemplu: ScCl3 |
|
s d --->s d |
Eox: +4 |
Exemplu: TiCl4 |
|
s d --->s d |
Eox: +5 |
Exemplu: V2O5 |
|
s d --->s d |
Eox: +6 |
Exemplu: H2CrO4 |
|
s d --->s d |
Eox: +7 |
Exemplu: KMnO4 |
|
s d --->s d |
Eox: +2 |
Exemplu: MnSO4 |
|
s d --->s d |
Eox: +2 |
Exemplu: FeCl2 |
|
s d --->s d |
Eox: +3 |
Exemplu: FeCl3 |
|
s d --->s d |
Eox: +2 |
Exemplu: CoCl2 |
|
s d --->s d |
Eox: +2 |
Exemplu: NiCl2 |
|
s d --->s d Eox: +1 |
Exemplu: Cu2O |
|
|
s d --->s d |
Eox: +2 |
Exemplu: CuSO4 |
|
s d --->s d Eox: +2 |
Exemplu: ZnCl2 |
|
Se remarca analogii intre starea de oxidare cea mai mare a elementelor grupelor principale si a metalelor tranzitionale de tip 'd' din aceeasi grupa:
|
Li |
Be |
B |
C |
N |
S |
Cl |
|
Cu |
Zn |
Sc |
Ti |
V |
Cr |
Mn |
In perioada a sasea, cele 14 lantanide ocupa progresiv orbitalii 4f si in perioada a saptea actinidele obtinute prin metode nucleare.
|
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
Ce |
Ce |
Ce |
Ce |
Ce |
Ce |
Ce |
Ce |
Ce |
Ce |
Ce |
Ce |
Ce |
Ce |
Structura electronica complexa a acestor elemente nu permite justificarea mai simpla a starii de oxidare.
Starea de oxidare cea mai frecvent intalnita este +3. La ceriu +4. Principala stare de oxidare a uraniului este +6.
Primele 92 elemente din sistemul periodic cu stari de oxidare comune si stari de oxidare mai putin caracteristice (instabile)
|
Numar |
|
Element |
|
Simbol |
Numere de oxidare |
|
|
Atomic Z |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hidrogen |
|
H |
|
|
|
|
|
Heliu |
|
He |
|
|
|
|
|
Litiu |
|
Li |
|
|
|
|
|
Beriliu |
|
Be |
|
|
|
|
|
Bor |
|
B |
|
|
|
|
|
Carbon |
|
C |
|
|
|
|
|
Azot |
|
N |
|
|
|
|
|
Oxigen |
|
O |
|
|
|
|
|
Fluor |
|
F |
|
|
|
|
|
Neon |
|
Ne |
|
|
|
|
|
Sodiu |
|
Na |
|
|
|
|
|
Magneziu |
|
Mg |
|
|
|
|
|
Aluminiu |
|
Al |
|
|
|
|
|
Siliciu |
|
Si |
|
|
|
|
|
Fosfor |
|
P |
|
|
|
|
|
Sulf |
|
S |
|
|
|
|
|
Clor |
|
Cl |
|
|
|
|
|
Argon |
|
Ar |
|
|
|
|
|
Potasiu |
|
K |
|
|
|
|
|
Calciu |
|
Ca |
|
|
|
|
|
Scandiu |
|
Sc |
|
|
|
|
|
Titan |
|
Ti |
|
|
|
|
|
Vanadiu |
|
V |
|
|
|
|
|
Crom |
|
Cr |
|
|
|
|
|
Mangan |
|
Mn |
|
|
|
|
|
Fier |
|
Fe |
|
|
|
|
|
Cobalt |
|
Co |
|
|
|
|
|
Nichel |
|
Ni |
|
|
|
|
|
Cupru |
|
Cu |
|
|
|
|
|
Zinc |
|
Zn |
|
|
|
|
|
Galiu |
|
Ga |
|
|
|
|
|
Germaniu |
|
Ge |
|
|
|
|
|
Arsen |
|
As |
|
|
|
|
|
Seleniu |
|
Se |
|
|
|
|
Brom |
Br |
|
|
|
Kripton |
Kr |
|
|
|
Rubidiu |
Rb |
|
|
|
Strontiu |
Sr |
|
|
|
Ytrium |
Y |
|
|
|
Zirconiu |
Zr |
|
|
|
Niobiu |
Nb |
|
|
|
Molibden |
Mo |
|
|
|
Tehnetiu |
Tc |
|
|
|
Ruteniu |
Ru |
|
|
|
Rodiu |
Rh |
|
|
|
Paladiu |
Pd |
|
|
|
Argint |
Ag |
|
|
|
Cadmiu |
Cd |
|
|
|
Indiu |
In |
|
|
|
Staniu |
Sn |
|
|
|
Stibiu |
Sb |
|
|
|
Tellure |
Te |
|
|
|
Iod |
I |
|
|
|
Xenon |
Xe |
|
|
|
Cesiu |
Cs |
|
|
|
Bariu |
Ba |
|
|
|
Lantan |
La |
|
|
|
Ceriu |
Ce |
|
|
|
Praseodim |
Pr |
|
|
|
Neodim |
Nd |
|
|
|
Prometiu |
Pm |
|
|
|
Samariu |
Sm |
|
|
|
Europiu |
Eu |
|
|
|
Gadoliniu |
Gd |
|
|
|
Terbiu |
Tb |
|
|
|
Disprosiu |
Dy |
|
|
|
Holmiu |
Ho |
|
|
|
Erbiu |
Er |
|
|
|
Tuliu |
Tm |
|
|
|
Yterbiu |
Yb |
|
|
|
Lutetiu |
Lu |
|
|
|
Hafniu |
Hf |
|
|
|
Tantal |
Ta |
|
|
|
Wolfram |
W |
|
|
|
Rheniu |
Re |
|
|
|
Osmium |
Os |
|
|
|
Iridiu |
Ir |
|
|
|
Platina |
Pt |
|
|
|
Au |
Au |
|
|
|
Mercur |
Hg |
|
|
|
Talliu |
Tl |
|
|
|
Plumb |
Pb |
|
|
|
Bismut |
Bi |
|
|
|
Poloniu |
Po |
|
|
|
Astatin |
At |
|
|
|
Radon |
Rn |
|
|
|
Franciu |
Fr |
|
|
|
Radiu |
Ra |
|
|
|
Actiniu |
Ac |
|
|
|
Toriu |
Th |
|
|
|
Protactiniu |
Pa |
|
|
|
Uraniu |
U |
|
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Analize pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








