
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Azotul - procese naturale de transformare a azotului, ciclul azotului |
Azotul - procese naturale de transformare a azotului, ciclul azotului
Azotul
Azotul sub forma de N2 reprezinta 78% din volumul atmosferei Pamantului. Comparativ cu oxigenul azotul are o reactivitate chimica scazuta si nu este direct utilizat de majoritatea organismelor vii.
Azotul este un element cu reactivitate scazuta. Molecula de azot este constituita din 2 atomi legati printr-o tripla legatura N≡N, a carei scindare necesita o cantitate mare de energie. Drept consecinta azotul este utilizat la cresterea plantelor sub forma de fertilizator.
Azotul este un constituent al emanatiilor vulcanice. Prezinta o importanta deosebita in procesele biologice. Ciclul azotului este dominat de reactiile implicate in materia biologica. Reactiile in serie sunt:
O2
N2 +H2 NH3 NO2- NO3- aminoacizi proteine N2
amoniac ion nitrit ion nitrat
Cantitati mici de azot exista in compusii organici din sedimente si roci sedimentare. Cea mai comuna forma a azotului in organisme este grupul amino-NH2, care este un component al aminoacizilor. Grupul amino de sine statator este de forma amoniacului NH3 sau ionul amoniu NH4+. Lipsind legaturile cu oxigenul, azotul sub forma de NH3 sau ion amoniu NH4+, este in starea cea mai inalta de reducere. Starile de oxidare ale azotului apar in ionul nitrat (NO3)-, si ionul nitrit (NO2)-. Azotul anorganic in sol sau dizolvat in apa este de obicei prezent sub aceste doua forme. Cea mai scazuta stare de oxidare este caracteristica oxidului nitros (N2O) care este produs de un numar mic de organisme. Pentru pamant ca si intreg, cea mai mare cantitate de azot este ca si azot molecular N2, care constituie peste 78% din volumul aerului. Azotul molecular este considerat neutru, avand o reactivitate chimica scazuta, nefiind utilizat direct de catre organismele vii. In asociatie cu azotul molecular, gazele, bioxidul de azot (NO2) si oxidul nitric (NO) sunt prezente in atmosfera in cantitati mici si sunt produsi poluanti rezultati prin activitatea omului. In ordine de la cele mai oxidate la cele mai reduse, formele comune ale azotului sunt: ionul nitrat (NO3)-, bioxidul de azot (NO2), ionul nitrit (NO2)-, oxidul nitric (NO), oxidul nitros, (N2O), azotul molecular (N2) si amoniacul (NH3).
|
Numar de oxidare |
|
Exemple |
|
-3 |
|
NH3, NH4+, NH2-, Mg3N2 |
|
-2 |
|
N2H4 |
|
-1 |
|
NH2OH |
|
-1/3 |
|
NaN3, HN3 |
|
0 |
|
N2 |
|
+1 |
|
N2O |
|
+2 |
|
NO, N2O2 |
|
+3 |
|
HNO2, NO2-, N2O3, NO+ |
|
+4 |
|
NO2, N2O4 |
|
+5 |
|
HNO3, NO3-, N2O5 |
1. Procese naturale de transformare a azotului
|
Trecerea azotului dintr-o forma in alta se realizeaza prin procese biochimice (reducere, asimilare, fixare, denitrificare, oxidare, nitrificare, amonificare).
1) reactii de reducere care implica pierderea oxigenului si aditia hidrogenului la azot.
a) - Asimilarea azotului
Asimilarea azotului este reducerea ionului nitrat sau nitrit la amoniac. Amoniacul atmosferic poate fi asimilat direct de catre plante dar cea mai mare cantitate de azot in medie este in sol ca si ion nitrat sau nitrit. Plantele si bacteriile din sol au mecanisme de asimilare a azotului si transforma nitratii si nitritii in amoniac. Animalele superioare cu aceeasi abilitate de a utiliza nitratii si nitritii, trebuie sa primeasca azot ca si grup amino in aminoacizi.
NO3- sau NO2- NH3
ion nitrat ion nitrit amoniac
Aceasta reactie este produsa de microorganisme (de plante si bacterii din sol) si necesita consum de energie.
b) - Fixarea azotului
Fixarea azotului transforma azotul molecular inert din atmosfera in amoniac.
N2+H2 NH3 sau NH4-
azot hidrogen amoniac ion
molecular molecular amoniu
Reactia b) este produsa de organisme fixatoare de azot.
c) - Dinitrificarea
NO3- sau NO2- N2 sau N2O
ion nitrat ion azot oxid nitros
nitrit molecular
(reactie produsa de bacterii anaerobe din sol)
Denitrificarea este denumirea procesului biologic care transforma nitratii si nitritii in azot molecular sau in oxizi nitrosi. Pentru ca ambele forme sunt gaze stabile ele parasesc solul si intra in atmosfera si sunt eliberate cel putin temporal, in biosfera. Denitrificarea apare numai in conditii anaerobe si este produsa de variate bacterii din sol. Ca rezultat denitrificarea este restransa la mediu anaerobic. In conditii anaerobe organismele pot utiliza nitratii ca inlocuitori ai oxigenului, ca si acceptori de electroni, ca si sursa pentru energia respiratorie:
5CH2O+4NO3-+4H+ →2N2++5CO2+7H2O
Cantitati semnificative ale procesului de denitrificare, apar in solurile permanent saturate unde bacteriile aerobe consuma putin oxigen dizolvat in apa din sol, producand un mediu anaerobic.
Reactia b si c actioneaza impreuna ca si control al cantitatii de azot mediu al organismelor vii. Din reactia (c) azotul poate fi incorporat in aminoacizi sau alte componente biochimice, compusi care pot fi ciclati sau reciclati prin ecosistem. Numai microorganismele poseda aceasta capacitate de fixare a azotului, unele sunt fixatoare libere de azot. Alte bacterii fixeaza azotul prin relatie simbiotica cu plantele superioare.
d) - Amonificarea
Amonificarea este reactia biochimica in care aminoacizii sunt descompusi cu eliberare de energie cu formarea amoniacului sau a ionilor de amoniu.
CH2
![]()
![]()
COOH NH2 + O2 CO2 + H2O + NH3
(amino acid)
(reactia este realizata prin descompunere bacteriana)
(NH2)2CO+H2O NH3+CO2
(ureea)
2) Reactii de oxidare
Nitrificarea este procesul biologic in care amoniacul este oxidat la nitrat. Reactia este realizata in doua etape, fiecare de catre grupe diferite de bacterii. Grupul Nitrosomona provoaca reactia amoniacului sau a ionului de amoniu cu oxigenul cu formarea ionului nitrit si a apei. Grupul Nitrobacter oxideaza ionul nitrit la ion nitrat. Ambele grupe utilizeaza amoniacul sau nitritul ca si sursa de energie.
NH3 sau 4NH4+ + 6O2 4NO2- + 8H++H2O
ion nitrit
(reactie produsa de Nitrosomona).
4NO2- +2O2 4NO3-
ion nitrit ion nitrat (reactie produsa de Nitrobacter).
Nitratul este foarte solubil in apa si usor de levigat din sol, astfel formarea rezervelor de nitrati in sol nu este posibil.
2. Ciclul azotului
Transformarea azotului in proteine furnizeaza energie, organismelor cu molecule capabile sa aiba anumite functii in structura, enzime, hormoni. In ciclul biogeochimic al azotului este implicata distrugerea proteinelor si subsecvent reactia de inlocuire a azotului original. Miscarea azotului implica: a). schimbari in starea de oxidare; b). schimbari in energie; c). reactii cu alte elemente (oxigen, hidrogen, si carbon). Procesul major biologic cu eliberare de electroni este oxidarea carbohidratilor cu formarea bioxidului de carbon:
CH2O+H2O CO2+4H++4e-
Fixarea azotului necesita o sursa de electroni care sa determine reducerea azotului N0 la N3-:
N2+8H++6e- 2NH3+
Speciile chimice ale azotului rezultate prin procese biochimice, ilustrand schimbarile in starea de oxidare si stabilitatea relativa sunt prezentate in, (Fig. 6.5).
Reactiile scrise mai sus sintetizeaza capacitatea activa si acumularea pentru azot in stratul viu. In cadrul acumularilor active azotul exista in doua forme:
1) azot anorganic (nitrat si nitrit);
2) azot organic (aminoacizi si alti compusi organici continand azot).
Cel mai activ azot este cel din materia organica descompusa. Masa totala a materiei vii contine peste 1% azot. Azotul anorganic in soluri si sedimente marine este o fractiune (o septime) din cantitatea materiei organice descompuse.
Formele de prezentare ale azotului sunt: - azot molecular (N2) relativ inert; - azot in mineralele din roci. Dintre cele doua forme azotul din minerale si roci, stocat in crusta este in cantitate mai mare decat cel din atmosfera. Trei procese de fixare a azotului sunt importante: fixarea biologica, fixarea industriala si fixarea atmosferica, (Fig. 6.6). Dintre acestea fixarea biologica este cea mai mare. Fixarea industriala include producerea azotului fertilizator si oxidarea azotului in timpul arderii combustibililor fosili. Ingrasamantul cu azot este fabricat utilizand procesul Haber in care N2 si H2 sunt combinate catalitic la temperaturi apropiate de 5000C si presiuni apropiate de 200 atmosfere pentru fabricarea amoniacului. Amoniacul poate fi oxidat la acid azotic (HNO3) care reactioneaza mai mult cu nitratul de amoniu, o forma comuna de azot fertilizator. Amoniacul poate reactiona cu CO2 pentru producerea ureei (NH2-CO-NH2) care este un alt fertilizator utilizat.
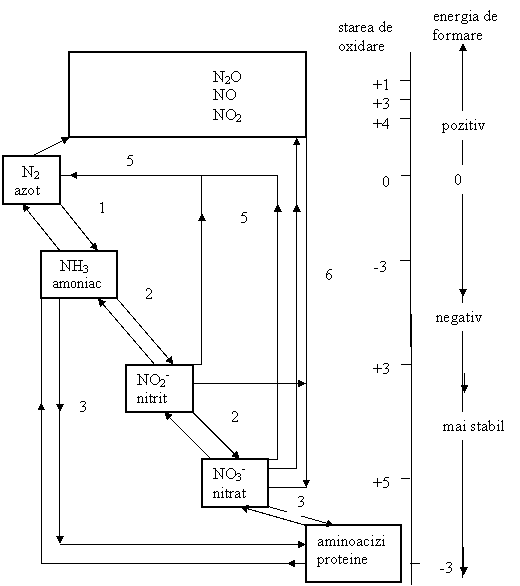
Fig.6.5 Speciile chimice din ciclul azotului,
1.-fixare; 2.-nitrificare; 3.-asimilare de catre plante; 4.-amonificare; 5.-denitrificare, 6.-precipitatii continand nitrati (acid azotic in ploi acide), (O'Neill, P. 1993).
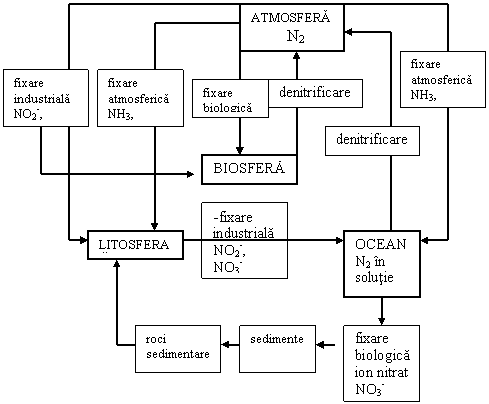
Fig 6.6 Ciclul azotului
Fixarea azotului apare de asemenea in arderea combustibililor fosili, cand N2 si O2 sunt amestecate la temperaturi inalte. Alaturi de oxidul nitric (NO) si bioxidul de azot (NO2) sunt produse prin ardere CO2 si H2O. Eliberate in atmosfera aceste gaze (NO) si (NO2) se combina cu vaporii de H2O cu producerea acidului azotos (HNO2) si a acidului azotic (NHO3) care reactioneaza cu suprafata solului sau a oceanului prin precipitatii si furnizeaza ioni de NO2- si NO3- biosferei. Oxizii de azot sunt produsi prin doua surse: 1.- industrial; 2.- de catre puterea electrica si arderea motoarelor. Oxizii de azot sunt importanti ca si poluanti. Fixarea industriala, fertilizarea si oxidarea prin ardere transforma peste 85% din azot asa cum fac toate organismele fixatoare de azot. Cantitati mici de azot sunt de asemenea adaugate prin fixarea atmosferica si aditie juvenila. Fixarea atmosferica apare numai in timpul descarcarilor electrice cand temperaturile ridicate si presiunile create de catre arc permite oxidarea N2 la NO si NO2 care reactioneaza cu nitratii si nitritii din pamant. Aceste procese contribuie la fixarea unei mici cantitati de azot in fiecare an. O cantitate mica de NO si NO2 este produsa prin vulcanism.
In analiza ciclului azotului de o importanta deosebita este ca fixarea este depasita de denitrificare si astfel azotul folosibil este acumulat in stratul viu. Excesul din fixare este produs prin activitatea umana (activitatea industriala si utilizarea fertilizatorilor ca hrana pentru plante).
Cel mai mult din excesul de azot este transportat in rauri si lacuri si apoi in ocean.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








