
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Chimie
|
|
Qdidactic » didactica & scoala » chimie Ortofosfati de amoniu - proprietati |
Ortofosfati de amoniu - proprietati
ORTOFOSFATI DE AMONIU
I. PROPRIETATI [1-5]
Acidul fosforic prin reactia cu amoniacul formeaza fosfatii mono, di si triamoniacali. Principalele proprietati ale ortofosfatilor de amoniu sunt prezentate in tabelul 8 [1-3, 6-8 ].
Tabelul 8. Proprietatile ortofosfatilor de amoniu
|
Proprietati |
NH4H2PO4 |
(NH4)4HPO4 |
(NH4)3PO4 |
|||||
|
Continut, % |
N |
12,17 |
21,19 |
28,6 |
||||
|
P2O5 |
61,71 |
53,76 |
48,3 |
|||||
|
Raport masic N:P2O5 |
1:5,1 |
1:2,5 |
1:1,7 |
|||||
|
Solubilitate la 25 C, g / 100 g H2O |
40 |
69,5 |
17,7 |
|||||
|
Masa specifica la 19 C, Kg / m3 |
1803 |
1619 |
|
|||||
|
pH-ul (solutie 0,1 M) |
4,4 |
7,8 |
9,4 |
|||||
|
Habitus cristalin |
tetragonal |
monoclinic |
ortorombic |
|||||
|
Presiunea partiala a NH3, Pa |
100 C |
|
667 |
85600 |
||||
|
125 C |
6,67 |
3990 |
157000 |
|||||
|
Caldura specifica, KJ / Kmol gr |
142,35 |
182,13 |
|
|||||
|
Temperatura de topire, C |
190,5 |
se descompun |
||||||
|
Caldura de topire, KJ / Kmol |
35700 [9] |
|
|
|||||
|
Caldura de formare, KJ / Kmol
|
98390 |
187150 |
252880 |
|||||
Studiile efectuate asupra stabilitatii termice a fosfatului monoamoniacal au aratat ca procesul de descompunere incepe la 132-135 C [10, 11]. Pana la temperatura de topire nu au loc modificari esentiale in compozitia chimica a produsului. In acest interval de temperatura are loc reactia:
2NH4H2PO4 = (NH4)2H2P2O7 + H2O
Odata cu aparitia topiturii, incepe descompunerea treptata a fosfatului monoamoniacal [12]. La temperaturi pana la 250 C, fosfatul se descompune dupa reactiile [13]:
2NH4H2PO4 = NH4H3P2O7 + NH3 + H2O
2NH4H2PO4 = (NH4)2H2P2O7 + H2O
Descompunerea are loc, in proportie mare, in intervalul de temperatura 275-400 C [14], cand au loc reactiile de baza [13]:
NH4H2PO4 + NH4H3P2O7 = NH4H4P3O10 + NH3 + H2O
NH4H2PO4 + NH4H4P3O10 = NH4H5P4O13 + NH3 + H2O
La temperaturi mai mari de 400 C, procesul de descompunere se incetineste si compozitia produsului tinde spre metafosfat [14, 15].
Fosfatul diamoniacal, la 70 C, pierde amoniac si se transforma in fosfat monoamoniacal.
Fosfatul triamoniacal se descompune in aer, la 30-40 C. Din aceasta cauza, prezinta importanta industriala doar fosfatii mono si diamoniacali.
Presiunea de vapori a amoniacului deasupra sarurilor solide, in conformitate cu reactiile de descompunere, poate fi determinata dupa cum urmeaza [16]:
NH4H2PO4 (cristalin) = NH3 (g) + H3PO4 (amorf)
p = 0,05 mm Hg la 125 C;
(NH4)2HPO4 (cristalin) = NH3 (g) + NH4H2PO4 (cristalin)
![]()
(NH4)3PO4 (cristalin) = NH3 (g) + (NH4)2HPO4 (cristalin)
![]()
unde:
p - presiunea amoniacului, mm Hg;
T - temperatura, K.
Presiunea de vapori deasupra fosfatului triamoniacal, la cca. 63 C, devine egala cu presiunea atmosferica (figura 38) [17].
Caldura specifica medie si absoluta pentru fosfatul monoamoniacal, in intervalul de temperatura 25-192 C, se poate calcula cu relatiile [18]:
Cp = 0,4743 + 0,283 · 10-4 · (T + 298) - 63,45 · T-1
Cp = 0,4743 + 0,566 · 10-4 · T - 18918 · T-2
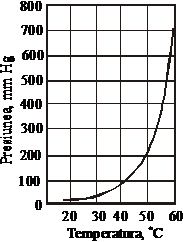
F Figura 38. Presiunea de vapori la disocierea
(NH4)3PO4
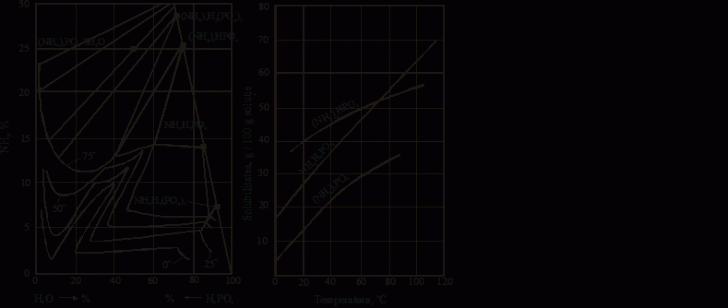
Figura 39. Izotermele de solubilitate in sistemul Figura 40. Curbele de solubilitate in apa a
NH3-H2O-H3PO4 fosfatilor de amoniu
Diagrama de solubilitate in sistemul NH3-H2O-H3PO4 (figura 39) [19] indica existenta a patru saruri anhidre: (NH4)7H2(PO4)3, (NH4)2HPO4, NH4H2PO4, NH4H5(PO4)2 si o sare trihidrata: (NH4)3PO4 3H2O.
Fosfatii de amoniu sunt solubili in apa (figura 40) [16].
Din diagrama rezulta ca solubilitatea fosfatului monoamoniacal creste mult mai mult cu ridicarea temperaturii, decat solubilitatea fosfatului diamoniacal. La 75 C solubilitatea in apa a celor doua saruri este egala, iar peste aceasta temperatura solubilitatea fosfatului monoamoniacal devine mai mare.
Diagrama de solubilitate in sistemul NH4H2PO4-H2O este data in figura 41, iar diagrama de solubilitate in sistemul (NH4)2HPO4-H2O in figura 42 [7, 20].
In intervalul 0-100 C, fosfatul monoamoniacal nu formeaza hidrati. In intervalul de temperatura de la -6,5 C la 16,5 C, fosfatul diamoniacal cristalizeaza ca dihidrat. La -6,5 C cristalizeaza un amestec eutectic fosfat diamoniacal - gheata, ce contine 29,6% (NH4)2HPO4 2H2O. In domeniul metastabil (delimitat de linia punctata) cristalizeaza, la -9,5 C, un eutectic format din (NH4)2HPO4 si gheata, ce contine 35% (NH4)2HPO4.
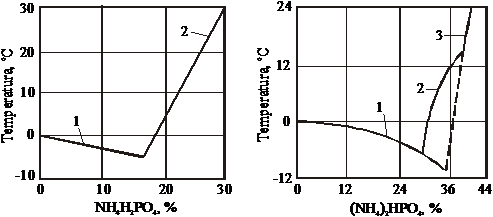
Figura 41. Solubilitatea in sistemul Figura 42. Solubilitatea in sistemul
NH4H2PO4-H2O (NH4)2HPO4-H2O
1 - gheata; 2 - NH4H2PO4 1 - gheata; 2 - (NH4)2HPO4 2H2O;
3 - (NH4)2HPO4
Solutiile apoase de fosfat diamoniacal prezinta o presiune de vapori mult mai mare decat produsul solid, deoarece in aceste conditii se formeaza amoniac liber si solutie nesaturata de fosfat monoamoniacal [21]:
(NH4)2HPO4=
2![]() +
+ ![]()
![]() + H2O =
+ H2O = ![]() +
+ ![]()
![]()
![]() = NH3 + H2O
= NH3 + H2O
(NH4)2HPO4 = NH3 + NH4H2PO4
De exemplu, presiunea de vapori a amoniacului deasupra solutiilor saturate este de 100 de ori mai mare decat deasupra sarii solide la 25 C. Pentru calculul presiunii de vapori deasupra solutiilor de fosfat de amoniu, in functie de temperatura si compozitia solutiei, se poate utiliza relatia [22]:
![]()
unde:
p - presiunea partiala a amoniacului, mm Hg;
x - raportul molar NH3:H3PO4 in solutie;
T - temperatura, K.
Diagrama din figura 43 permite sa se determine densitatea si temperatura de fierbere a solutiilor de fosfat monoamoniacal (liniile de presiune constanta in functie de concentratie [7].
In figura 44 se da conductibilitatea electrica a solutiilor apoase de fosfat monoamoniacal, in functie de concentratie, la diferite temperaturi [23].
Fosfatii mono si diamoniacali sunt putin higroscopici. Higroscopicitatea lor creste brusc odata cu marirea aciditatii produsului. Prin urmare, este necesar ca la uscare sa se evite pierderile de amoniac [24]. Capacitatea de aglomerare a fosfatilor de amoniu este influentata de impuritatile continute in acidul fosforic utilizat la obtinere. Gradul de defluorurare a acidului fosforic este unul din factorii determinanti ce micsoreaza tendinta de aglomerare [25].
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








